articol de revizuire
leucemie-pentru medicul generalist
leucemie pentru medicul generalist
Rafael Hurtado Monroya, Braulio Solano Estradab, Pablo Vargas Viverosc
șef al Departamentului de Hematologie. Spitalul nr. Mexic, DF. Adresa de Email: [email protected]
B Medicină Internă. Spitalul nr. Mexic. DF.
C Medicină Internă. Spitalul nr. Mexic. DF.
primit: 17 octombrie 2011
acceptat: 07 ianuarie 2012
introducere
în ciuda marilor progrese moleculare și terapeutice în studiul leucemiilor, aspectele de bază ale acestei afecțiuni nu sunt încă cunoscute în mod clar de către non-hematolog, astfel încât obiectivul acestei lucrări este de a oferi informații fundamentale studenților medicali și medicilor în general și care permite, mai presus de toate, obținerea de cunoștințe generale despre leucemii, diagnosticarea lor în timp util și căutarea unei referințe timpurii cu hematologul.

definiție
leucemia este termenul folosit pentru a defini un grup de boli maligne ale sângelui. Diagnosticul precoce este esențial, deoarece va permite pacientului să meargă devreme cu specialistul în hematologie, care va conduce procesul de diagnostic și va oferi tratamentul specific. Se caracterizează prin faptul că are o proliferare clonală, autonomă și anormală a celulelor care dau naștere restului celulelor normale ale sângelui (comportamentul tumorii în general).
aceasta implică faptul că o celulă timpurie suferă o schimbare genetică care va determina o clonă anormală (colonie) în sine să apară necontrolat. Această producție anormală este dezordonată, deoarece celulele anormale se înmulțesc după chipul și asemănarea lor, astfel încât ocupă treptat spațiul măduvei osoase normale și provoacă anemie progresivă, sângerare anormală și predispoziție la infecții. Pe de altă parte, atunci când celulele anormale invadează alte țesuturi, va exista o defecțiune a funcționării organului în cauză, de exemplu, infiltrarea în sistemul nervos central care apare în leucemia limfoblastică acută (LAL) s-ar putea manifesta cu dureri de cap, convulsii, modificări motorii concentrate, presiune intracraniană crescută și eșecul de a face un diagnostic precoce și de a oferi un tratament adecvat, va prezenta pierderea funcției și consecințe ireversibile.
manifestări clinice
tabloul clinic este divers și depinde de tipul de leucemie: acută sau cronică, cu toate acestea pentru 2 există manifestări clinice nespecifice (care apar în orice boală):
1. Oboseală.
2. Oboseală ușoară.
3. Slăbiciune generalizată.
4. Dorește să rămână odihnit sau în pat.
5. Este nevoie de ajutorul cuiva pentru a vă satisface nevoile personale.
leucemiile cronice sunt indolente și până la 50% din cazuri sunt descoperite într-o analiză clinică sau de laborator de rutină la voluntari care sunt considerați sănătoși și vin să doneze sânge, cu toate acestea, pe măsură ce boala progresează, sunt prezentate manifestări nespecifice, dar acum sunt specifice (Tabelul 1).

în formele acute, manifestările specifice sunt derivate din deficiența uneia dintre liniile celulare:
1. Eritrocite: sindromul anemic a cărui intensitate va depinde de gradul de hipoxemie, indiferent de gradul de anemie. Dispneea efortului mediu până la ortoprea.
2. Trombocite: petechii, echimoze la extremități și, în cazuri generalizate mai severe, hemoragie uscată și umedă cu epistaxis, gingivoragie, hematurie, mane sau hematochezie. Foarte severă în sistemul nervos central (SNC).
3. Leucocite: febră, diaforeză, infecții localizate până la septicemie sinceră (bacterii sau ciuperci). Acestea apar cu neutropenie mai mică de 250 de neutrofile totale / mm3.
sindromul infiltrativ: se referă la implantarea anormală în orice țesut, deși este comună:
1. Hepatomegalie sau splenomegalie (Figura 5).
2. Adenomegalie (locală sau generalizată).
3. Ten leucemic.
4. Durere osoasă din expansiunea măduvei osoase.
5. Țesuturi moi (sarcom granulocitar).
6. Testicul.
7. SNC.
8. Gume și orice site (figura 1).

tulburări metabolice: acestea rezultă din hiperproducția anormală a celulelor maligne și creșterea apoptozei.
1. Acidoză.
2. Creșterea lacto-dehidrogenazei (LLD).
3. Hiperkaliemie.
4. Hiperuricemie.
5. Creșterea numărului de microglobulină de la numărul de centimetri2.
dovezile clinice predomină ca piatră de temelie a diagnosticelor suspectate de leucemii acute și de orice afecțiune, dar ceea ce urmează este completarea diagnosticului cu sprijinul laboratorului clinic în hemograma completă a citometriei sau special, adică observarea aprofundată a frotiului de sânge periferic de către personalul tehnic care pregătirea în identificarea celulelor anormale, în special a leucemiei.

modificările de laborator care necesită o examinare specială includ:
1. Anemie (orice grad).
2. Leucopenie sau leucocitoză (predominanța unei linii celulare).
3. Trombocitopenie.
4. Combinații: bicitopenie sau pancitopenie.
trebuie acordată o atenție deosebită când Laboratorul raportează prezența leucocitelor sau a limfocitelor atipice (pot fi blaști leucemici). Este recomandabil să solicitați o revizuire a experților (Figura 2).

aspirația măduvei osoase este esențială pentru diagnostic (Figura 3) și 20% din explozii sunt necesare pentru a stabili criteriile pentru leucemia acută în oricare dintre soiurile sale.

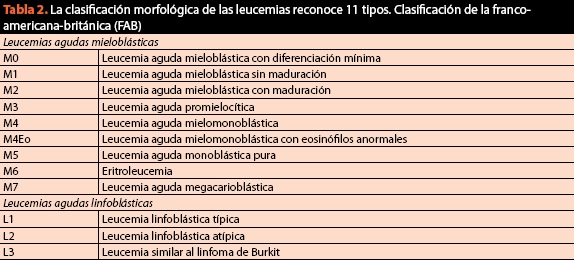
în aceeași procedură trebuie obținute probe pentru clasificarea finală a afecțiunii și solicitarea cariotipului și imunofenotipului, deoarece în prezent criteriul citomorfologic este de o importanță vitală, dar nu mai este suficient. Clasificarea actuală și actuală a bolilor maligne de sânge este prezentată în tabelul 2.
tratamentul vizează 2 aspecte importante: primul dintre ele este antileucemic specific și se bazează pe utilizarea medicamentelor de origine chimică cunoscute sub numele de chimioterapie, al căror obiectiv principal este eradicarea, adică eliminarea tuturor celulelor leucemice din organism. Al doilea aspect al tratamentului este sprijinul pentru complicațiile care apar de obicei la pacienți la admitere.
tratamentul vizează 2 aspecte importante: primul dintre ele este antileucemic specific și se bazează pe utilizarea medicamentelor de origine chimică cunoscute sub numele de chimioterapie, al căror obiectiv principal este eradicarea, adică eliminarea tuturor celulelor leucemice din organism.
al doilea aspect al tratamentului este suportul pentru complicațiile pe care pacienții le prezintă de obicei la internare, cum ar fi:
1. Anemie.
2. Sângerări anormale.
3. Infecții pulmonare și generalizate, printre altele (Figura 4).
4. Orice alte complicații adiacente pe care pacientul le poate avea (comorbiditate), cum ar fi afecțiuni preexistente, de exemplu diabet, hipertensiune arterială, boli de inimă și alte boli frecvente în rândul pacienților care suferă de leucemie.


prin urmare, este foarte important să se ia în considerare faptul că tratamentul împotriva leucemiei este multidisciplinar, implicând participarea altor specialiști, cum ar fi sprijinul pentru hematolog.
tratamentul Antileucemic va fi, de asemenea, diferit pentru diferite tipuri de leucemie și pentru forme acute. Acesta este împărțit în 3 faze:
1. Inducerea remisiunii. Scopul este de a obține o remisiune completă (CR), adică normalizarea valorilor sanguine ale pacientului, absența oricăror simptome sau semne că leucemia persistă cu infiltrare. În timpul procesului, pacientul ar trebui să aibă o „stare fără leucemie” în măduva osoasă, iar viitorul ar trebui să fie recuperarea la o hematopoieză normală și, din păcate, în alte cazuri, se recuperează cu boala, care vorbește despre leucemie rezistentă al cărui prognostic este teribil. Acest prim proces poate dura 6 până la 8 săptămâni pentru a realiza CR.
2. Consolidare. Aceasta implică utilizarea acelorași medicamente care au fost utilizate în inducerea sau combinarea altor chimioterapice, de asemenea, în scopul urmăririi eradicării celulelor maligne reziduale care ar putea dezvolta rezistență la cele de primă utilizare.
3. Întreținere. Se preferă menținerea pacientului sub efectul chimioterapiei înainte de posibilitatea activității leucemice incipiente și că, odată cu tratamentul, acesta își menține efectul până la dispariția bolii.

până în prezent, pentru formele acute, cele mai stricte criterii de luat în considerare CR devin mai complexe, deoarece cel mai bine este să căutați remisie moleculară, care implică căutarea modificării cromozomiale inițiale așa cum apare în cazul leucemiei promielocitare (M3-FAB) cu t (15;17) inițial, trebuie căutat studii moleculare și citogenetice specifice, în ciuda faptului că se află în CR, deoarece dacă translocarea persistă, tratamentul agresiv trebuie continuat până la eliminarea totală a clonei. Această varietate de leucemie ar trebui considerată ca fiind potențial vindecabilă și este una dintre cele mai frecvente în populația Latină.
vindecarea bolii va depinde apoi de eliminarea tuturor celulelor maligne existente la pacient. În general, unele leucemii pot fi susceptibile de a se vindeca numai cu chimioterapie, dar astăzi trebuie acordată o mare importanță așa-numiților factori prognostici care se bazează pe modele matematice care permit pacienților să fie plasați în gradul de prognostic pe care îl au și includ:
1. Tipul de leucemie.
2. Modificarea moleculară inițială și persistența acesteia în ciuda tratamentului sau eradicării.
3. vârsta. Pacienții cu vârsta peste 60 de ani au un prognostic slab în comparație cu pacienții mai tineri.
4. Chimioterapie. Medicamentele indicate și, mai ales, dozele recomandate trebuie utilizate. De exemplu, la LAL adult, utilizarea schemei Hipercivad (doze crescute de ciclofosfamidă, vincristină, adriamicină, dexametazonă în asociere cu citozină arabinozidă și metotrexat) atinge 90% CR și cure în 50% din cazuri, date care nu au fost văzute anterior cu alte scheme. Acest tratament este toxic și necesită utilizarea acestuia numai în instituții care dispun de resurse suficiente de sprijin. Din păcate, în mediul nostru nu toate centrele au medicamentele recomandate, iar rezultatele nu vor fi reproductibile, deoarece nu au suficient sprijin pentru pacient în timpul fazei de mielosupresie maximă.
5. Terapie de susținere. Realizările chimioterapiei și a noilor medicamente, noi combinații și cu mai multă specificitate obligă implementarea echipelor multidisciplinare cu adresa hematologului; instalarea și utilizarea cateterelor venoase centrale; suport pentru banca de sânge pentru susținerea transfuziilor de trombocite și eritrocite (chiar și produsele stelate); intervenția infectologului pentru detectarea infecțiilor și utilizarea adecvată a antibioticelor sau a agenților antifungici, fie profilactici, fie terapeutici, dacă este necesar; furnizarea de camere de izolare cu servicii de întreținere și intendent care permit realizarea unui mediu fără bacterii, inclusiv hrănirea sterilă; un laborator cu protocol de gestionare a probelor pacientului în protocoale de tratament specifice și gestionarea probelor speciale (prepararea concentratelor de leucocite în citometria hematică a stratului buffy și obținerea unei lecturi optime); zona de pregătire a medicamentelor foarte specializate și, pe de altă parte, cel mai important este personalul medical, auxiliar și administrativ, care cu întregul grup sunt așteptate rezultatele pe care le au în alte țări.
6. Transplant de măduvă osoasă (MO). Este un tip de tratament complex și cu costuri ridicate, care necesită un donator mo compatibil și o stare inactivă, cu o probabilitate mare de recidivă precoce sau tardivă sau, cu factori de prognostic slab. Este o procedură cu tendințe mai curative, deoarece folosește megadoze de chimioterapie pentru a eradica celulele leucemice, dar în încercare, eradică și precursorii normali și este necesară înlocuirea unei noi măduve normale compatibile. Tipul alogen (frate compatibil identic) Este cea mai bună selecție, deoarece receptorul acceptă numai prin identitate parțială (singura acceptare totală sunt gemenii identici) și, prin urmare, are ca rezultat o respingere a bolii grefă-contra-gazdă, care la rândul său duce la grefă-contra-leucemie și crește eradicarea clonelor leucemice, cu toate acestea, în cazurile severe ale sindromului (gradele 3-4) morbiditatea și mortalitatea sunt crescute în ciuda manipulării specifice.
leucemii cronice
1. Leucemie limfocitară cronică. Apare mai frecvent la persoanele în vârstă, iar criteriul este persistența limfocitozei mai mari de 10 x 109/l și MO cu infiltrarea a mai mult de 50% din limfocitele cu fenotip CD5+. Criteriul de tratament este duplicarea contului de limfocite într-un an sau progresia adenomegaliei sau splenomegaliei, deși unele cazuri dincolo de acest standard prin prezența anemiei hemolitice sau trombocitopeniei, autoimune, și apoi a indicat tratamentul bazat pe combinația de fludarabină, ciclofosfamidă și prednison, în stadiile I și II doar somenter și evoluția observată și așteptată fără tratament.
2. Leucemie mieloidă cronică (LMC). În această boală există un mare progres în cunoașterea prezenței cromozomului Philadelphia, care a fost descris în 1950 în orașul Uniunii americane și că începutul său a fost primul cromozom marker în asociere cu malignitate, totuși de-a lungul anilor de cercetare, am reușit să cunoaștem t(9;22) cu expresia funcțională a cromozomului cu producerea unei oncoproteine cu mare activitate de tirokinokinază, care crește proliferarea celulelor și care, la rândul său, explică leucocitoza și trombocitoza mare cu care acești pacienți prezintă, precum și Marea splenomegalie (Figura 5).
În acest moment, au trecut 10 până la 12 ani de la descoperirea unei molecule mici direcționate în mod specific împotriva acestui substrat molecular donator de fosfat pentru reglarea internă a celulei leucemice și a substraturilor sale. Denumit inițial its (signal transduction inhibitor) a produs inhibarea competitivă a fosforilării, a condus la apoptoza celulară, iar pacienții au obținut rezultate clinice nemaivăzute până acum cu remisiuni moleculare de până la 80-90% la 10 ani, ceea ce a schimbat dramatic istoricul natural al bolii, cu pre-tratamentul nu a fost mai mare de 3 ani. Aceste informații fac o schimbare în istoria naturală și prognosticul bolii, anterior fatală pe termen scurt.

aceste exemple sunt o bază a progresului atât de intens care a avut loc în ultimii ani și că este de dorit să se permită provoca interesul studenților la medicină, profesorii lor, dar mai ales a autorităților educaționale ale leucemiei în general, care ocupă primele 5 locuri ale frecvenței bolii maligne a adultului și a primelor locuri la copii, astfel încât hematologia să fie inclusă în disciplinele de bază în curriculum-ul carierei de Medicină și medicină, dar și în chiar și ca parte a cursurilor specializare postuniversitară.
deși utilă pentru simplitatea sa, clasificarea Franco-americană britanică (FAB) poate duce la erori de diagnostic și, prin urmare, terapeutice în până la 20% din cazuri. Din acest motiv, clasificarea prin metode de imunohistochimie și biologie moleculară a devenit o cerință sine qua non pentru clasificarea corectă și gestionarea ulterioară a pacienților (Figura 6).

spre deosebire de clasificarea FAB, OMS (tabelul 2) reflectă o schimbare în paradigma prin care înțelegem la boli sânge, deoarece pentru prima dată a combinat informațiile genetice, morfologice, citochimice și imunofenotipice cu constatările clinice în cadrul algoritmilor de diagnostic ai neoplasmelor țesutului hematopoietic; importanța relativă a fiecărui criteriu diferă între neoplasme și nu există un „standard de aur” pentru clasificarea tuturor malignităților hematologice. Obiectivul a fost de a defini entități care ar putea fi recunoscute de patologi și care au relevanță clinică. De la apariția sa în 2001, au fost făcute diferite revizuiri pentru a-și actualiza conținutul în raport cu cele mai actuale descoperiri. Ultima revizuire a fost din 2008 și clasifică malignitățile hematologice după cum urmează:
1. Neoplasme mieloide.
2. Neoplasme limfoide.
3. Mastocite sau boli ale celulelor grase.
4. Bolile celulelor histiocitare și dendritice.

neoplazice mieloide
neoplasmele mieloide sunt derivate din progenitori din măduva osoasă, se diferențiază în eritrocite, granulocite (neutrofile, bazofile și eozinofile), monocite și megacariocite. Clasificarea FAB recunoaște 3 categorii principale:
1. Leucemie mieloidă acută.
2. Sindroame mielodisplazice.
3. Neoplasme mieloproliferative.
cei mai importanți determinanți ai categoriilor recunoscute utilizând morfologice, histochimice și imunofenotipice și procentul de celule blastice, linia celulară și gradul de diferențiere a celulelor neoplazice (figura 7). În ultimii ani, caracteristicile genetice (citogenetice și moleculare), precum și pre-tratamentul și evoluția mielodisplaziei, au arătat un impact semnificativ asupra comportamentului clinic al acestor suferințe, care nu se corelează întotdeauna bine cu categoriile FAB, astfel încât dezbaterea centrală pentru reclasificare a fost discriminarea între entități și factorii prognostici patologici, pentru a realiza o clasificare cu relevanță și semnificație clinică pentru patolog. Unele anomalii genetice par să definească diferite boli, în timp ce altele reprezintă factori de prognostic pentru o anumită boală.

în prezent, clasificarea OMS grupează condițiile mieloide în 4 grupe principale:
1. Bolile mieloproliferative
2. Sindroame mielodisplazice
3. Boli mielodisplazice/ mieloproliferative
4. Leucemii mieloide Acute

bolile mieloproliferative sunt un grup de tulburări clonale asociate cu proliferarea uneia sau mai multor linii mieloide. Devine din ce în ce mai clar că aceste boli sunt adesea asociate cu mutații care determină creșteri anormale ale activității tirozin kinazei și proliferarea celulelor progenitoare independente de factorul de creștere în măduva osoasă. Procentul de explozii din măduva osoasă este normal sau ușor ridicat, dar întotdeauna mai mic de 20%. Hematopoieza este de obicei eficientă, rezultând o creștere a numărului uneia sau mai multor celule mature din sângele periferic. Prototipul neoplasmelor mieloproliferative este leucemia mieloidă cronică cu cromozom Philadelphia pozitiv (Ph1) (BCR/ABL). Celelalte entități incluse sunt:
1. Policitemia vera.
2. Mielofibroza idiopatică.
3. Trombocitemie esențială primară.
4. Leucemie eozinofilă cronică.
5. Leucemie neutrofilă cronică.
6. Mastocitoză.
7. Neoplasme mieloproliferative neclasificabile.

sindroamele mielodisplazice se referă la tulburări caracterizate prin producție celulară ineficientă și displazie, cu risc variabil de transformare în leucemie acută. Celularitatea în măduvă este adesea crescută, dar foarte variabilă. Există maturizare, dar și displazie a uneia sau mai multor linii mieloide. Hematopoieza nu este eficientă și, prin urmare, există citopenii. Acest articol include:
1. Citopenie refractară cu displazie de o linie*.
• anemie refractară.
• neutropenie refractară.
• trombocitopenie refractară.
2. Anemie refractară cu sideroblaste inelare.
3. Citopenie refractară cu displazie de linii multiple.
4. Anemie refractară cu explozii excesive.
5. Sindromul mielodisplazic cu d (5q).
6. Sindromul mielodispastic neclasificabil.
7. Sindromul mielodisplazic juvenil include o entitate provizorie cunoscută sub numele de citopenie refractară juvenilă.
sindroamele mielodisplazice / mieloproliferative includ tulburări în care coexistă caracteristici displazice și proliferative. Acest grup include leucemia juvenilă mielomonocitară, care este reprezentativă pentru ambele sindroame (mielodisplazice și mieloproliferative). Aproape jumătate dintre pacienți prezintă un număr normal sau scăzut de neutrofile și displazie a mai multor linii celulare fără organomegalie și măduvă osoasă cu morfologie asemănătoare anemiei refractare cu explozii în exces, dar cu monocitoză. Alți pacienți au neutrofilie severă, monocitoză și splenomegalie. Nu se știe încă dacă sunt 2 boli diferite, un mielodisplazic și un mieloproliferativ; cu toate acestea, până în prezent nu există diferențe în anomaliile citogenetice sau în modelele de creștere ale coloniilor in vitro sau în evoluția lor clinică, deci există controverse între clinicieni și patologi în funcție de locul lor în cadrul clasificării. Conform ultimei revizuiri, în această categorie se află:
1. Leucemie mielomonocitară cronică.
2. Leucemie mieloidă cronică atipică (BCR/ABL negativ).
3. Leucemie mielomonocitară juvenilă.
4. Sindromul mielodisplazic / mieloproliferativ nu poate fi clasificat.
în categoria leucemiilor acute mielobloktastikas (LAM) (care este definit de un procent mai mare de 20% mieloblaste în măduva osoasă sau sânge mai subțire periferic, sau prezența unei anomalii citogenetice, în special, în ciuda contul de explozii) recunoaște următoarele grupuri:
1. LAM cu translocații citogenetice recurente.
2. LAM cu caracteristici mielodisplazice.
3. LAM și MDS legate de tratamentele antineoplazice.
4. Nu pot fi clasificate.
5. Sarcom mieloid.
6. Proliferări mieloide legate de sindromul Down.
7. Neoplasmul Blastic Plasmacitoid al celulelor dendritice.
neoplasmele limfoide
sunt cele care provin din celule care se dezvoltă în mod normal în limfocite T (LT citotoxice, colaboratori sau regulatori) sau limfocite B (limfocite sau celule plasmatice). În general, neoplasmele limfoide sunt împărțite în cele derivate din precursori limfoizi și cele din limfocite mature și celule plasmatice și sunt ulterior grupate în funcție de descendența lor (B sau T).
Din punct de vedere istoric, neoplasmele limfoide care apar în măduva osoasă și implică măduva osoasă au fost separate de cele care se prezintă ca o tumoare (limfom). Cu toate acestea, acum se știe că orice limfom poate prezenta caracteristici clinice ale leucemiei și că orice leucemie poate prezenta ocazional ca o tumoare (sarcom granulocitar). În clasificarea OMS, diagnosticul mai multor neoplasme limfoide depinde nu numai de localizarea anatomică a celulelor tumorale, ci și de originea morfologică definită a celulei tumorale. Aceste considerații au anulat relevanța Termenilor L1 și L2 din clasificarea FAB, deoarece nu se corelează cu imunofenotipul lor, anomaliile genetice sau cu evoluția lor clinică (figura 8). L3 este echivalent cu limfomul Burkitt în faza leucemică și ar trebui diagnosticat ca atare.

1. Neoplasme precursoare. Există un consens că neoplasmele precursoare care se prezintă ca tumori solide și cele care implică măduva osoasă și sângele sunt biologic aceeași boală cu prezentări clinice diferite. Majoritatea neoplasmelor limfoide precursoare sunt prezentate ca leucemii, deci s-a convenit ca clasificarea să păstreze termenul LAL pentru faza leucemică a neoplasmelor precursoare de tip B și T. Există 2 categorii principale:
• leucemii / limfoame precursoare B.
• leucemii/limfoame precursoare T.
2. Neoplasme cu celule B Mature. Clasificarea propusă ia în considerare limfoamele și leucemiile de același tip de celule ca aceeași boală cu diferite prezentări clinice sau etape. Bolile specifice derivate din celulele B mature sunt următoarele:
1. Leucemie limfocitară cronică / limfom limfocitar mic.
2. Limfom limfoplasmacitic.
3. Limfom cu celule de manta.
4. Leucemie cu celule B prolimfocitare.
5. Limfom folicular.
6. Limfom difuz cu celule mari B.
• limfom Intravascular cu celule mari B.
• limfom mediastinal primar cu celule mari B.
• limfom cu celule mari B (legat de virusul Epstein Barr-EBV).
•• limfom cu celule B mari bogate în histiocite și celule T.
* limfom cu celule B difuze ale sistemului nervos central.
• * limfom cutanat primar difuz cu celule B mari.
• limfom difuz cu celule B mari la vârstnici pozitiv pentru EBV.
• limfom Pasmablastic.* limfom pleural primar•
• * limfom cu celule mari cu Alkom pozitiv (ALK).* limfom Burkitt•
7. Limfom cu celule B din zona marginală.
8. Limfom cu celule B din zona marginală extranodală.
9. Limfom cu celule B din zona marginală splenică
10. Leucemie cu celule păroase.
11. Plasmocitom / mielom cu celule plasmatice.

neoplasme mieloide și limfoide
unele neoplasme exprimă markeri ai liniilor mieloide și limfoide.nediferențiate) sau caracteristicile prezente ale ambelor linii (fenotip mixt sau leucemie acută de linie mixtă).
Tabelul 3.Clasificaci de la OMS de las neoplasias mieloides y leucemias agudas
bibliograf XCA
Bassan R, Hoelzer D. terapia modernă a leucemiei limfoblastice Acute. J Clin Oncol. 2011;29:523-43.
Burnett a, Wetzler M, L Inktokswenberg B. progrese terapeutice în leucemia acută. J Clin Oncol. 2011;29:487-94.
Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. Clasificarea OMS din 2008 a neoplasmelor limfoide și nu numai: concepte în evoluție și aplicații practice. Sânge. 2011 12 mai; 117 (19):5019-32. Epub 2011 Februarie 7. Revizuire. Cortes J, Hochhaus A, Hugues T, Kantajian H. prima linie și terapii de salvare cu inhibitori de tirozin kinază și alte tratamente în leucemia mieloidă cronică. J Clin Oncol. 2011;29:524-31.
Chin-Hon Pui, Carroll WL, și colab. Biologie, stratificarea riscurilor și terapia leucemiei acute pediatrice: o actualizare. J Clin Oncol. 2011;29:551-65.
Gambacorti PC, Antolin L, Hurtado Mr.evaluarea independentă multicentrică a ourvenes la pacienții cu leucemie mieloidă cronică tratați cu Imatinib. Jurnalul Institutului Național Al Cancerului. 2011;103:1-9.
Grever M, Lozanki G. Strategii moderne pentru leucemia cu celule păroase. J Clin Oncol. 2011:29;583-90.
Gribben JG, O ‘ Brien S. actualizare privind terapia leucemiei limfocitare cronice. J Clin Oncol. 2011;29:544-50.
Hurtado dl, Vargas VP, Cortes FJ. Leucemie Mieloidă Cronică. Concepte actuale în Fiziopatologie și tratament. Cancerolog de la SEC. 2007:2:137-47.
Hurtado MR, Vargas VP, și colab. Imatinib comparativ cu Imatinib / citarabină pentru tratamentul de primă linie al leucemiei mieloide cronice precoce cu cromozom Philadelphia pozitiv. Rezultatele unui studiu clinic randomizat al Grupului mexican de leucemie colaborativă. Leucemie Clinică. 2008: 2(2);1128-32.
Lichtman MA. Clasificarea și manifestările clinice ale tulburărilor mieloide clonale. Williams. Hematologie. Mc Graw-Hill; 2010.
Marcucci G, Haferlach T, Dohner H. genetica moleculară a leucemiei mieloide acute adulte. Implicații prognostice și terapeutice. J Clin Oncol. 2011;29:475-86.
Rafael Hurtado M Mellado Y, Floresw RG, Pablo Vargas. Semiolog de la Citometru de la Semiximetrie de la Semiximetrie de la Semiximetrie. Rev Fac Med UNAM. 2010; 53:36-43.
Sanz m, Lo-Coco F. Abordări moderne pentru tratarea leucemiei Promielocitare Acute. J Clin Oncol. 2011;29:495-503.
notă
* displazie. Se referă la alterarea citomorfologică care include disocierea maturării nucleului-citoplasmă (amintiți-vă că maturarea cromatinei depinde de citoplasma ADN și ARN, prin urmare nucleul se oprește la maturare în timp ce citoplasma își continuă procesul normal) care produce celule neviabile și există apoptoză intramedulară.
