Găsiți surse: „single bond” – știri · Ziare · Cărți · savant · JSTOR (August 2012) (Aflați cum și când să eliminați acest mesaj șablon)
în chimie, o singură legătură este o legătură chimică între doi atomi care implică doi electroni de valență. Adică atomii împărtășesc o pereche de electroni în care se formează legătura. Prin urmare, o singură legătură este un tip de legătură covalentă. Când este partajat, fiecare dintre cei doi electroni implicați nu mai este în posesia exclusivă a orbitalului din care a provenit. Mai degrabă, ambii electroni petrec timp în oricare dintre orbitali care se suprapun în procesul de lipire. Ca structură Lewis, o singură legătură este notată ca a OQUA sau A-A, pentru care a reprezintă un element (Moore, Stanitski, și Jurs 329). În prima predare, fiecare punct reprezintă un electron partajat, iar în a doua predare, bara reprezintă ambii electroni împărțiți în legătura unică.

o legătură covalentă poate fi, de asemenea, o legătură dublă sau o legătură triplă. O singură legătură este mai slabă decât o legătură dublă sau o legătură triplă. Această diferență de rezistență poate fi explicată prin examinarea legăturilor componente din care constă fiecare dintre aceste tipuri de legături covalente (Moore, Stanitski și Jurs 393).
de obicei, o singură legătură este o legătură sigma. O excepție este legătura din diboron, care este o legătură pi. În schimb, legătura dublă constă dintr-o legătură sigma și o legătură pi, iar o legătură triplă constă dintr-o legătură sigma și două legături pi (Moore, Stanitski și Jurs 396). Numărul de legături componente este ceea ce determină disparitatea forței. Este evident că legătura unică este cea mai slabă dintre cele trei, deoarece constă doar dintr-o legătură sigma, iar legătura dublă sau tripla legătură constă nu numai din acest tip de legătură componentă, ci și cel puțin o legătură suplimentară.
legătura unică are capacitatea de rotație, o proprietate care nu este posedată de legătura dublă sau de legătura triplă. Structura legăturilor pi nu permite rotația (cel puțin nu la 298 K), astfel încât legătura dublă și legătura triplă care conțin legături pi sunt deținute datorită acestei proprietăți. Legătura sigma nu este atât de restrictivă, iar legătura unică este capabilă să se rotească folosind legătura sigma ca axă de rotație (Moore, Stanitski și Jurs 396-397).
o altă comparație a proprietății poate fi făcută în lungimea obligațiunii. Legăturile simple sunt cele mai lungi dintre cele trei tipuri de legături covalente, deoarece atracția interatomică este mai mare în celelalte două tipuri, duble și triple. Creșterea legăturilor componente este motivul acestei creșteri a atracției pe măsură ce mai mulți electroni sunt împărțiți între atomii legați (Moore, Stanitski și Jurs 343).
legăturile unice sunt adesea observate în moleculele diatomice. Exemple de această utilizare a legăturilor unice includ H2, F2 și HCl.
legăturile unice sunt observate și în moleculele formate din mai mult de doi atomi. Exemple de această utilizare a legăturilor simple includ:
- ambele legături în H2O
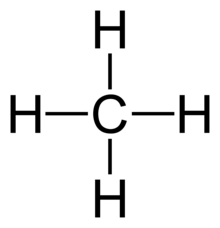
- toate cele 4 legături în CH4
legătura unică apare chiar și în molecule la fel de complexe ca hidrocarburile mai mari decât metanul. Tipul de legătură covalentă în hidrocarburi este extrem de important în Nomenclatura acestor molecule. Hidrocarburile care conțin numai legături simple sunt denumite alcani (Moore, Stanitski și Jurs 334). Numele moleculelor specifice care aparțin acestui grup se termină cu sufixul-ane. Exemplele includ etan, 2-metilbutan, și ciclopentan (Moore, Stanitski, și Jurs 335).