황 헥사 플루오 라이드 또는 SF6 는 무기,온실 가스입니다. 불연성,무취 및 무색이며 우수한 절연체입니다. 그것은 화학 애호가들 사이에서 대화의 흥미로운 주제였던 고가 8 면체 분자입니다.
Henri Moissan 은 SF6 의 존재를 발견했습니다. 덧붙여,그는 또한 불소의 발견 자입니다. SF6 을 합성하는 표준 방법은 S8 을 F2 에 노출시키는 것입니다. 이 방법의 대형을 일으키는 원인이 되는 몇 가지 유황 불화물,하지만 그를 통해 제거 될 수 있습 난방 및 다음 사용하는 NaOH 를 제거하는 추가 SF4 분자.
sf6 은 합성 직후에 사용할 수 없습니다. 모든 반응성 불화물을 제거하기 위해 정제해야합니다. 그 후에는 열분해를 거쳐야합니다.
여기에는 이 블로그 게시물에,우리는 배울 것입니다 루이스의 구조 SF6 고 결정하는 각도,분자 구조와 형태는 데 도움이 될 수 있는 이해의 물리적 특성을 이 분자입니다.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis 어떤 분자의 구조,우리는 먼저 원자가 전자의 총 수를 알아야합니다. 여기서 우리는 황과 불소 원자 모두에 대한 원자가 전자를 추가함으로써 SF6 에 대한 원자가 전자의 총 수를 알아낼 것이다.
총 수의 원자의 전자에서는 SF6–원자의 전자의 유황+원자의 전자의 불
황는 여섯 원자의 전자.
불소는 7 개의 원자가 전자를 가지고 있지만,이 분자에 6 개의 불소 원자가 있기 때문에이 숫자에 6 을 곱할 것입니다.
=6 + 7*6
=6+42
=48 원자의 전자
따라서 SF6 48 원자의 전자 도움이 될 것입니다 우리는 루이스 도 구조의 SF6.
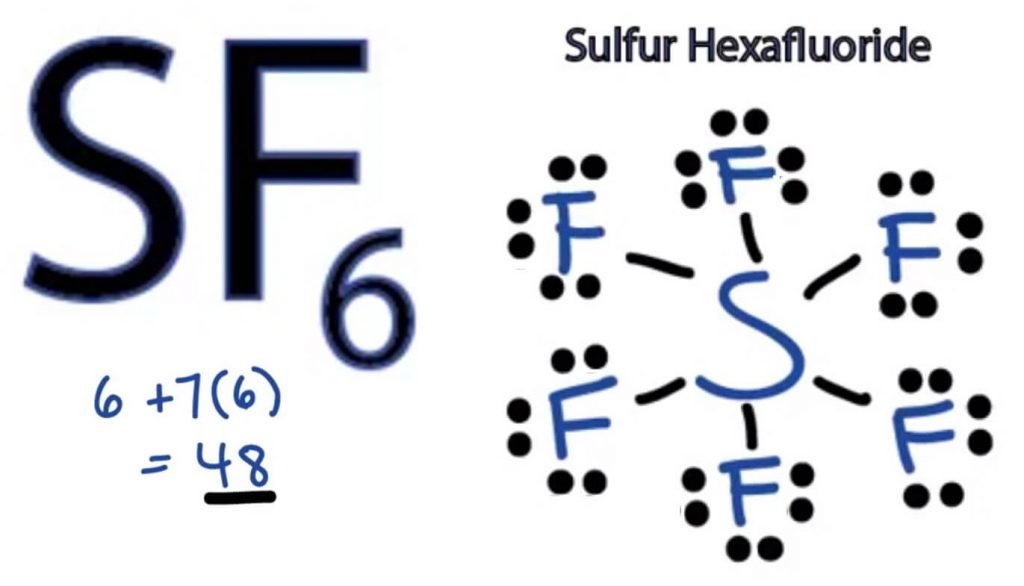
SF6 루이스 구조
루이스 점의 구조는 모든 분자는 그림 표현의 원자 참여를 형성하는 구조 및 개인 원자의 전자. 이 구조는 우리가 분자 내의 결합 형성과 그 안에있는 전자의 배열을 알도록 도와줍니다.
황 원자는 불소보다 전기 음성도가 적기 때문에 중심 위치를 취할 것입니다. 그래서에 센터와 모든 불소 원자 주변에는 이를 다음과 같이 설명합니다:
불소 원자 요구에만 하나의 원자를 완료 octet. 으로 모든 원자 다음과 같수 규칙을 달성하기 위해 안정된 구조,불소 원자를 공유 중 하나는 원자가 전자의 유황 atom. 따라서,유황을 공유 여섯 개의 그것의 원자의 전자와 함께 모든 불소 원자는 결과를 형성하는 여섯 단일채 S 과 F.
루이스 구조는 채권에 의한 구조물을 그리는 직선 사이에 두 개의 원자를 함유하고 있습니다. 그래서이 모든 결합은 48 개 중 12 개의 원자가 전자를 차지할 것입니다.
장소 남아있는 모든 원자의 전자 주위를 불소 원자를 확인하는 경우에는 옥텟의 모든 불소 원자는 완료합니다.
마치신 후에는,당신은 원자의 전자에서 외부의 껍질이 모두 불소 원자,그러나 황 8 개 이상의 전자에서 outer shell. 옥텟 역할에 대한 예외이며 더 많은 전자를 수용하기 위해 궤도를 확장 할 수 있기 때문입니다.
따라서 이것은 sf6 의 오른쪽 루이스 구조입니다.
SF6 교 잡
이제 우리가 알고 있는 루이스의 구조 SF6,우리는 지 결정하는 원자’교 잡에서 분자입니다. 여기서 유황이 불소 원자와 전자를 공유함에 따라,우리는 그 혼성화를 살펴볼 것입니다.
접지 상태에서 SF6 의 전자 구성은 3s23p4 입니다. 그러나 그것이 전자를 공유하고 여기 된 상태에있을 때 3s 와 3p 궤도 모두에서 전자쌍은 짝을 이루지 못한다. 이 전자들은 더 높은 빈 3 차원 인공 위성을 채우기 위해 움직입니다. 결과적으로 6 개의 하이브리드 오비탈이 형성됩니다(3s 중 하나,3p 중 3 개 및 2 개의 3d). 이 하이브리드 오비탈은 공유 전자를 수용하는 것입니다. 이 인공 위성은 황과 불소 원자가 결합을 형성 할 때 불소 원자의 2p 인공 위성과 중첩됩니다. 이 여섯 개의 인공 위성은 팔면체 모양의 여섯 방향에 있습니다.
따라서,황 헥사 플루오 라이드는 sp3d2 혼성화를 갖는다.
SF6 채권 각
으로 유황을 공유하는 원자의 전자과 6 불소 원자,우리가 볼 수 있는 여섯 개의 모든 전자의 유황 원자가 공유하는 형태다. F-S-F 의 결합 각은 90 도입니다.
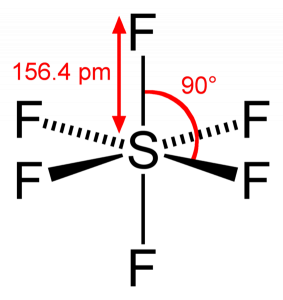
SF6 분자의 형상
볼 때 우리는 Sulphur Hexafluoride 분자,유황에서는 중앙 위치를 불소 원자 배열을 기준으로 대칭니다. 원자는 팔면체 패턴에 배치되어 SF6 의 분자 기하학이 팔면체가됩니다.
SF6 모양
보고분자의 형상을 분자,우리가 말할 수 있는 SF6 분자가 팔면체 형태로 그것은 여덟 측면입니다. 그러나 중심 원자는 6 개의 불소 원자와 결합하며 SF6 의 모양은 팔면체입니다.

SF6 극성입니까 비극성입니까?
SF6 는 비극성 분자입니다. 이 때문에 VSEPR 이론을 때 여섯 불소 원자는 배치 대칭 주위에 황 atom,채권 쌍극자가 취소됩니다. 결과적으로 비극성 분자입니다.

그것은 또한 동성로 비극의 분자와 같은 비용성에서는 물과되는 수용성에 비극성 유기 용제.
발언을 체결
요약하면 이 문서에서는 우리가 말할 수있는 루이스 도 구조의 SF6,모든 원자의 전자가 사용하는 결과를 형성하는 여섯 단일 채권 간 S-F 없이 혼자의 쌍.
이 분자에서 황의 혼성화는 결합 각도가 90 도인 sp3d2 입니다.
sf6 의 분자 기하학은 팔면체이며 비극성 분자입니다.