kén-hexafluorid vagy SF6 szervetlen, üvegházhatású gáz. Nem gyúlékony, szagtalan és színtelen, kiváló szigetelő. Ez egy hipervalens oktaéderes molekula, amely érdekes beszélgetési téma volt a kémia rajongói között.
Henri Moissan fedezte fel az SF6 létezését. Egyébként ő is a fluor felfedezője. Az SF6 szintetizálásának szokásos módja az S8 F2-nek való kitettsége. Ez a módszer néhány kén-fluorid képződését okozza, de ezek fűtéssel kiküszöbölhetők, majd NaOH-val eltávolíthatók további SF4 molekulák.
SF6 nem használható közvetlenül a szintézis után. Meg kell tisztítani, hogy megszabaduljon az összes reaktív fluoridtól. Ezt követően át kell mennie a pirolízisen.
ebben a blogbejegyzésben megismerjük az SF6 Lewis szerkezetét és annak kötési szögeit, molekuláris geometriáját és alakját, amelyek segítenek megérteni ennek a molekulának a fizikai tulajdonságait.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Bármely molekula szerkezete, először meg kell ismernünk a valence elektronok teljes számát. Itt megismerjük az SF6 valence-elektronjainak teljes számát, hozzáadva a valence-elektronokat mind a kén, mind a fluor-atomokhoz.
összesen száma vegyértékű elektronok SF6 – Valence elektronok kén + Valence elektronok fluor
kén hat vegyértékű elektronok.
A fluornak hét vegyértékű elektronja van, de mivel ebben a molekulában hat fluor atom van, ezt a számot 6-tal megszorozzuk.
= 6 + 7*6
= 6 + 42
= 48 valence elektronok
így SF6 48 valence elektronok, amelyek segítenek felhívni a Lewis Dot szerkezete SF6.
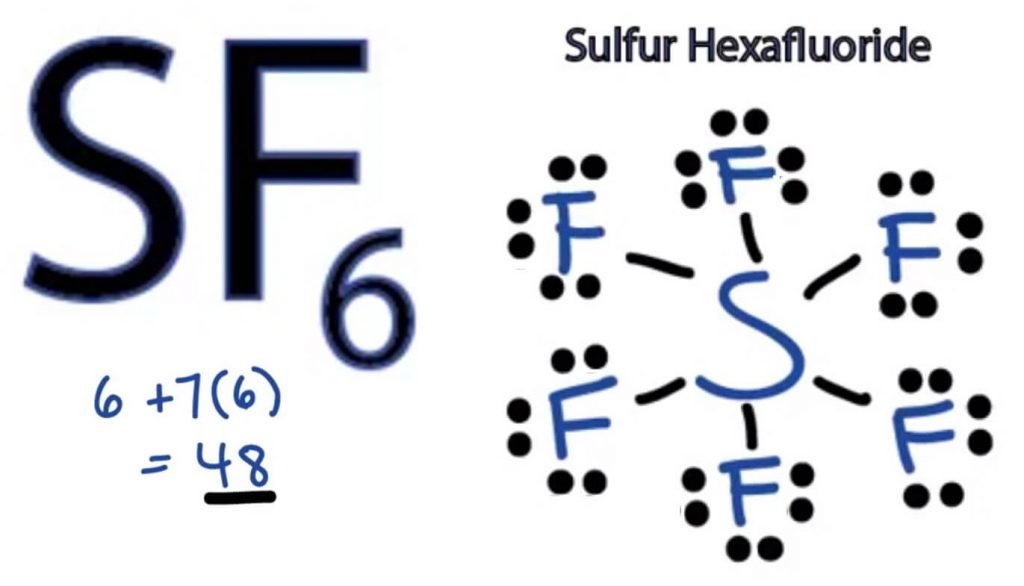
SF6 Lewis Structure
bármely molekula Lewis Dot szerkezete a szerkezet kialakításában részt vevő atomok képi ábrázolása, valamint annak egyedi valenciaelektronjai. Ez a szerkezet segít megismerni a molekula kötési formációit és az elektronok elrendezését.
a kén atom a központi pozíciót veszi át, mivel kevésbé elektronegatív, mint a fluor. Tehát tegyük a középpontba és az összes fluor atomot körülötte így:
A fluor atomnak csak egy valence elektronra van szüksége az oktett befejezéséhez. Mivel minden atom követi az oktet-szabályt, hogy stabil szerkezetet érjen el, a fluor atom megosztja a kénatom egy valence elektronját. Így a kén hat vegyértékű elektront oszt meg az összes fluor atommal, amelyek hat egyetlen kötést képeznek S és F között.
Lewis szerkezetében a kötéseket a szerkezetben úgy mutatjuk be, hogy egyenes vonalat rajzolunk két atom között. Tehát ezek a kötések 48-ból 12 valence elektront vesznek fel.
helyezze az összes fennmaradó vegyértékű elektronot a Fluortatomok köré, és ellenőrizze, hogy az összes fluortatom oktettje teljes-e.
miután ezt megtette, látni fogja a valence elektronokat az összes fluor atom külső héjában, de a kénnek több mint 8 elektronja van a külső héjában. Ez azért van, mert ez kivétel az oktett szerepétől, és kibővítheti orbitális pályáját, hogy több elektront tudjon befogadni.
tehát ez az SF6 megfelelő Lewis szerkezete.
SF6 hibridizáció
most, hogy ismerjük az SF6 Lewis szerkezetét, most meghatározhatjuk az atomok hibridizációját a molekulában. Itt, ahogy a kén megosztja elektronjait a fluor atomokkal, megvizsgáljuk annak hibridizációját.
az SF6 elektronikus konfigurációja földi állapotában 3s23p4. De amikor megosztja az elektronokat, és izgatott állapotban van, az elektronpárok mind a 3S, mind a 3p pályákon párosítatlanok lesznek. Ezek az elektronok mozognak, hogy kitöltsék a magasabb üres 3D-s pályákat. Ennek eredményeként hat hibrid orbitális alakul ki ( a 3s egyik, a 3p három, a két 3D). Ezek a hibrid pályák azok, amelyek befogadják a megosztott elektronokat. Ezek a pályák átfedik egymást a fluor atom 2p pályáival, amikor a kén és a fluor atomok kötéseket képeznek. Ez a hat orbitális az oktaéder alakjának hat irányában van.
ezért a kén-hexafluorid sp3d2 hibridizációval rendelkezik.
SF6 Bond szög
Kén részvények a valence elektronok 6 Fluor atomok, láthatjuk, hogy mind a hat elektronok a Kén atom megosztott formában kötvények. Az F-S-F kötési szöge 90 fok.
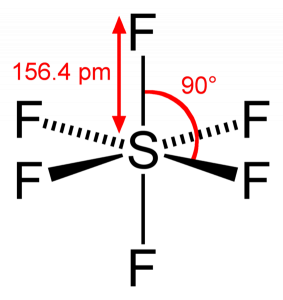
SF6 molekuláris geometria
amikor a kén-hexafluorid molekulát nézzük, a kén központi helyzetben van, a körülötte szimmetrikusan elrendezett fluor atomokkal. Az atomokat az oktaéderes mintába helyezzük, ami az SF6 molekuláris geometriáját oktaéderrálisvá teszi.
SF6 alak
a molekula molekuláris geometriáját tekintve azt mondhatjuk, hogy az SF6 molekula oktaéderes alakú, mivel nyolc oldala van. Azonban a központi atom hat fluor atommal kötődik, az SF6 alakja oktaéderes.

az SF6 poláris vagy nempoláris? a
SF6 egy nempoláris molekula. Ennek oka az, hogy a VSEPR elmélet azt mondja, hogy amikor hat fluor Atom szimmetrikusan van elrendezve a kénatom körül, a kötési dipólusok megszűnnek. Ennek eredményeként ez egy nempoláris molekula.

ugyanolyan tulajdonságokkal rendelkezik, mint a nem poláris molekulák, például vízben nem oldódnak, és nem poláris szerves oldószerekben oldódnak.
Záró megjegyzések
összefoglalni ezt a cikket azt mondhatjuk, hogy az SF6 Lewis dot szerkezetében minden valence elektront használnak fel, ami hat egyetlen kötést eredményez az S-F között, egyetlen elektronpár nélkül.
a kén hibridizációja ebben a molekulában sp3d2, 90 fokos kötési szögekkel.
az SF6 molekuláris geometriája oktaéderes, és nempoláris molekula.