obiective de învățare
până la sfârșitul acestei secțiuni, veți putea:
- examina transferul de căldură.
- calculați temperatura finală din transferul de căldură.
până acum am discutat despre schimbarea temperaturii datorită transferului de căldură. Nu se produce nicio schimbare de temperatură din transferul de căldură dacă gheața se topește și devine apă lichidă (adică în timpul unei schimbări de fază). De exemplu, luați în considerare scurgerea apei din gheață care se topește pe un acoperiș încălzit de soare. În schimb, apa îngheață într-o tavă de gheață răcită de împrejurimile cu temperaturi mai scăzute.

Figura 1. Căldura din aer se transferă pe gheață, provocând topirea acesteia. (credit: Mike Brand)
energia este necesară pentru a topi un solid, deoarece legăturile coezive dintre moleculele din solid trebuie să fie rupte astfel încât, în lichid, moleculele să se poată deplasa la energii cinetice comparabile; astfel, nu există o creștere a temperaturii. În mod similar, energia este necesară pentru a vaporiza un lichid, deoarece moleculele dintr-un lichid interacționează între ele prin forțe atractive. Nu există nicio schimbare de temperatură până când o schimbare de fază nu este completă. Temperatura unei cesti de sifon initial la 0 CENTICC ramane la 0 CENTICC pana cand toata gheata S-a topit. În schimb, energia este eliberată în timpul înghețării și condensării, de obicei sub formă de energie termică. Munca se face prin forțe coezive atunci când moleculele sunt reunite. Energia corespunzătoare trebuie să fie eliberată (disipată) pentru a le permite să rămână împreună Figura 2.
energia implicată într-o schimbare de fază depinde de doi factori majori: numărul și puterea legăturilor sau perechilor de forțe. Numărul de legături este proporțional cu numărul de molecule și, astfel, cu masa probei. Puterea forțelor depinde de tipul de molecule. Căldura Q necesară pentru a schimba faza unui eșantion de masă m este dată de
Q = mLf (topire/congelare,
Q = mLv (vaporizare/condensare),
unde căldura latentă de fuziune, Lf și căldura latentă de vaporizare, Lv, sunt constante materiale care sunt determinate experimental. A Se Vedea (Tabelul 1).

Figura 2. (a) Energia este necesară pentru a depăși parțial forțele de atracție dintre moleculele dintr-un solid pentru a forma un lichid. Aceeași energie trebuie eliminată pentru ca înghețarea să aibă loc. (B) moleculele sunt separate de distanțe mari atunci când trec de la lichid la vapori, necesitând o energie semnificativă pentru a depăși atracția moleculară. Aceeași energie trebuie îndepărtată pentru ca condensul să aibă loc. Nu există nicio schimbare de temperatură până când o schimbare de fază nu este completă.
căldura latentă este măsurată în unități de J / kg. Atât Lf, cât și Lv depind de substanță, în special de puterea forțelor sale moleculare, așa cum s-a menționat anterior. LF și Lv sunt denumite colectiv coeficienți de căldură latenți. Ele sunt latente sau ascunse, deoarece în schimbările de fază, energia intră sau iese dintr-un sistem fără a provoca o schimbare de temperatură în sistem; deci, de fapt, energia este ascunsă. Tabelul 1 enumeră valorile reprezentative ale Lf și Lv, împreună cu punctele de topire și fierbere.
tabelul arată că cantități semnificative de energie sunt implicate în schimbările de fază. Să ne uităm, de exemplu, la cât de multă energie este necesară pentru a topi un kilogram de gheață la 0 CENTICC pentru a produce un kilogram de apă la 0 centicc C. folosind ecuația pentru o schimbare de temperatură și valoarea pentru apă din tabelul 1, constatăm că Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ este energia pentru a topi un kilogram de gheață. Aceasta este o mulțime de energie, deoarece reprezintă aceeași cantitate de energie necesară pentru a ridica temperatura de 1 kg de apă lichidă de la 0 la 79,8. Chiar și mai multă energie este necesară pentru a vaporiza apa; ar fi nevoie de 2256 kJ pentru a schimba 1 kg de apă lichidă la punctul normal de fierbere (100 CENTICC la presiune atmosferică) în abur (vapori de apă). Acest exemplu arată că energia pentru o schimbare de fază este enormă în comparație cu energia asociată cu schimbările de temperatură fără o schimbare de fază.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Luați, de exemplu, faptul că temperaturile aerului în climatele umede rareori depășesc 35,0 CENTICC, ceea ce se datorează faptului că majoritatea transferului de căldură intră în evaporarea apei în aer. În mod similar, temperaturile pe vreme umedă scad rar sub punctul de rouă, deoarece căldura enormă este eliberată atunci când vaporii de apă se condensează.
examinăm efectele schimbării de fază mai precis luând în considerare adăugarea de căldură într −un eșantion de gheață la-20 CENTICC (Figura 3). Temperatura gheții crește liniar, absorbind căldura la o rată constantă de 0,50 cal/g centicc până când ajunge la 0 CENTICC. Odată la această temperatură, gheața începe să se topească până când toată gheața s-a topit, absorbind 79,8 cal/g de căldură. Temperatura rămâne constantă la 0 CENTICC în timpul acestei schimbări de fază. Odată ce toată gheața s-a topit, temperatura apei lichide crește, absorbind căldura la o nouă rată constantă de 1,00 cal/g centicc. La 100 de CENTICCI, apa începe să fiarbă și temperatura rămâne din nou constantă, în timp ce apa absoarbe 539 cal/g de căldură în timpul acestei schimbări de fază. Când tot lichidul a devenit vapori de abur, temperatura crește din nou, absorbind căldura la o rată de 0,482 cal/g centicc.
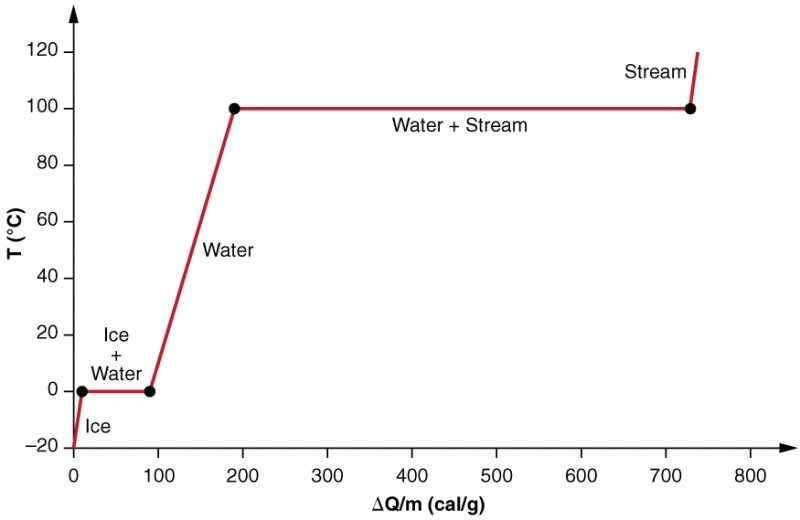
Figura 3. Un grafic de temperatură versus energie adăugată. Sistemul este construit astfel încât să nu se evapore vapori în timp ce gheața se încălzește pentru a deveni apă lichidă și astfel încât, atunci când are loc vaporizarea, vaporii rămân în sistem. Întinderile lungi de valori constante ale temperaturii la 0 și 100 de CENTICC reflectă căldura latentă mare de topire și, respectiv, vaporizare.
apa se poate evapora la temperaturi sub punctul de fierbere. Este nevoie de mai multă energie decât la punctul de fierbere, deoarece energia cinetică a moleculelor de apă la temperaturi sub 100 CENTICC este mai mică decât cea de la 100 CENTICC, deci mai puțină energie este disponibilă din mișcări termice aleatorii. Luați, de exemplu, faptul că, la temperatura corpului, transpirația de pe piele necesită un aport de căldură de 2428 kJ/kg, care este cu aproximativ 10 la sută mai mare decât căldura latentă de vaporizare la 100 CENTICC. Această căldură provine din piele și oferă astfel un mecanism eficient de răcire pe vreme caldă. Umiditatea ridicată inhibă evaporarea, astfel încât temperatura corpului ar putea crește, lăsând transpirația neuniformă pe frunte.
Exemplul 1. Calculați temperatura finală de la schimbarea de fază: Soda de răcire cu cuburi de gheață
trei cuburi de gheață sunt folosite pentru a răci un sifon la 20 de CENTICC cu masă msoda = 0,25 kg. Gheața este la 0 CENTICC și fiecare cub de gheață are o masă de 6,0 g. Să presupunem că sifonul este păstrat într-un recipient de spumă, astfel încât pierderea de căldură să poată fi ignorată. Să presupunem că soda are aceeași capacitate de căldură ca și apa. Găsiți temperatura finală când toată gheața s-a topit.
strategie
cuburile de gheață se află la temperatura de topire de 0 MMC. Căldura este transferată de la sifon la gheață pentru topire. Topirea gheții are loc în două etape: mai întâi are loc schimbarea fazei și solidul (gheața) se transformă în apă lichidă la temperatura de topire, apoi temperatura acestei ape crește. Topirea produce apă la 0 CENTICC, deci mai multă căldură este transferată din sodă în această apă până când sistemul de apă plus sodă atinge echilibrul termic, Qice = − Qsoda.
căldura transferată pe gheață este
Qice = mice Lf + micecW(TF−0 INKTICC).
căldura degajată de soda este Qsoda = msodacW(TF−20 INKTC). Din moment ce nu se pierde căldură, Qice = – Qsoda, astfel încât
șoareci LF + micecW(TF−0 INKTICTC) = –msodacW(TF−20 INKTICTC).
aduceți toți termenii care implică Tf pe partea stângă și toți ceilalți termeni pe partea dreaptă. Rezolvați pentru cantitatea necunoscută Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
soluție
- identificați cantitățile cunoscute. Masa de gheață este șoareci = 3 6,0 g = 0,018 kg, iar masa de sodă este msoda = 0,25 kg.
- se calculează termenii în numărător: m sodacW(20 XQC)=(0,25 kg)(4186 J/kg XQC)(20 XQC) = 20,930 J și micelf = (0,018 kg)(334,000 j/kg) = 6012 J.
- se calculează numitorul: (msoda + șoareci)CW = (0,25 kg + 0.018 kg) [4186 k/(kg XQC) = 1122 J/XQC.
- calculați temperatura finală: \ displaystyle{T} _ {\text{f}}= \ frac{20,930 \ text{ J}-6012 \ text{ J}}{1122 \ text{ J/}^{\circ} \ text{C}} = 13 ^ {\circ} \ text{c}\\
discuție
acest exemplu ilustrează energiile enorme implicate în timpul unei schimbări de fază. Masa gheții este de aproximativ 7% din masa apei, dar duce la o schimbare vizibilă a temperaturii sifonului. Deși am presupus că gheața a fost la temperatura de îngheț, acest lucru este incorect: temperatura tipică este de −6 CENTICC. Cu toate acestea, această corecție oferă o temperatură finală care este în esență identică cu rezultatul pe care l-am găsit. Poți explica de ce?

Figura 4. Condensarea pe un pahar de ceai rece. (credit: Jenny Downing)
am văzut că vaporizarea necesită transfer de căldură către un lichid din împrejurimi, astfel încât energia să fie eliberată de împrejurimi. Condensarea este procesul invers, crescând temperatura împrejurimilor. Această creștere poate părea surprinzătoare, deoarece asociem condensul cu obiecte reci-sticla din figură, de exemplu. Cu toate acestea, energia trebuie îndepărtată din moleculele de condensare pentru a face o condensare a vaporilor. Energia este exact aceeași cu cea necesară pentru a face schimbarea de fază în cealaltă direcție, de la lichid la vapori, și astfel poate fi calculată din Q = mLv.
condensul se formează în Figura 4 deoarece temperatura aerului din apropiere este redusă sub punctul de rouă. Aerul nu poate reține la fel de multă apă ca la temperatura camerei și astfel apa se condensează. Energia este eliberată atunci când apa se condensează, accelerând topirea gheții în pahar.
aplicație din lumea reală
energia este eliberată și atunci când un lichid îngheață. Acest fenomen este folosit de cultivatorii de fructe din Florida pentru a proteja portocalele atunci când temperatura este aproape de punctul de îngheț (0%). Cultivatorii pulverizează apă pe plantele din livezi, astfel încât apa să înghețe și căldura să fie eliberată portocalelor în creștere de pe copaci. Acest lucru împiedică temperatura din interiorul portocalei să scadă sub îngheț, ceea ce ar deteriora fructele.

figura 14.11. Gheața de pe acești copaci a eliberat cantități mari de energie atunci când a înghețat, ajutând la prevenirea scăderii temperaturii copacilor sub 0 CENTICC. Apa este pulverizată intenționat pe livezi pentru a ajuta la prevenirea înghețurilor dure. (credit: Hermann Hammer)
sublimarea este trecerea de la faza solidă la cea de vapori. Este posibil să fi observat că zăpada poate dispărea în aer subțire fără urmă de apă lichidă sau dispariția cuburilor de gheață într-un congelator. Reversul este, de asemenea, adevărat: înghețul se poate forma pe ferestre foarte reci fără a trece prin etapa lichidă. Un efect popular este producerea de” fum ” din gheață uscată, care este dioxid de carbon solid. Sublimarea are loc deoarece presiunea vaporilor de echilibru a solidelor nu este zero. Anumite odorizante folosesc sublimarea unui solid pentru a injecta un parfum în cameră. Bilele de molii sunt un exemplu ușor toxic de fenol (un compus organic) care sublimează, în timp ce unele solide, cum ar fi tetroxidul de osmiu, sunt atât de toxice încât trebuie păstrate în recipiente sigilate pentru a preveni expunerea umană la vaporii produși de sublimare.

Figura 5. Tranzițiile directe între solid și vapori sunt comune, uneori utile și chiar frumoase. (a) gheața carbonică se sublimează direct în dioxid de carbon. Vaporii vizibili sunt făcuți din picături de apă. (credit: Windell Oskay) (b) Frost formează modele pe o fereastră foarte rece, un exemplu de solid format direct dintr-un vapor. (credit: Liz West)
toate tranzițiile de fază implică căldură. În cazul tranzițiilor directe de vapori solizi, energia necesară este dată de ecuația Q = mLs, unde Ls este căldura sublimării, care este energia necesară pentru a schimba 1.00 kg de substanță de la faza solidă la faza de vapori. Ls este analog cu Lf și Lv, iar valoarea sa depinde de substanță. Sublimarea necesită energie, astfel încât gheața uscată este un lichid de răcire eficient, în timp ce procesul invers (adică înghețarea) eliberează energie. Cantitatea de energie necesară pentru sublimare este de același ordin de mărime ca și pentru alte tranziții de fază.
materialul prezentat în această secțiune și secțiunea precedentă ne permite să calculăm orice număr de efecte legate de temperatură și schimbare de fază. În fiecare caz, este necesar să se identifice ce schimbări de temperatură și fază au loc și apoi să se aplice ecuația corespunzătoare. Rețineți că transferul de căldură și munca pot provoca atât schimbări de temperatură, cât și de fază.
strategii de rezolvare a problemelor pentru efectele transferului de căldură
- examinează situația pentru a determina că există o schimbare a temperaturii sau a fazei. Există transfer de căldură în sau în afara sistemului? Când prezența sau absența unei schimbări de fază nu este evidentă, poate doriți să rezolvați mai întâi problema ca și cum nu ar exista modificări de fază și să examinați schimbarea de temperatură obținută. Dacă este suficient să treceți peste un punct de fierbere sau de topire, ar trebui să vă întoarceți și să faceți problema în pași—schimbarea temperaturii, schimbarea fazei, schimbarea ulterioară a temperaturii și așa mai departe.
- identificați și listați toate obiectele care schimbă temperatura și faza.
- identificați exact ceea ce trebuie determinat în problemă (identificați necunoscutele). O listă scrisă este utilă.
- faceți o listă cu ceea ce este dat sau ce poate fi dedus din problemă așa cum este menționat (identificați cunoștințele).
- rezolva ecuația corespunzătoare pentru cantitatea care urmează să fie determinată (necunoscut). Dacă există o schimbare de temperatură, căldura transferată depinde de căldura specifică (a se vedea tabelul 1 în schimbarea temperaturii și capacitatea de căldură), în timp ce, pentru o schimbare de fază, căldura transferată depinde de căldura latentă. A Se Vedea Tabelul 1.
- înlocuiți cunoștințele împreună cu unitățile lor în ecuația corespunzătoare și obțineți soluții numerice complete cu unități. Va trebui să faceți acest lucru în pași dacă există mai multe etape ale procesului (cum ar fi o schimbare de temperatură urmată de o schimbare de fază).
- verificați răspunsul pentru a vedea dacă este rezonabil: are sens? De exemplu, asigurați-vă că schimbarea temperaturii nu provoacă, de asemenea, o schimbare de fază pe care nu ați luat-o în considerare.
verificați-vă înțelegerea
de ce rămâne zăpada pe versanții montani chiar și atunci când temperaturile din timpul zilei sunt mai mari decât temperatura de îngheț?
soluție
zăpada este formată din cristale de gheață și astfel este faza solidă a apei. Deoarece căldura enormă este necesară pentru schimbările de fază, este nevoie de o anumită perioadă de timp pentru ca această căldură să fie acumulată din aer, chiar dacă aerul este mai mare de 0 CENTICC. Cu cât aerul este mai cald, cu atât mai rapid are loc acest schimb de căldură și cu atât mai repede se topește zăpada.
Rezumatul secțiunii
- majoritatea substanțelor pot exista fie în forme solide, lichide și gazoase, care sunt denumite „faze.”
- schimbările de fază apar la temperaturi fixe pentru o anumită substanță la o anumită presiune, iar aceste temperaturi se numesc puncte de fierbere și îngheț (sau topire).
- în timpul schimbărilor de fază, căldura absorbită sau eliberată este dată de: Q = mL unde L este coeficientul de căldură latent.
întrebări conceptuale
- transferul de căldură poate provoca schimbări de temperatură și fază. Ce altceva poate provoca aceste schimbări?
- cum ajută căldura latentă de fuziune a apei să încetinească scăderea temperaturilor aerului, împiedicând probabil temperaturile să scadă semnificativ sub nivelul de XCC, în vecinătatea corpurilor mari de apă?
- care este temperatura gheții imediat după ce se formează prin înghețarea apei?
- dacă plasați gheața în apa de la CENTICC într-un recipient izolat, ce se va întâmpla? Se va topi niște gheață, va îngheța mai multă apă sau nu va avea loc niciuna?
- ce efect are condensul pe un pahar de apă cu gheață asupra vitezei la care se topește gheața? Condensarea va accelera procesul de topire sau îl va încetini?
- în climatele foarte umede, unde există numeroase corpuri de apă, cum ar fi în Florida, este neobișnuit ca temperaturile să crească peste aproximativ 35 de metri cubi (95 de metri cubi). Cu toate acestea, în deșerturi, temperaturile pot crește mult peste acest lucru. Explicați modul în care evaporarea apei ajută la limitarea temperaturilor ridicate în climatele umede.
- în ierni, este adesea mai cald în San Francisco decât în apropiere Sacramento, la 150 km spre interior. În timpul verii, este aproape întotdeauna mai cald în Sacramento. Explicați modul în care corpurile de apă din jurul San Francisco își moderează temperaturile extreme.
- punerea unui capac pe o oală de fierbere reduce foarte mult transferul de căldură necesar pentru a-l menține la fierbere. Explicați de ce.
- alimentele liofilizate au fost deshidratate în vid. În timpul procesului, alimentele îngheață și trebuie încălzite pentru a facilita deshidratarea. Explicați atât modul în care vidul accelerează deshidratarea, cât și de ce alimentele îngheață ca urmare.
- când aerul încă se răcește radiind noaptea, este neobișnuit ca temperaturile să scadă sub punctul de rouă. Explicați de ce.
- într-o demonstrație de clasă fizică, un instructor umflă un balon pe gură și apoi îl răcește în azot lichid. Când este rece, balonul micșorat are o cantitate mică de lichid albastru deschis, precum și unele cristale asemănătoare zăpezii. Pe măsură ce se încălzește, lichidul fierbe și o parte din cristale se sublimează, unele cristale persistând o vreme și apoi producând un lichid. Identificați lichidul albastru și cele două solide din balonul rece. Justificați-vă identificările utilizând datele din tabelul 1.
probleme& exerciții
- cât de mult transfer de căldură (în kilocalorii) este necesar pentru a dezgheța un pachet de 0,450 kg de legume congelate inițial la 0 CENTICC dacă căldura lor de fuziune este aceeași cu cea a apei?
- o pungă care conține gheață de 0% este mult mai eficientă în absorbția energiei decât una care conține aceeași cantitate de apă de 0%. (a) cât de mult transfer de căldură este necesar pentru a crește temperatura de 0,800 kg de apă de la 0 la 30,0 la 30,0? (b) cât de mult transfer de căldură este necesar pentru a topi mai întâi 0.800 kg de 0 gheață și apoi se ridică temperatura? (c) explicați modul în care răspunsul dvs. susține afirmația că gheața este mai eficientă.
- (a) cât de mult transfer de căldură este necesar pentru a ridica temperatura unui vas de aluminiu de 0,750 kg care conține 2,50 kg de apă de la 30,0 CENTICC până la punctul de fierbere și apoi se fierbe 0,750 kg de apă? (b) cât durează acest lucru dacă rata de transfer de căldură este de 500 W 1 watt = 1 joule/secundă (1 W = 1 J/s)?
- formarea condensului pe un pahar de apă cu gheață face ca gheața să se topească mai repede decât ar fi altfel. Dacă 8.00 g de condens se formează pe un pahar care conține atât apă, cât și 200 g de gheață, câte grame de gheață se vor topi ca rezultat? Să presupunem că nu are loc niciun alt transfer de căldură.
- într-o călătorie, observați că o pungă de gheață de 3,50 kg durează în medie o zi în răcitorul dvs. Care este puterea medie în wați care intră în gheață dacă începe de la 0 CENTICC și se topește complet la 0 CENTICC apă într-o singură zi 1 watt = 1 joule/secundă (1 W = 1 J/s)?
- într-o anumită zi însorită uscată, temperatura unei piscine ar crește cu 1,50 UNQC dacă nu ar fi evaporată. Ce fracțiune din apă trebuie să se evapore pentru a transporta suficientă energie pentru a menține temperatura constantă?
- (a) cât de mult transfer de căldură este necesar pentru a ridica temperatura unei bucăți de gheață de 0,200 kg de la -20,0 la 130 la 130 la sută, inclusiv energia necesară pentru schimbările de fază? (b) cât timp este necesar pentru fiecare etapă, presupunând o rată constantă de transfer de căldură de 20,0 kJ/s? (c) faceți un grafic al temperaturii în funcție de timp pentru acest proces.
- în 1986, un aisberg gargantuan s-a desprins de Raftul de gheață Ross din Antarctica. Avea aproximativ un dreptunghi de 160 km lungime, 40.0 km lățime și 250 m grosime. (a) care este masa acestui aisberg, având în vedere că densitatea gheții este de 917 kg/m3? b) cât transfer de căldură (în jouli) este necesar pentru a-l topi? (c) câți ani ar fi nevoie doar de lumina soarelui pentru a topi gheața atât de groasă, dacă gheața absoarbe în medie 100 W/m2, 12,00 h pe zi?
- câte grame de cafea trebuie să se evapore din 350 g de cafea într-o ceașcă de sticlă de 100 g pentru a răci cafeaua de la 95,0 la 45,0 la 45,0? Puteți presupune că cafeaua are aceleași proprietăți termice ca și apa și că căldura medie de vaporizare este de 2340 kJ/kg (560 cal/g). (Puteți neglija schimbarea masei cafelei pe măsură ce se răcește, ceea ce vă va oferi un răspuns puțin mai mare decât corect.)
- (a) este dificil să stingi un incendiu pe un petrolier brut, deoarece fiecare litru de țiței eliberează 2,80 107 J de energie atunci când este ars. Pentru a ilustra această dificultate, calculați numărul de litri de apă care trebuie cheltuiți pentru a absorbi energia eliberată prin arderea a 1,00 L de țiței, dacă apa are temperatura ridicată de la 20,0 CENTICC la 100 CENTICC, fierbe, iar aburul rezultat este ridicat la 300 CENTICC. (b) să discute despre complicațiile suplimentare cauzate de faptul că țițeiul are o densitate mai mică decât apa.
- energia eliberată de condensare în furtuni poate fi foarte mare. Calculați energia eliberată în atmosferă pentru o furtună mică de rază 1 km, presupunând că 1,0 cm de ploaie este precipitată uniform pe această zonă.
- pentru a preveni deteriorarea înghețului, 4,00 kg de apă 0 UNKTICC este pulverizată pe un pom fructifer. (a) cât de mult transfer de căldură are loc pe măsură ce apa îngheață? b) cât de mult ar scădea temperatura copacului de 200 kg dacă această cantitate de căldură ar fi transferată din copac? Luați căldura specifică pentru a fi de 3,35 kJ/kg · CENTICC și presupuneți că nu are loc nicio schimbare de fază.
- un vas de aluminiu de 0,250 kg care conține 0,800 kg de supă la 25,0 CENTICC este plasat într-un congelator. Care este temperatura finală dacă 377 kJ de energie este transferată din castron și supă, presupunând că proprietățile termice ale supei sunt aceleași cu cele ale apei?
- un cub de gheață de 0,0500 kg la -30,0 CENTICC este plasat în 0,400 kg de apă de 35,0 centicc într-un recipient foarte bine izolat. Care este temperatura finală?
- dacă turnați 0,0100 kg de apă de 20,0 XQC pe un bloc de gheață de 1,20 kg (care este inițial la -15,0 XQC), care este temperatura finală? Puteți presupune că apa se răcește atât de rapid încât efectele împrejurimilor sunt neglijabile.
- indigenii gătesc uneori în coșuri etanșe, punând pietre fierbinți în apă pentru a le aduce la fierbere. Ce masă de rocă de 500 de kilograme trebuie plasată în 4,00 kg de apă de 15,0 kilograme pentru a-și aduce temperatura la 100 de kilograme, dacă 0,0250 kg de apă scapă sub formă de vapori de la sfârâitul inițial? Puteți neglija efectele împrejurimilor și puteți lua căldura specifică medie a rocilor ca fiind cea a granitului.
- care ar fi temperatura finală a tăvii și a apei la calcularea temperaturii finale atunci când căldura este transferată între două corpuri: turnarea apei reci într-o tigaie fierbinte dacă 0,260 kg de apă a fost plasată în tigaie și 0,0100 kg de apă evaporată imediat, lăsând restul să ajungă la o temperatură comună cu tigaia?
- în unele țări, azotul lichid este utilizat pe camioanele de lapte în locul frigiderelor mecanice. A 3.Călătoria de livrare de 00 de ore necesită 200 L de azot lichid, care are o densitate de 808 kg/m3. (a) se calculează transferul de căldură necesar pentru a evapora această cantitate de azot lichid și pentru a crește temperatura acestuia la 3,00 CENTICC. (Utilizați cp și presupuneți că este constantă în intervalul de temperatură.) Această valoare este cantitatea de răcire a aprovizionării cu azot lichid. b) care este această rată de transfer de căldură în kilowați-oră? (c) să Compare cantitatea de răcire obținută prin topirea unei mase identice de gheață de 0 CENTICC cu cea obținută prin evaporarea azotului lichid.
- unii crescători de arme își fac propriile gloanțe, ceea ce implică topirea și turnarea melcilor de plumb. Cât de mult transfer de căldură este necesar pentru a ridica temperatura și a topi 0,500 kg de plumb, începând de la 25,0 CENTICC?
Glosar
căldură de sublimare: energia necesară pentru a schimba o substanță din faza solidă în faza de vapori
coeficient de căldură latent: o constantă fizică egală cu cantitatea de căldură transferată pentru fiecare 1 kg de substanță în timpul schimbării fazei substanței
sublimare: trecerea de la faza solidă la faza de vapori
soluții selectate la probleme & exerciții
1. 35,9 kcal
3. (a) 591 kcal; (b) 4,94 XCT 103 s
5. 13, 5 W
7. (a) 148 kcal; (b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 S
9. 33,0 g
10. (a) 9,67 L; (b) țițeiul este mai puțin dens decât apa, deci plutește deasupra apei, expunându-l astfel la oxigenul din aer, pe care îl folosește pentru a arde. De asemenea, dacă apa se află sub ulei, este mai puțin eficientă în absorbția căldurii generate de ulei.
12. (a) 319 kcal; (b)2.00 XQC
14. 20.6 XQC
16. 4, 38 kg
18. (a) 1,57 int.104 kcal; (b) 18,3 kW int. h; (c) 1,29 int. 104 kcal
- valori cotate la temperaturile normale de topire și fierbere la presiunea atmosferică standard (1 atm).
- la 37,0 LV (temperatura corpului), căldura de vaporizare Lv pentru apă este de 2430 kJ/kg sau 580 kcal/kg
- la 37,0 LV (temperatura corpului), căldura de vaporizare LV pentru apă este de 2430 kJ/kg sau 580 kcal/kg