Rikkiheksafluoridi tai SF6 on epäorgaaninen kasvihuonekaasu. Se on palamatonta, hajutonta ja väritöntä ja erinomainen eriste. Se on hypervalentti oktaedrinen molekyyli, joka on ollut kiinnostava keskustelunaihe kemian harrastajien keskuudessa.
Henri Moissan löysi SF6: n olemassaolon. Ohimennen sanoen hän on myös fluorin löytäjä. Normaali tapa syntetisoida SF6 on altistaa S8 F2: lle. Tämä menetelmä aiheuttaa muutaman rikkifluoridin muodostumisen, mutta ne voidaan eliminoida kuumentamalla ja käyttämällä sitten NaOH: ta mahdollisten ylimääräisten SF4-molekyylien poistamiseksi.
SF6-valmistetta ei voida käyttää välittömästi synteesin jälkeen. Se on puhdistettava, jotta se pääsee eroon kaikista reaktiivisista fluorideista. Sen jälkeen sen on käytävä läpi pyrolyysi.
tässä blogikirjoituksessa opimme SF6: n Lewis-rakenteen ja sen Sidoskulmat, Molekyyligeometrian ja muodon, jotka voivat auttaa meitä ymmärtämään tämän molekyylin fysikaalisia ominaisuuksia.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
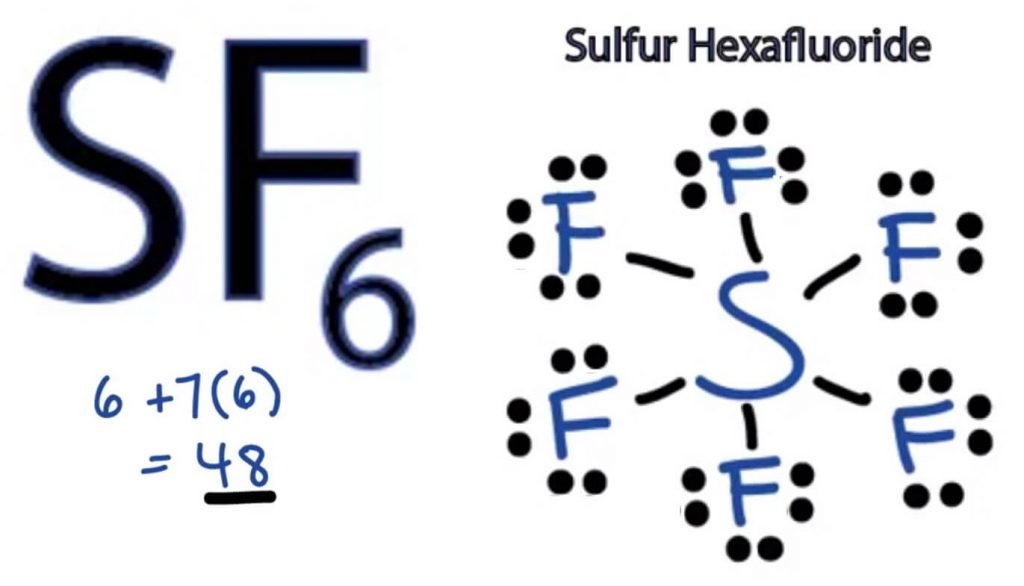
To determine the Lewis Minkä tahansa molekyylin rakenne, meidän on ensin tiedettävä valenssielektronien kokonaismäärä. Tässä selvitetään SF6: n valenssielektronien kokonaismäärä lisäämällä sekä rikki-että Fluoriatomien valenssielektronit.
VALENSSIELEKTRONIEN kokonaismäärä SF6 – Valenssielektroneilla rikillä + Valenssielektroneilla fluorilla
rikillä on kuusi valenssielektronia.
fluorilla on seitsemän valenssielektronia, mutta koska tässä molekyylissä on kuusi Fluoriatomia, kerrotaan tämä luku 6: lla.
= 6 + 7*6
= 6 + 42
= 48 valenssielektronia
näin SF6: lla on 48 valenssielektronia, joiden avulla voidaan piirtää SF6: n Lewis-Pisterakenne.
SF6 Lewis-rakenne
minkä tahansa molekyylin Lewis-Pisterakenne on kuvallinen esitys rakenteen muodostamiseen osallistuvista atomeista ja sen yksittäisistä valenssielektroneista. Tämä rakenne auttaa meitä tuntemaan molekyylin sidosmuodostumat ja elektronien järjestäytymisen siinä.
Rikkiatomilla on keskeinen asema, koska se on vähemmän elektronegatiivinen kuin fluori. Sijoita se siis keskelle ja kaikki Fluoriatomit sen ympärille näin:
Fluoriatomi tarvitsee vain yhden valenssielektroninsa täydentääkseen oktettinsa. Koska jokainen atomi noudattaa oktettisääntöä vakaan rakenteen saavuttamiseksi, Fluoriatomi jakaa Rikkiatomista yhden valenssielektronin. Näin rikki jakaa kuusi valenssielektroniaan kaikkien fluoriatomien kanssa, joiden tuloksena muodostuu kuusi yksittäistä sidosta S: n ja F: n välille.
Lewis-rakenteessa osoitetaan rakenteen sidokset piirtämällä suora viiva kahden atomin välille. Kaikki nämä sidokset vievät siis 12 valenssielektronia 48: sta.
aseta kaikki jäljellä olevat valenssielektronit Fluoriatomien ympärille ja tarkista, ovatko kaikkien fluoriatomien oktetit täydelliset.
tämän jälkeen kaikkien Fluoriatomien ulkokuorissa on valenssielektroneja, mutta Rikkillä on yli 8 elektronia ulkokuoressaan. Tämä johtuu siitä, että se on poikkeus oktetin roolista ja voi laajentaa orbitaaliaan niin, että siihen mahtuu enemmän elektroneja.
näin ollen tämä on SF6: n oikea Lewis-rakenne.
SF6-hybridisaatio
nyt kun tiedämme SF6: n Lewis-rakenteen, voimme nyt määrittää atomien hybridisaation molekyylissä. Tässä rikin jakaessa elektroninsa Fluoriatomien kanssa tarkastelemme sen hybridisoitumista.
SF6: n elektroninen konfiguraatio maanpäällisessä tilassaan on 3s23p4. Mutta kun se jakaa elektroneja ja on virittyneessä tilassa, elektroniparit sekä 3S-että 3p-orbitaaleilla jäävät parittomiksi. Nämä elektronit liikkuvat täyttääkseen korkeammat tyhjät 3d-orbitaalit. Tämän seurauksena muodostuu kuusi hybridiorbitaalia (yksi 3s: stä, kolme 3p: stä ja kaksi 3d: stä). Näihin hybridiorbitaaleihin mahtuu jaettuja elektroneja. Nämä orbitaalit ovat päällekkäin fluoriatomin 2p-orbitaalien kanssa, kun rikki-ja Fluoriatomit muodostavat sidoksia. Nämä kuusi orbitaalia ovat oktaedrin muodon kuudessa suunnassa.
näin ollen Rikkiheksafluoridilla on sp3d2-hybridisaatio.
SF6-Sidoskulma
koska rikki jakaa valenssielektroninsa 6 Fluoriatomin kanssa, voidaan nähdä, että rikkiatomin kaikki kuusi elektronia jakautuvat muodostaen sidoksia. F-S-F: n sidoskulma on 90 astetta.
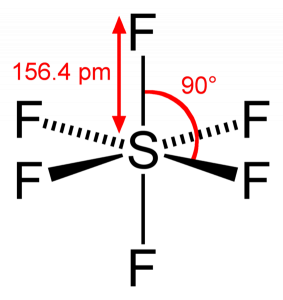
SF6-Molekyyligeometria
kun tarkastelemme Rikkiheksafluoridimolekyyliä, rikki on keskeisessä asemassa fluoriatomien järjestyessä symmetrisesti sen ympärille. Atomit sijoittuvat oktaedrikuvioon, minkä vuoksi SF6: n molekyyligeometria on oktaedrinen.
SF6-muoto
tarkasteltaessa molekyylin molekyyligeometriaa voidaan sanoa, että SF6-molekyylillä on oktaedrinen muoto, koska sillä on kahdeksan sivua. Keskusatomin sidokset kuuden Fluoriatomin kanssa ovat kuitenkin SF6: n muotoa oktaedriset.

onko SF6 polaarinen vai ei-polaarinen?
SF6 on ei-polaarinen molekyyli. Tämä johtuu siitä, että VSEPR-teorian mukaan kun kuusi fluoriatomia on järjestetty symmetrisesti rikkiatomin ympärille, sidosdipolit kumoutuvat. Tämän seurauksena se on ei-polaarinen molekyyli.

sillä on myös samat ominaisuudet kuin ei-polaarisilla molekyyleillä, kuten se ei liukene veteen ja liukenee ei-polaarisiin orgaanisiin liuottimiin.
Loppuhuomautukset
tämän artikkelin tiivistämiseksi voidaan sanoa, että SF6: n Lewis-pisterakenteessa kaikki valenssielektronit käytetään loppuun, jolloin muodostuu kuusi yksittäistä sidosta S-F: n välille ilman yksinäisiä elektronipareja.
rikin hybridisaatio tässä molekyylissä on sp3d2, jonka sidoskulmat ovat 90 astetta.
SF6: n molekyyligeometria on oktaedrinen ja se on ei-polaarinen molekyyli.