A Microbial Biorealm page on the genus Enterococcus faecalis
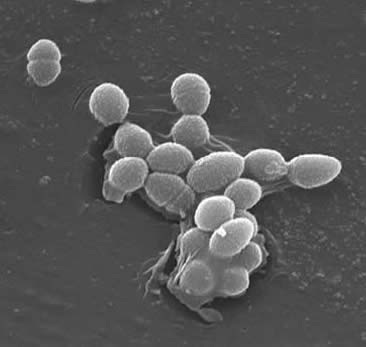
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
specii
Enterococcus faecalis
descriere și semnificație
enterococii sunt coci Gram-pozitivi care pot supraviețui condițiilor dure din natură. Ele pot fi găsite în sol, apă și plante. Unele tulpini sunt utilizate la fabricarea alimentelor, în timp ce altele sunt cauza infecțiilor grave umane și animale (de exemplu, se știe că colonizează tractul gastro-intestinal și genital al oamenilor). Acestea sunt asociate atât cu infecții dobândite în Comunitate, cât și în spital. Enterococii pot crește la un interval de temperatură cuprins între 10 și 42 de centi C și în medii cu valori mari ale pH-ului. Unii sunt cunoscuți a fi motili. Deși există peste 15 specii din genul Enterococcus, 80-90% din izolatele clinice sunt E. faecalis (8). Enterococii formează de obicei lanțuri scurte sau sunt aranjate în perechi. Cu toate acestea, în anumite condiții de creștere, ele se alungesc și apar cocobacilare. În general,enterococii sunt alfa-hemolitici. Unii posedă antigenul Lancefield din grupa D și pot fi detectați folosind teste de aglutinare pe bază de anticorpi monoclonali.Enterococii sunt de obicei catalază negativă și sunt anaerobi. Sunt capabili să crească în 6,5% NaCl, pot hidroliza esculina în prezența a 40% săruri biliare și sunt pirolidonil arilamidază și leucină arilamidază pozitivă (8). Enterococii s-au dovedit a prezenta o provocare terapeutică datorită rezistenței lor la multe medicamente antimicrobiene, „inclusiv agenți activi pe peretele celular; aminoglicozide, Penicilină și ampicilină și vancomicină” (1). Enterococii au capacitatea de a dobândi o mare varietate de factori de rezistență antimicrobiană, care prezintă probleme grave în managementul pacienților cu infecții enterococice (8). În general, izolatele enterococice cu susceptibilitate redusă la vancomicină pot fi clasificate ca vanA, vanB și Vancouver. vanA și vanB reprezintă cea mai mare amenințare, deoarece sunt cele mai rezistente, iar genele de rezistență sunt purtate pe o plasmidă. Deoarece genele de rezistență sunt purtate pe o plasmidă, ele sunt ușor transferabile, E. faecalis poate transfera aceste plasmide prin conjugare (2). E. faecalis sunt, de asemenea, rezistente la teicoplanină. Au fost găsite tulpini enterococice dependente de vancomicină, dar sunt rare și mai puțin frecvente decât tulpinile rezistente la vancomicină (denumite „Enterococci rezistenți la vancomicină” sau „VRE”) (1).
structura genomului

datorită multor pericole pentru sănătatea publică, datele secvenței genomului dintr-o tulpină de Enterococcus au fost necesare. Tulpina aleasă pentru secvențierea ADN-ului genomului a fost E. faecalis V583, primul izolat rezistent la vancomicină din Statele Unite. Genomul tulpinii V583 a fost secvențiat de Institutul de cercetare a genomului (TIGR). Genomul enterococic arată că E. faecalis este metabolic divers și conține o gamă largă de sisteme de reglementare. Tulpina V583 conține patru molecule de ADN: principalul cromozom bacterian 3,218,030 pereche de baze și trei plasmide circulare. Cromozomul conține aproximativ 3.500 de cadre de citire deschise (ORFs), aproximativ 1/3 din aceste ORFs nu au nicio funcție atribuibilă (8). Cele trei plasmide sunt molecule circulare de ADN identificate ca plasmidă-1, plasmidă-2 și plasmidă-3. Plasmida-1 conține 66.320 bp, plasmida-2 conține 17.963 bp, iar plasmida-3 conține 57.660 bp. Plasmidele codifică un număr de gene, inclusiv transpozaze, proteine de rezistență la mai multe medicamente și un inhibitor de creștere reglementat de ppGpp (8). Compoziția medie G + C a cromozomului E. faecalis este de 37,38%. Deoarece molecula ADN este atât de mare, apar abateri regionale de la medie. Una dintre aceste locații este segmentul mare asociat cu „grupul de gene de rezistență la vancomicină poziționat lângă 2,22 Mb”, care arată o creștere mare a conținutului procentual de G+C (8). Aceste diferențe asociate cu rezistența la antibiotice sau virulența au sugerat achiziționarea de material genetic de la o specie străină prin transfer orizontal. Încă nu se știe dacă transferurile sunt responsabile pentru variațiile în structura ADN-ului. Informațiile conținute în genomul E. faecalis V583 va ajuta foarte mult la înțelegerea modului în care organismul s-a adaptat pentru a fi un agent patogen uman versatil. Folosind genomica comparativă, rolul diferitelor elemente de reglementare va fi mai bine înțeles în modul în care acestea răspund la diferite stresuri de mediu și în exprimarea potențialilor factori de virulență (8). Mai multe studii ca acestea vor sugera noi medicamente pentru infecțiile bacteriene cauzate de enterococi.Genomul conține, de asemenea, 3 operoni Ebp (care codifică Pili-ul asociat cu biofilmul endocarditei) care sunt importanți pentru producerea biofilmului tulpinii E. faecalis OG1RF. Această tulpină folosește acești operoni pentru a produce Pili de suprafață. . Pilii de suprafață sunt utilizați pentru „atașarea la suprafețele gazdă și sunt antigenici la om în timpul endocarditei” (9).
TIGR conține o listă completă de gene pentru cromozomii E. faecalis.
structura celulară și metabolismul
metabolismul celular
enterococii locuiesc în medii dure, cum ar fi tracturile intestinale ale oamenilor și animalelor. Creșterea în aceste condiții ostile necesită ca E. faecalis să aibă un metabolism flexibil. E. faecalis sunt capabili nu numai de fermentație pentru a produce acid lactic, ci și pot „cataboliza un spectru de surse de energie din carbohidrați, glicerol, lactat, malat, citrat, diaminoacizi și mulți-cetoacizi” (3).s-a demonstrat că, în condiții de creștere selectate, E. faecalis poate spori creșterea prin fosforilarea oxidativă folosind o forță motrice protonică stabilită prin transportul electronilor. O consecință a” respirației în curs de formare este producerea de oxidanți puternici ” (de exemplu, superoxid și peroxid de hidrogen), stresul oxidativ pe care E. faecalis îl poate tolera (3). Toleranța acestui stres, combinată cu alte condiții severe de creștere, permite E. faecalis să crească la 10 până la 45 de centi C, în săruri biliare și la pH-uri extrem de scăzute și ridicate. În plus, E. faecalis poate rezista la azide, detergenți, metale grele și etanol. Deoarece E. faecalis poate utiliza surse variate de zahăr, poate trăi în medii diverse, în special în intestin, unde nutrienții sunt limitați (2). În intestin, E. faecalis își derivă cea mai mare parte a energiei din fermentarea zaharurilor neabsorbite. E. faecalis poate obține, de asemenea, energie prin degradarea mucinelor, un carbohidrat care este puternic glicozilat și produs de celulele calciforme intestinale (2).E. faecalis folosește un „sistem fosfoenolipiruvat fosfotransferază (PTS) pentru a simți zaharurile în afara celulei și cuplează absorbția zaharurilor cu fosforilare” (2). Procedând astfel, mai puțină energie (ATP) este irosită în comparație cu modul în care zahărul este acumulat de sistemele non-PTS. Zaharurile metabolizate de E. faecalis includ: D-glucoză, d-fructoză, lactoză, maltoză (toate substraturile PTS). În enterococi, PTS reglează, de asemenea, metabolismul glicerolului, expulzarea inductorului și reprimarea catabolitului (8). E. faecalis este una dintre puținele bacterii Gram-pozitive cu conținut scăzut de G+C care expulzează zahărul în timpul creșterii pe glucoză, fenomen cunoscut sub numele de expulzarea inductorului (8). E. faecalis poate chiar să fermenteze glicerolul în condiții aerobe și microaerofile. E. faecalis poate crește și pe glicerol în condiții anaerobe, deoarece „exprimă o genă pentru activitatea dehidrogenază anaerobă legată de nad+” (8). Glicerolul poate traversa membrana celulară folosind o proteină numită facilitator de difuzie a glicerolului (GlpF). GlpF face ca concentrația de glicerol în interiorul și în exteriorul celulei să fie egală, proteina fiind inhibată de glicoliză. E. faecalis sunt capabili să trăiască în pH alcalin extrem și concentrație mare de sare. Aceste trăsături necesită transportul cationic pentru a menține compoziția constantă a ionilor citosolici esențiali pentru homeostazie. Toate celulele trebuie să expulzeze excesul de sodiu pentru a menține concentrațiile citosolice în intervalul care favorizează homeostazia. E. faecalis exprimă atât un antiporter Na+/H+, cât și o ATPază de tip vacuolar (2). Potasiul este un cation intracelular major. Concentrația de potasiu din E. faecalis de 0,4 până la 0,6 m este esențială pentru metabolismul celular normal, „neutralizează anionii intracelulari, activează diverse enzime și reglează pH-ul citosolic” (8). E. faecalis exprimă cel puțin doi transportori de potasiu pentru a efectua reglarea, KtrI și KtrII împreună cu sistemul Kep pentru extrudarea K+ (8). Deși se știe că KtrI și KtrII sunt sisteme de absorbție K +(sunt simporteri K+/H+), se cunosc puțin mai multe proteine.
structura celulară
enterococii sunt cocci Gram-pozitivi care formează de obicei lanțuri scurte sau sunt aranjați în perechi (3). În anumite condiții de creștere, acestea se pot alungi și pot apărea coccobacilare. Peretele celular al E. faecalis este de 20 până la 38% din greutatea celulei uscate (în celulele de fază exponențială și staționară). Având în vedere că E. faecalis este o bacterie Gram-pozitivă, există trei componente principale care alcătuiesc peretele celular: peptidoglican, acid teichoic și polizaharidă. 40% din peretele celular este alcătuit din peptidoglican, în timp ce restul peretelui celular este alcătuit dintr-o „polizaharidă care conține ramnoză și un acid teichoic care conține ribitol” (3). Peptidioglicanul funcționează (ca în majoritatea celulelor Gram-pozitive) pentru a rezista la spargerea indusă de presiunea osmotică citoplasmatică ridicată. E. faecalis este în general considerat un organism necapsulat, demonstrat de” lipsa unui fenotip mucoid detectabil ” (3). Cu toate acestea, subseturile de izolate E. faecalis posedă o polizaharidă capsulară. E. faecalis poate schimba material genetic (plasmide) prin procese de conjugare induse de feromoni peptidici mici (2). Proteina de suprafață „substanțele de agregare care recunosc un ligand specific pe celulele receptoare” asigură conexiuni de succes pentru conjugare (2).E. faecalis au, de asemenea, capacitatea de a face Pili de suprafață care poate duce la formarea unui biofilm. Tulpinile E. faecalis care provoacă endocardită conțin cantități mari din aceste pili. Pili permite atașarea la suprafețele gazdă (de exemplu, țesutul cardiac). Tulpinile lui E. fecalele care provoacă endocardită produc „biofilmul semnificativ mai des și, de asemenea, într-o măsură mai mare decât izolatele non-endocardite” (9).
Ecologie
E. faecalis este o specie foarte diversă de enterococi. Interacționează cu multe alte organisme și are efecte asupra mediului. Enterococii sunt membri ai comunității bacteriene care locuiește în intestinul gros la om. Ele sunt, de asemenea, o parte naturală a florei intestinale în cele mai multe alte mamifere și păsări (8). Enterococii se găsesc și în sol, plante și apă. Când se găsesc în apă, este de obicei pentru că apa a fost contaminată cu materii fecale. Deși E. faecalis nu apare prea des în plante, alte tulpini de enterococi au fost găsite printre plante și este cel mai probabil să se facă la o sursă de apă contaminată (8).Ecologia rezistenței la antibiotice și a transferului de gene de virulență în mediu nu este încă bine înțeleasă. Insectele, cum ar fi muștele de casă (HF), care se dezvoltă în materialul organic în descompunere pot transmite bacterii rezistente la antibiotice din gunoiul de grajd al animalelor și din alte substraturi organice în descompunere în medii rezidențiale (7). HF sunt transmițătoare perfecte datorită comunităților microbiene vii prezente în habitatele în care se dezvoltă (de exemplu, fecale). Adăugarea la calitățile bune de transfer sunt modul în care HF își hrănesc tinerii (regurgitarea) și atracția lor față de alimentele umane. Deoarece HF poate zbura pe distanțe lungi, această insectă este foarte bună pentru răspândirea bacteriilor fecale, inclusiv a agenților patogeni umani și animale și, eventual, a tulpinilor de enterococi rezistente la antibiotice (7). Un studiu recent a examinat rezistența la antibiotice și genele de virulență la enterococi de la HF în restaurantele fast-food din Kanasas. Acest studiu a arătat că „muștele de casă din instalațiile de manipulare și servire a alimentelor pot transporta enterococi rezistenți la antibiotice și potențial virulenți care au capacitatea de transfer orizontal al genelor de rezistență la antibiotice către alte bacterii” (7).Efectele pe care E. faecalis are asupra mediului tind să fie mai negativ. Acestea contaminează de obicei aprovizionarea cu apă care poate duce la plante infectate, precum și la infecții la oameni (8). Factorii antibiotici pot fi, de asemenea, transportați de diverse insecte (de exemplu, muște de casă) și animale, ceea ce duce la creșterea numărului de E. faecalis virulent.
patologia
enterococii au apărut ca o cauză majoră a infecțiilor nosocomiale, iar în cadrul acestui grup Enterococcus faecalis provoacă majoritatea infecțiilor enterococice umane. Aceste infecții pot fi locale sau sistematice și includ infecții ale tractului urinar și abdominale, infecții ale rănilor, bacteremie și endocardită (2). Deoarece E. faecalis este capabil să supraviețuiască numeroaselor provocări de mediu (cum ar fi temperaturile extreme și prezența sărurilor biliare) și pentru că pot dobândi rezistență la antibiotice multiple, aceste bacterii au devenit o problemă majoră de sănătate. Sistemul Național de Supraveghere a infecțiilor nosocomiale (NNIS) a raportat creșteri ale incidenței infecțiilor datorate enterococilor rezistenți la vancomicină (VRE) din 1989 (1). Aceasta poate însemna probleme grave de sănătate, care includ lipsa terapiei cu antibiotice disponibile pentru infecțiile cu VRE, deoarece majoritatea tulpinilor VRE prezintă rezistență la antibiotice multiple în afară de vancomicină (de exemplu, aminogliscoide și ampicilină). Transferul genelor rezistente la vanocmicină de la VRE la alți agenți patogeni Gram-pozitivi este o preocupare serioasă pentru sănătatea publică. Cel mai frecvent mod în care infecția cauzată de E. faecalis apare într-un spital/unitate de îngrijire pe termen lung este transmiterea E. faecalis între pacienți (8). Enterococii pot fi transportați pe mâinile lucrătorilor din domeniul sănătății și pot fi transportați (transferați) de la un pacient la altul. S-a demonstrat că VRE pe mâini poate persista până la 60 de minute (8). Transmiterea de la mâinile unui lucrător medical la pacient ar putea avea loc la contactul cu cateterele intravenoase sau urinare ale pacientului. Termometrele rectale, care nu sunt curățate corespunzător după utilizare, pot transmite VRE de la pacient la pacient. Uneori, transmiterea poate duce la colonizarea tractului GI al pacientului cu tulpina dobândită. Noua tulpină devine apoi parte a florei endogene a pacientului (8). Tulpina dobândită, care poartă gene de rezistență la antibiotice, este capabilă să trăiască în tractul GI. Infecțiile apar apoi din aceste tulpini de E. faecalis nou dobândite.E. faecalis poate provoca multe infecții în corpul uman. Cea mai frecventă infecție cauzată de Enterococci este infecția tractului urinar. E. faecalis poate provoca infecții ale tractului urinar inferior (UTI), cum ar fi cistită, prostatită și epididimită (8). E. faecalis se găsesc și în infecțiile intraabdominale, pelvine și ale țesuturilor moi. E. faecalis poate provoca bacteremie nosocomială. Sursa bacteremiei este cel mai adesea tractul urinar, care apare dintr-un cateter intravenos infectat. Endocardita este cea mai gravă infecție enterococică, deoarece provoacă inflamația valvelor cardiace. În multe cazuri de endocardită, tratamentul cu antibiotice eșuează și este necesară intervenția chirurgicală pentru îndepărtarea valvei infectate (8). Infecțiile mai puțin frecvente cauzate de E. faecalis includ meningita, hematogena, osteomielita, artrita septică și (foarte rar) pneumonia. Datorită rezistenței enterococilor la multe antibiotice, tratamentul acestor infecții este dificil.
aplicarea la biotehnologie
enterococii au fost studiați pentru o posibilă utilizare ca probiotic (un supliment alimentar care conține celule microbiene nevirulente vii care, atunci când sunt ingerate, se consideră că afectează în mod benefic compoziția microflorei intestinale). S-a demonstrat că administrarea tulpinii E. faecalis reduce diareea. Probioticele E. faecalis sunt utilizate în hrana puilor/porcilor/bovinelor pentru a reduce diareea la animale (8).datorită proprietăților ridicate ale E. faecalis, s-au efectuat mult mai multe cercetări cu privire la modul de oprire a virulenței E. faecalis decât utilizarea benefică a E. faecalis.
cercetare curentă
1.) Speranța pentru infecțiile cauzate de Enterococcus faecalis (4)
se știe că bacteriile rezistente la vancomicină (de exemplu, E. faecalis) prezintă multe probleme societății, provocând infecții bacteriene la om dificil de tratat. Infecțiile enterococice sunt provocatoare, deoarece organismele au capacitatea de a dobândi și disemina rapid genele de rezistență. Ceftobiprolul (BPR) a fost utilizat ca cefalosporină investigativă împotriva cocilor Gram-pozitivi. BPR este o cefalosporină parenterală cu spectru larg, cu afinități ridicate din proteine Gram-pozitive și Gram-negative care leagă penicilina. De asemenea, prezintă stabilitate împotriva hidrolizei prin lactamaze-lactamaze.Acest studiu a examinat activitatea BRP împotriva unei colecții mari de E. faecalis, analizând activitatea bactericidă a BPR împotriva izolatelor rezistente la vancomicină. Studiul a constatat că susceptibilitatea la BPR în E. faecalis nu este afectată de prezența rezistenței la vancomicină sau de producția de lactamază-lactamază. La tulpinile de E. faecalis care prezintă fie rezistență la vancomicină (fenotipuri VanA și VanB), fie rezistență la ampiciliină, BPR a fost bactericid. Cercetătorii au arătat că BPR a prezentat activitate bactericidă împotriva E. faecalis la o doză de 750 mg, inhibând 100% din activitatea E. faecalis. Deși prezența enzimei lactamază-lactamază este rară în E. faecalis, prezența acesteia compromite utilizarea celor mai eficiente anti-enterococice-lactame (de exemplu, ampicilină). BPR este un substrat slab pentru enzima-lactamază de la xixt, explicând activitatea sa excelentă împotriva E. faecalis producătoare de lactamază de la xixt.Această cercetare a demonstrat că BPR are o activitate puternică împotriva unei colecții foarte mari de E. faecalis. Activitatea BPR nu a fost afectată de rezistența la vancomicină sau de producerea de lactamază-lactamază. Prin urmare, BPR este un agent plin de speranță pentru utilizarea în tratamentul infecțiilor cu E. faecalis producătoare de lactamază și rezistente la vancomicină la om.
2.) Examinând modul în care Enterococcus faecalis devine rezistent la medicamentul linezolid (5)
când antibioticele sunt utilizate în tratamentul unei infecții bacteriene, acestea pot avea un impact asupra florei intestinale. Bacteriile rezistente pot fi selectate în timpul tratamentului, cum ar fi enterococii, și sunt potențial patogene. Apariția rezistenței este o problemă pentru noile antibiotice, deoarece ar putea risca utilitatea antibioticelor.Acest studiu a examinat apariția rezistenței la antibiotice de către E. faecalis. Mai precis, cercetătorii au analizat rezistența la linezolid (primul dintr-o nouă clasă de antibiotice cunoscută sub numele de „oxazolidinone”). Linezolidul poate fi utilizat împotriva cocilor Gram-pozitivi rezistenți la mai multe medicamente, inclusiv VRE. Inhibă sinteza proteinelor bacteriene prin legarea specifică la un domeniu din subunitatea ribozomală 50S și nu este afectată de mecanismele de rezistență care afectează alte antibiotice. Acest studiu a analizat rata de apariție a mutanților E. faecalis rezistenți la linezolid în tractul digestiv al șoarecilor gnotobiotici. Does de linezolid a fost alimentat în apă cu doze variind de la 0,5, 0,005 la 0,005 g/L. mutanții au fost toți dependenți de linezolid dat, nivelurile de rezistență au crescut odată cu durata expunerii. Nu au fost izolați mutanți în absența linezolidului, ceea ce sugerează că rezistența de novo la linezolid a fost mai puțin frecventă la enterococi.Cercetarea a constatat că o mutație într-o singură genă rRNA 23S a fost pasul critic în apariția rezistenței la linezolid. Colonizarea primară cu mutanți cu o singură mutație a fost observată încă din 5 zile după inițierea tratamentului la șoareci.Aceste experimente care implică șoareci ajută la explicarea modelului de apariție a rezistenței la linezolid observat în izolatele clinice. Echipa de cercetare a arătat că doza este esențială pentru dinamica rezistenței. Aceste constatări ar trebui să ajute la definirea celor mai bune strategii terapeutice pentru a minimiza apariția rezistenței în mediul clinic, salvând eventual multe vieți.
3.) Se constată că o ser/THR kinază din Enterococcus faecalis mediază rezistența antimicrobiană (6)
Enterococcus faecalis provoacă multe dintre infecțiile rezistente la antibiotice în spitale, o consecință a rezistenței sale inerente la anumite antibiotice și a capacității sale de a supraviețui și de a prolifera în tractul intestinal.Baza genetică a rezistenței observate în E. faecalis nu este bine cunoscut, această cercetare încearcă să identifice o cauză a rezistenței. Cercetătorii au arătat că PrkC, o proteină de semnalizare cu un singur component care conține un domeniu de kinază ser/Thr de tip eucariot, a permis rezistența antimicrobiană inerentă și persistența intestinală a E. faecalis. Ei au descoperit că un mutant E. faecalis lipsit de PrkC a crescut la o rată de tip sălbatic în absența stresului antimicrobian, dar a arătat o sensibilitate sporită la compușii activi ai celulelor, inclusiv antibioticele care au vizat biogeneza peretelui celular și detergenții biliari.PrkC reglementează procesele fiziologice din E. faecalis care sunt esențiale pentru succesul său ca agent patogen nosocomial. Structura prezisă de cercetători a PrkC a fost un domeniu de kinază citoplasmatică separat de un segment transmembranar despre care se crede că leagă peptidoglican fără legătură încrucișată. Acest lucru a sugerat că PrkC a fost un receptor transmembranar care monitorizează integritatea peretelui celular E. faecalis și mediază răspunsurile adaptive pentru a menține acea intergritate. PrKC este important pentru E. faecalis pentru a provoca infecții nosocomiale, sugerând că proteina de semnalizare este o țintă pentru dezvoltarea terapiilor pentru prevenirea infecțiilor prin enterococi rezistenți la antibiotice.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. „Rolul ADN-ului mobil în evoluția Enterococcus faecalis rezistent la vancomicină.”Știință. Martie 2003. Vol. 299, nr. 5615. p. 2071-2074
2.) Murrary fi. Mai 1998. „Diversitatea în rândul enterococilor multirezistenți.”Boli Infecțioase Emergente. Vol. 4, Nr. 1. p. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo și Janet T. Shigei. Atlas de culoare Al bacteriologiei medicale. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. „Studii de timp și sinergism ale ceftobiprolului împotriva Enterococcus faecalis, inclusiv izolate producătoare de lactamază și rezistente la vancomicină.”Agenți antimicrobieni și chimioterapie. Iunie 2007. Vol. 51, nr. 6. p. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. ” dependența de doză a apariției rezistenței la Linezolid în Enterococcus faecalis in Vivo.”Jurnalul bolilor infecțioase. 2007. Vol. 195. p. 1480-1488.
6.) Kristich C., Wells C., Dunny G. „O Ser/THR kinază de tip eucariot în Enterococcus faecalis mediază rezistența antimicrobiană și persistența intestinală.”Lucrările Academiei Naționale de științe din Statele Unite ale Americii. Februarie 2007. Vol. 104, Nr. 9. p. 3508-3513.
7.) Macovei, L., Zurek, L. „ecologia genelor de rezistență la antibiotice: caracterizarea enterococilor din muștele de casă colectate în setările alimentare.”Microbiologie aplicată și de mediu. Iunie 2006. Vol. 72, nr. 6. p. 4028-4035.
8. Gilmore, Michael. Enterococii: patogeneză, Biologie Moleculară și rezistență la antibiotice. Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanp J J, Garsin Da, h Inktok m, Erlandsen SL, Murray be.. „Endocardita și piliul asociat biofilmului Enterococcus faecalis.”Jurnalul de Investigații Clinice. Octombrie 2006. Nr. 116. p. 2799-2807.
editat de Richard A. Martinez de la UC San Diego, student al lui Rachel Larsen.