ce este Ionic Bonding?
legăturile chimice se formează atunci când energia totală a atomilor legați este mai mică decât energia totală a atomilor separați.Forma pe care o ia legătura este determinată de aranjamentul electronilor care minimizează energia.
în unele cazuri, electronii sunt împărțiți între atomi – aceasta se numește legătură covalentă.
în alte cazuri, există un transfer complet al unuia sau mai multor electroni de la un atom la altul.Atomul care pierde electroni devine un ion încărcat pozitiv.Atomul care primește electroni devine un ion încărcat negativ.
aceasta duce la lipirea Ionică – atracția electrostatică reciprocă dintre pozitiv și negativ charges.In forma sa cea mai pură, legătura ionică nu este direcțională. Poate fi privită ca o simplă atracție Coulombică între sarcinile punctuale.Acest lucru este diferit de legătura covalentă, în care împărțirea electronilor are ca rezultat legături direcționale.
transfer de electroni
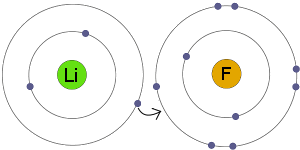
Li transferă un electron la F. rezultatul este că ambii ioni rezultați deveniți încărcați electric și aveți cochilii de electroni complete și stabile.
atracție electrostatică
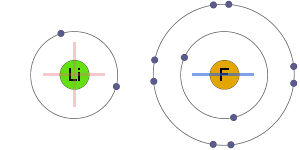
ionii pozitivi și negativi sunt atrași electrostatic unul de celălalt, rezultând o legătură ionică.
forța coulombică nu are o direcție preferată, rezultând că compușii ionici tind să existe ca structuri gigantice de zăbrele cristaline ale ionilor împachetați împreună.
un eșantion de rețea cristalină de fluorură de litiu

electronegativitate și legătură ionică
două elemente vor tinde să se lege ionic atunci când diferă foarte mult în electronegativitate.
tabelul Periodic al electronegativității
cu cât nuanța verde este mai deschisă, cu atât electronegativitatea este mai mare. Gri înseamnă că nu se cunoaște nicio valoare. (Click pe imagine pentru vizualizare mai mare.)

caracterul de legătură covalentă
compușii legați ionic absolut pur nu există cu adevărat, deoarece ionul încărcat pozitiv polarizează norul de electroni al ionului negativ.Acest lucru este deosebit de vizibil atunci când se ocupă de ioni metalici mici, foarte încărcați, cum ar fi Al3+, deși efectul polarizant este prezent într-o oarecare măsură în toți compușii ionici.Polarizarea este efectiv un efect direcțional, de partajare a electronilor, prin urmare introduce o cantitate mică de covalență în compușii ionici.
proporția comportamentului ionic / covalent într-o legătură poate fi evaluată foarte aproximativ folosind scara Pauling a electronegativității.Linus Pauling a estimat că o diferență de electronegativitate de 1,7 între elemente duce la o legătură care este de 50% Ionică.
Valorile de sub 1 corespund legăturii covalente dominante, iar valorile de peste 2 corespund legăturii ionice dominante.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
legătura C-H cu o diferență de 0,35 va fi covalentă, în timp ce legătura NaCl la 2,23 va fi Ionică.Legarea HCl la 0,96 va fi covalentă polară, iar legarea LiI la 1,68 va fi de 50/50 ionic/covalent.
cea mai mare diferență de electronegativitate este 3,19, între cesiu (0,79) și fluor (3,98). Legătura rezultată are un caracter ionic de aproximativ 95%.
