SF6 er en uorganisk drivhusgas. Den er ikke brandfarlig, lugtfri og farveløs og er en fremragende isolator. Det er et hypervalent oktaedrisk molekyle, der har været et interessant samtaleemne blandt kemientusiaster.
Henri Moissan opdagede eksistensen af SF6. I øvrigt er han også opdageren af fluor. Standardmetoden til syntese af SF6 er at udsætte S8 For F2. Denne metode forårsager dannelsen af et par svovlfluorider, men disse kan elimineres ved opvarmning og derefter bruge NaOH til at fjerne eventuelle yderligere SF4-molekyler.
SF6 kan ikke anvendes umiddelbart efter syntese. Det skal renses for at slippe af med alle reaktive fluorider. Derefter skal det gå gennem pyrolyse.
her i dette blogindlæg lærer vi strukturen af SF6 og dens Bindingsvinkler, molekylær geometri og form, der kan hjælpe os med at forstå de fysiske egenskaber ved dette molekyle.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
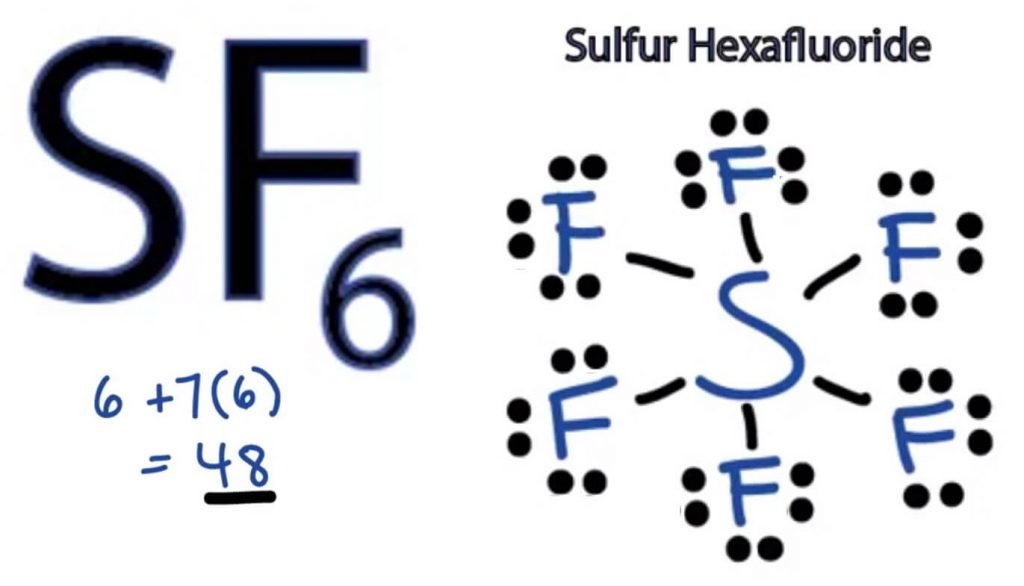
To determine the Lewis Struktur af ethvert molekyle, skal vi først kende det samlede antal valenselektroner. Her finder vi ud af det samlede antal valenselektroner til SF6 ved at tilføje valenselektronerne til både svovl-og fluoratomer.
samlet antal valenselektroner i SF6 – valenselektroner af svovl + valenselektroner af fluor
svovl har seks valenselektroner.
fluor har syv valenselektroner, men da der er seks fluoratomer i dette molekyle, multiplicerer vi dette tal med 6.
= 6 + 7*6
= 6 + 42
= 48 valenselektroner
således har SF6 48 valenselektroner, der vil hjælpe os med at tegne SF6 ‘ s livsstil.
SF6 struktur
strukturen af ethvert molekyle er en billedlig repræsentation af de atomer, der er involveret i dannelsen af strukturen og dens individuelle valenselektroner. Denne struktur hjælper os med at kende bindingsformationerne i molekylet og arrangementet af elektroner i det.
svovlatom vil indtage den centrale position, da det er mindre elektronegativt end fluor. Så placer det i midten og alle fluoratomer omkring det sådan:
fluoratom har kun brug for en valenselektron for at fuldføre sin oktet. Da hvert atom følger oktetreglen for at opnå en stabil struktur, vil fluoratomet dele en valenselektron af svovlatomet. Svovl vil således dele seks af sine valenselektroner med alle fluoratomer, der resulterer i dannelse af seks enkeltbindinger mellem S og F. Så alle disse bindinger vil tage op 12 valenselektroner ud af 48.
Placer alle de resterende valenselektroner omkring Fluoratomerne, og kontroller, om oktetterne af alle fluoratomer er komplette.
når du gør det, vil du se valenselektroner i de ydre skaller af alle fluoratomer, men svovl har mere end 8 elektroner i sin ydre skal. Dette skyldes, at det er en undtagelse fra oktetrollen og kan udvide sin orbital for at rumme flere elektroner.
derfor er dette den rigtige struktur af SF6.
SF6 hybridisering
nu hvor vi kender uvis struktur af SF6, kan vi nu bestemme atomernes hybridisering i molekylet. Her som svovl deler sine elektroner med fluoratomer, vil vi se på dens hybridisering.
den elektroniske konfiguration af SF6 i sin jordtilstand er 3s23p4. Men når den deler elektroner og er i ophidset tilstand, bliver elektronparene i både 3s og 3p orbitaler uparrede. Disse elektroner bevæger sig for at udfylde de højere ledige 3D-orbitaler. Som et resultat dannes seks hybridorbitaler ( en af 3s, tre af 3p og to 3D). Disse hybrid orbitaler er dem, der rummer de delte elektroner. Disse orbitaler overlapper med 2p-orbitalerne i fluoratomet, når svovl-og fluoratomer danner bindinger. Disse seks orbitaler er i de seks retninger af oktaedronformen.
derfor har Svovlgeksafluorid sp3d2-hybridisering.
SF6 bindingsvinkel
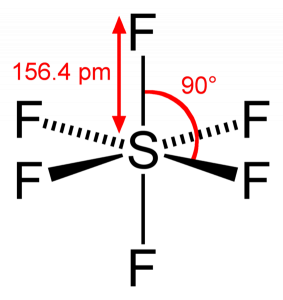
da svovl deler sine valenselektroner med 6 fluoratomer, kan vi se, at alle seks elektroner i svovlatomet deles for at danne bindinger. Bindingsvinklen på F – S-F er 90 grader.
SF6 molekylær geometri
Når vi ser på svovl Geksafluorid molekyle, svovl er i den centrale position med fluor atomer arrangeret symmetrisk omkring det. Atomerne placeres i det oktaedriske mønster, hvilket gør den molekylære geometri af SF6 er oktaedrisk.
SF6-form
Når vi ser på molekylets molekylære geometri, kan vi sige, at SF6-molekylet har en oktaedrisk form, da den har otte sider. Imidlertid binder det centrale atom med seks fluoratomer, formen af SF6 er oktaedrisk.

er SF6 polær eller ikke-polær?
SF6 er et ikke-polært molekyle. Dette skyldes, at VSEPR-teorien siger, at når seks fluoratomer er arrangeret symmetrisk omkring svovlatomet, annulleres bindingsdipolerne. Som et resultat er det et ikke-polært molekyle.

afsluttende bemærkninger
for at opsummere denne artikel kan vi sige, at alle valenselektronerne i SF6 er opbrugt, hvilket resulterer i dannelse af seks enkeltbindinger mellem S-F uden ensomme par elektroner.
hybridiseringen af svovl i dette molekyle er sp3d2 med bindingsvinklerne på 90 grader.
den molekylære geometri af SF6 er oktaedrisk, og det er et ikke-polært molekyle.