compușii Antiaromatici sunt neobișnuit de instabili
care sunt factorii cheie care determină dacă o moleculă este antiaromatică?
în postările noastre anterioare din seria noastră despre aromaticitate , , am văzut că moleculele aromatice sunt neobișnuit de stabile. Au energii de rezonanță deosebit de mari, tind să sufere mai degrabă reacții de substituție decât de adăugare și au electroni pi delocalizați (toate lungimile legăturii C-C din benzen sunt egale, de exemplu).
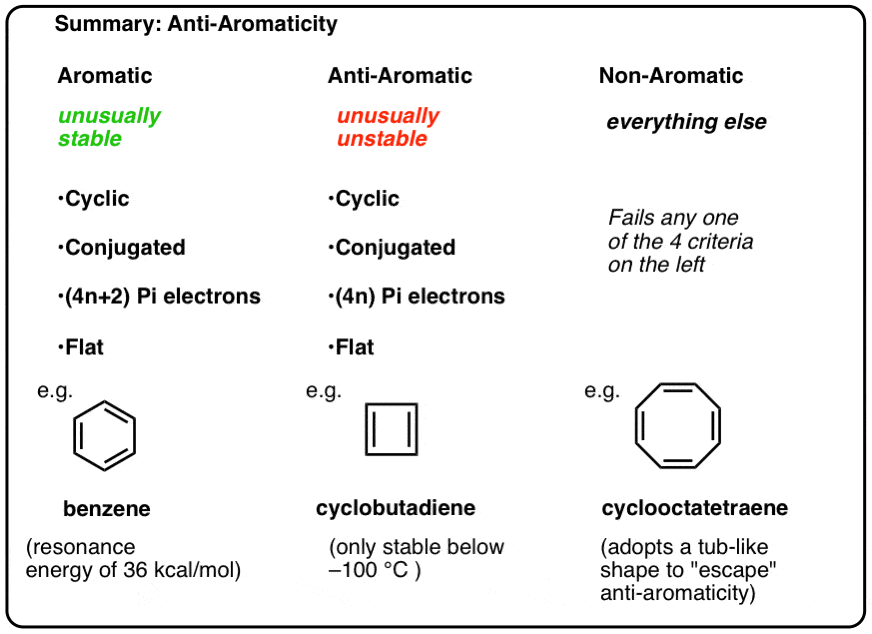
pentru a fi aromatică, o moleculă trebuie să aibă următoarele patru caracteristici structurale:
- ciclic
- conjugat în jurul inelului
- au electroni pi
- plat (planar)
dacă aceste patru condiții sunt îndeplinite, molecula este aromatică.
dacă pică chiar și o întrebare la test, este non-aromatic.
asta pare a fi destul de clar. Sau este?
s-ar putea ghici din modul în care am încadrare această întrebare că răspunsul este „nu chiar”. :- )
cuprins
- unele molecule sunt atât de spectaculos și neobișnuit de instabile și greu de izolat încât merită propria lor Categorie:Antiaromatic
- cation Ciclopentadienil: Carbocația „stabilizată prin rezonanță” care nu este stabilă
- Inele Antiaromatice cu trei membri: Oxiren, 1h-Aziren, Tiiren
- Ciclobutadiena este Antiaromatică
- un exemplu de 8 pi-electron al unui compus Antiaromatic: Pentalen
- ce face o moleculă Anti-aromatică?
- Ciclooctatetraena „scapă” Anti-Aromaticitatea prin răsucirea din planeitate
- concluzie: compuși Antiaromatici
- Note
- avansat: referințe și lecturi suplimentare
1. Molecule spectaculos instabile care formează o categorie pentru ei înșiși:”Anti-Aromatic”
Iată chestia. Există un număr mic de molecule care pică testul de aromaticitate care nu sunt doar non-aromatice: au proprietatea de a fi atât de spectaculos și neobișnuit de instabili și greu de izolat încât merită un alt nume.
numim aceste molecule „anti-aromatice”.ceea ce este interesant este că, în multe cazuri, moleculele în sine nu par a fi deosebit de instabile de la primele principii, în contrast cu, să zicem, cubane. Destul de amuzant, puteți cumpăra cubane (mai mult sau mai puțin) de la Aldrich, dar majoritatea moleculelor anti-aromatice pe care le vom discuta mai jos sunt stabile doar la temperaturi extrem de scăzute – dacă pot fi izolate deloc!
2. Cation De Ciclopentadienil: Carbocația „stabilizată prin rezonanță” care nu este stabilă
să începem călătoria noastră în gaura iepurelui cu un exemplu simplu care ar trebui să pară familiar din chimia organică din primul semestru.
vă amintiți reacția SN1? Pisica care lasă mai întâi scaunul confortabil?
recenzie rapidă: Începeți cu o halogenură de alchil. Lăsând frunzele grupului, formând o carbocație. Atacuri nucleofile. Se numește SN1 deoarece etapa de determinare a ratei (formarea carbocației) este unimoleculară. Linia de fund: cu cât carbocația este mai stabilă, cu atât reacția se desfășoară mai repede. Prin urmare, viteza de reacție pentru halogenurile de alchil este terțiară > secundar > primar, iar carbocația primește puncte bonus speciale dacă este stabilizată prin rezonanță.
Uită-te la aceste două reacții SN1. Care credeți că s – ar întâmpla mai repede-reacția SN1 care trece printr-o carbocație secundară (a) sau reacția SN1 care trece printr-o carbocație secundară și poate forma mai multe forme de rezonanță (B)?
Din tot ce ai învățat până acum, te-ai aștepta ca răspunsul să fie B).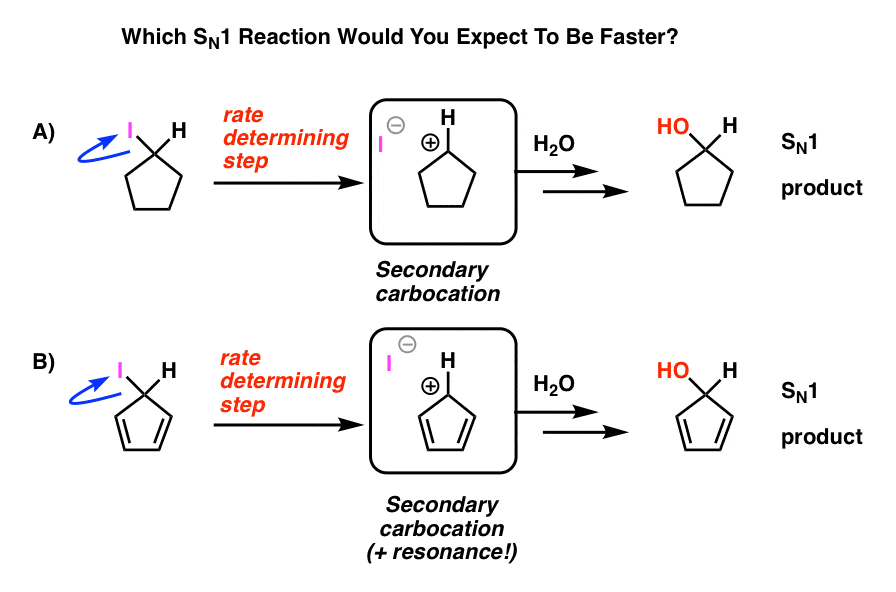
nu este.
răspunsul este că reacția A) se întâmplă mai repede. Reacția B nu se întâmplă deloc.
acest lucru ar trebui să vi se pară profund ciudat.
este!
cum se face că această presupusă carbocație stabilizată prin rezonanță este mai puțin stabilă decât o carbocație secundară?
la urma urmei, de câte ori este forat în capul tău că rezonanța stabilizează moleculele, în special carbocațiile?
dar aici, pare a fi destabilizator. Este… este…

dar instabil este! Cationul ciclopentadienil este incredibil de instabil și dificil de realizat – și nu este din lipsă de încercare. E ceva foarte ciudat în structura cationului ciclopentadienil care îi dă o instabilitate neobișnuită.

ciclic, conjugat, plat…. și are 4 electroni pi. Interesant!
3. Inele antiaromatice cu trei membri: Oxirene, 1h-Azirene, Tiirene
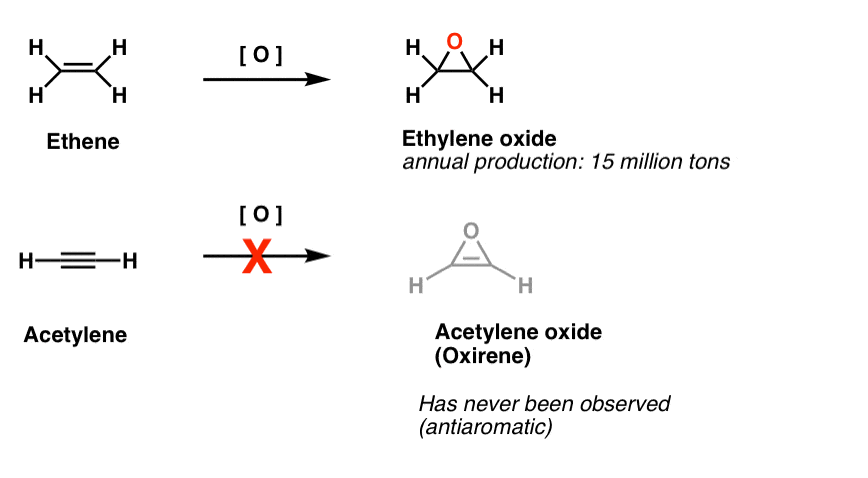
o altă clasă de molecule „evazive” este o familie de inele cu trei membri. S-ar putea să vă amintiți de la Org 1 că este ușor să faceți epoxizi din alchene folosind un oxidant precum M-CPBA.
te-ai întrebat vreodată de ce nu am acoperit niciodată aceeași reacție pentru alchine?
Ei bine, nu este pentru lipsa de a încerca. Chimiștii au încercat tot felul de metode pentru epoxidarea alchinelor și știi ce? Reacția nu funcționează.
de exemplu, epoxidarea acetilenei ar da molecula de mai jos (oxiren).Oxirenul în sine nu a fost niciodată observat, deși există urme tentante ale existenței sale trecătoare. Și apropo, nici analogul de azot, 1H-azirene, sau thirene.
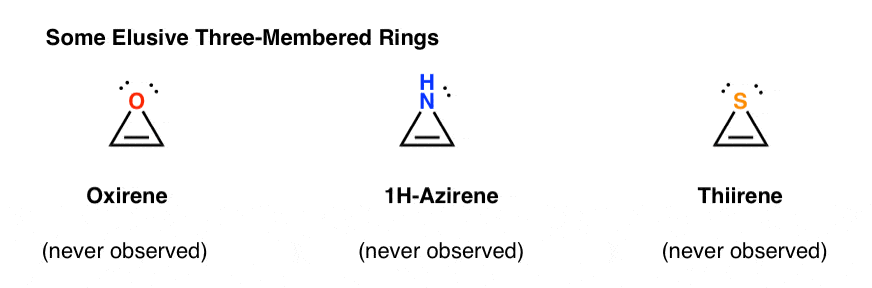
De ce nu? Ce este special la fiecare dintre aceste cazuri?s-ar putea să observați că, la fel ca cationul ciclopentadienil, aceste molecule sunt ciclice, conjugate, plate și au 4 electroni pi (doi în legătura pi și doi dintr-o pereche singură).
OK. Ce altceva ar putea fi ciclic, conjugat, plat și să aibă 4 electroni pi?
4. Ciclobutadiena este Antiaromatică
Ciclobutadiena arată ca o moleculă suficient de simplă, dar nu a fost sintetizată până în 1965. Și chiar și atunci, s-a constatat că nu este stabil la temperaturi peste 35 Kelvin.
întrebarea este, de ce?

sigur, este un inel cu patru membri și da, are o mulțime de tulpini de inel, dar s-au făcut molecule mai tensionate care sunt de fapt stabile la temperatura camerei.
s-ar putea să rețineți, de asemenea, că, la fel ca exemplele de mai sus, ciclobutadiena este un alt exemplu de moleculă care este ciclică, conjugată, are 4 electroni pi și este plată.
ceea ce este și mai interesant este ceea ce s-a învățat despre geometria ciclobutadienei. În loc să fie o moleculă cu lungimi de legătură identice (cum ar fi benzenul), s-a constatat că ciclobutadiena are o formă dreptunghiulară, indicând faptul că electronii nu au fost delocalizați.
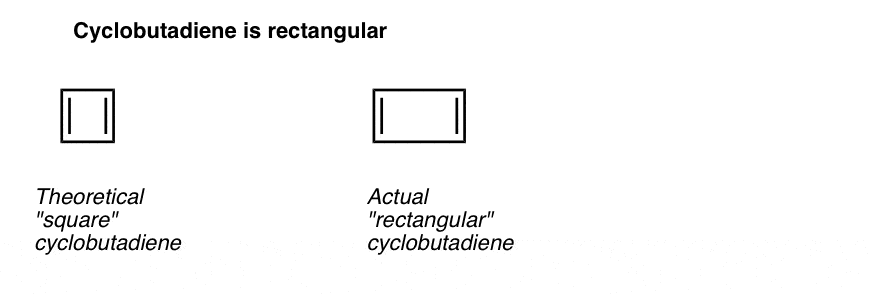
ceea ce ne spune acest lucru este că chiar și atunci când o moleculă îndeplinește toate condițiile (ciclic, conjugat, plat, 4 electroni pi), geometria simetrică este deosebit de instabilă. . Foarte interesant!
un exemplu de 8 electroni Pi ai unui compus Antiaromatic: Pentalena
până acum toate exemplele pe care le-am văzut până acum au avut 4 electroni pi. S-ar putea să vă întrebați: există exemple de molecule anti-aromatice care au mai mult de 4 electroni pi? De ce, da.
molecula de mai jos se numește „Pentalen”. Acesta a fost sintetizat, dar este stabil doar sub -100 C. peste această temperatură se combină cu o altă moleculă de sine (referință). Un alt exemplu de instabilitate spectaculoasă.

Pentalenul are 8 electroni pi. Acest lucru ar putea declanșa unele clopote de alarmă de recunoaștere. Amintiți-vă cum Numărul de electroni pi din moleculele aromatice a urmat secvența (2, 6, 10, 14….) ?
acest exemplu sugerează că numărul de electroni pi din moleculele anti-aromatice urmează secvența (4, 8, 12…)
ce face o moleculă Anti-aromatică?
deci, ce au în comun toate aceste molecule din această galerie a pungașilor?
fiecare dintre ele este ciclic, conjugat și plat – și când numărați numărul de electroni pi, sunt multipli de 4. Deci, în timp ce moleculele aromatice au (4N+2) electroni pi, „regula” pentru moleculele anti-aromatice este (4n). (un alt mod de a-l privi: numărul de electroni pi va fi de două ori un număr par).
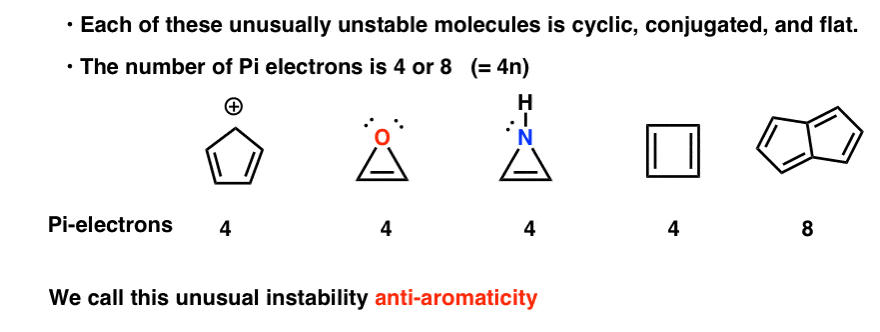
această instabilitate neobișnuită se numește „anti-aromaticitate”.
aceasta înseamnă că acum putem elabora trei categorii pentru molecule conform următoarelor criterii:
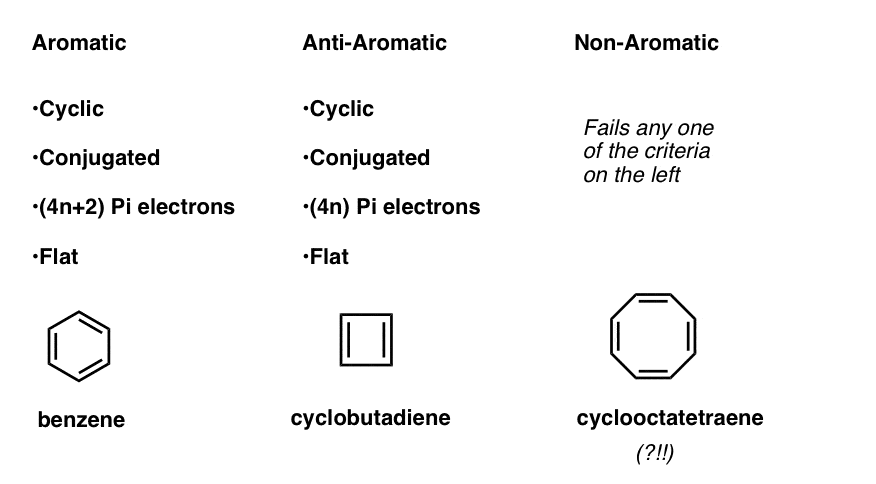
- moleculele aromatice sunt ciclice, conjugate, au (4N+2) electroni pi și sunt plate.
- moleculele Anti-aromatice sunt ciclice, conjugate, au electroni (4N) pi și sunt plane.
- moleculele non-aromatice sunt orice altă moleculă care nu reușește una dintre aceste condiții.
așteptați o secundă – s-ar putea să vă întrebați de ce ciclooctatetraena este clasificată ca „non-aromatică”. Cu 8 electroni pi (de două ori un număr par) nu ar trebui să fie „anti-aromatic”?
Cyclooctatetraene „scapă” Anti-Aromaticitate prin răsucirea din planeitate
gândiți-vă la îndeplinirea condițiilor pentru „anti-aromaticitate” ca la un fel de calificare pentru un impozit pe venit extrem de pedepsitor. Având în vedere posibilitatea de a găsi o lacună pentru a ieși din impozit, ați face-o? Probabil.
Ciclooctatetraena este anti-aromatică numai dacă este plată. Cu toate acestea, structura relativ „floppy” a cyclooctatetraene permite o anumită flexibilitate. Legăturile se pot roti departe de planeitate, astfel încât molecula să adopte o formă „tub-like”, evitând astfel „taxa antiaromaticitate” de 18 12 kcal/mol care ar fi plătită dacă toți p-orbitalii de pe moleculă ar fi conjugați între ei.
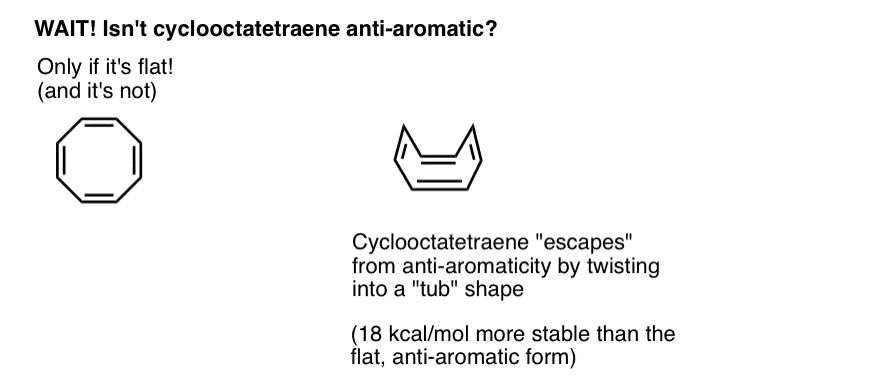
se pare că ciclooctatetraenul a fost sintetizat, este stabil (îl puteți cumpăra aici, de exemplu) și se comportă ca o alchenă „normală”, suferind reacții de adiție, hidrogenare și așa mai departe.
Pentalena (de mai sus) care are și 8 electroni pi, are o structură biciclică foarte rigidă care împiedică rotația legăturilor departe de planeitate. Prin urmare, este blocat în conformația sa anti-aromatică.
Anti-aromaticitatea moleculelor cu mai mult de 8 electroni pi este cunoscută, dar foarte neobișnuită. (Iată un exemplu distractiv de altă” evadare ” din aromaticitate pentru o moleculă cu 18 electroni pi.)
concluzie: compuși Antiaromatici
până în prezent, tratamentul nostru de aromaticitate și anti-aromaticitate a fost pur descriptiv și empiric. Am arătat o mulțime de exemple și am dat o mulțime de reguli, dar lipsește din discuție orice explicație profundă a „de ce”.
ce este atât de special la inelul benzenic care îl face atât de stabil? De ce este stabil?
Ce este atât de special la sistemul ciclobutadienic care îl face atât de instabil. De ce este instabilă?
pentru a răspunde la aceste întrebări mai profunde, va trebui să facem un pas înapoi și să examinăm orbitalii moleculari ai acestor două molecule și apoi să ajungem la o înțelegere mai profundă a aromaticității și anti-aromaticității.
asta vom face în următoarea noastră postare.Vă mulțumim pentru Matthew Knowe pentru ajutor în pregătirea acestui post.
Note
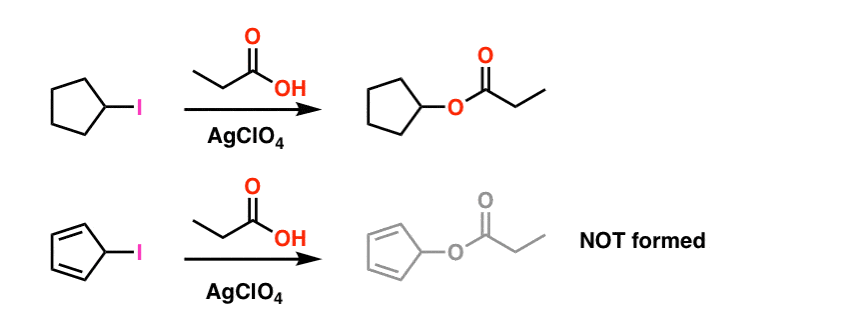
nota de subsol 1. Pentru simplitate, imaginea prezentată în articolul principal se referă la condițiile reale de reacție. Condițiile experimentale reale sunt prezentate mai jos. Solventul este acid propionic, iar percloratul de argint al acidului Lewis este adăugat pentru a ajuta la extragerea iodului. .
chiar și în aceste condiții carbocația ciclopentadienilului nu se formează, ceea ce este o dovadă a instabilității sale extreme.
nota de subsol 2. Epoxidarea pe etenă (aka etilenă) se face în valoare de 15 milioane de tone, anual. Epoxidarea acetilenei pentru a forma oxiren este necunoscută.
au fost găsite dovezi trecătoare ale existenței oxirenelor. Există dovezi bune din studiile de etichetare a izotopilor că oxirenii sunt intermediari trecători în anumite rearanjări Wolff. Există, de asemenea, două exemple de oxirene care au fost prinse la temperaturi extrem de scăzute, dar descompuse peste 35 Kelvin.
existența trecătoare a unui 1h-azirină a fost postulată prin adăugarea unui nitren la o acetilenă, care se rearanjează rapid la un 2h-aziren (stabil) (mai jos).
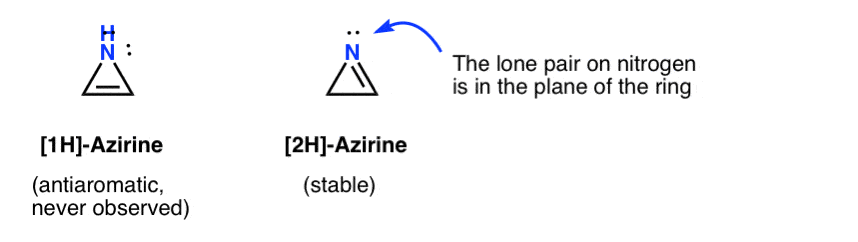
rețineți că în 2h-azirene perechea singuratică pe azot este în unghi drept față de sistemul pi, deci acest sistem este nearomatic spre deosebire de antiaromatic.
pentru mai multe discuții, consultați chimia organică avansată din martie. Am lucrat la ediția a 5-A, paginile 62-63.
. Nota de subsol 3. Un experiment foarte inteligent a stabilit că ciclobutadiena 1,2-dideutero are doi izomeri, nu unul (vezi mai jos). Acest lucru indică faptul că legăturile duble din ciclobutadienă nu sunt delocalizate așa cum sunt în benzen, ci seamănă mai mult cu legăturile duble într-o dienă convențională.
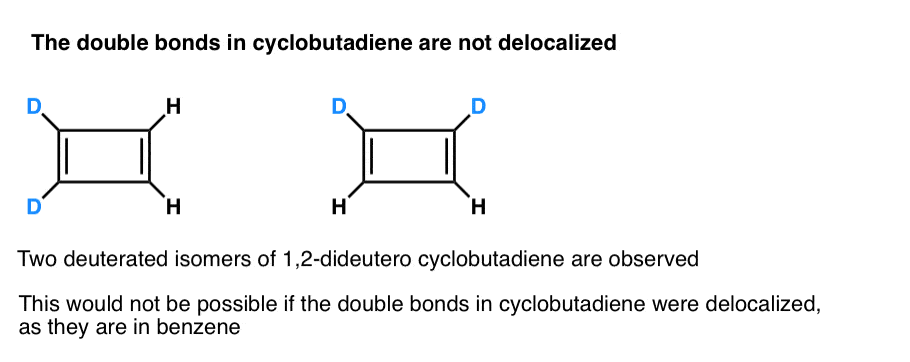
Ciclobutadiena reacționează cu ea însăși la 35 K pentru a forma un „dimer”, într-un exemplu de reacție Diels-arin.
nota de subsol 4. Da, este adevărat că perechea singuratică din azirene poate fi pusă într-un orbital hibrid sp3 (mai jos). Acest lucru reduce probabil „pedeapsa” anti-aromatică oarecum, dar molecula este încă incredibil de instabilă. Anti-aromaticitatea este cel mai simplu mod de a explica acest lucru.

nota de subsol 5. Geometria dreptunghiulară se datorează unui efect cunoscut sub numele de efectul Jahn-Teller. Amintiți-vă principiul excluderii Pauli, unde electronii nu pot avea același număr cuantic? Ei bine, după cum vom vedea când ne uităm la diagrama orbitală moleculară a ciclobutadienei, ciclobutadiena „pătrată” are doi electroni „degenerați”, adică au aceleași energii și numere cuantice. Acest lucru duce la un fenomen cunoscut sub numele de „repulsie Pauli”, unde alungirea legăturilor are loc până când nivelurile de energie ale celor doi electroni sunt diferențiate. Cu siguranță un subiect avansat.
(avansat) referințe și lecturi suplimentare
- spectroscopie de tranziție de Stat de Cyclooctatetraene
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
știință ,1996, 272, 1456-1459.
DOI: 10.1126 / știință.272.5267.1456
acest studiu este baza pentru afirmația că starea de bază non-aromatică a ciclooctatetraenei este cu 12 kcal/mol sub conformația „antiaromatică”. - Îmblânzirea Ciclobutadienei
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/ani.199110241
această lucrare a laureatului Nobel Prof. Donald J. Cram (UCLA) descrie prima caracterizare spectroscopică a ciclobutadienei. Acest lucru se realizează prin închiderea precursorului într-un hemicarcerand (complex de cușcă) și apoi iradierea acestuia cu lumină UV, creând astfel ciclobutadienă, care nu este capabilă să facă nimic, deoarece este prinsă. - Cyclobutadiene
Thomas Bally, Satoru Masamune
tetraedru 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
această lucrare din 1980 comentarii de lucru efectuate pe cyclobutadiene până la acel moment. Aceasta este împărțită în 2 părți – eforturi sintetice experimentale și calcule teoretice. - Tetraedran și Ciclobutadienă
G Inkther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/ani.198803093
această lucrare analizează eforturile sintetice către tetraedran și ciclobutadienă – ambele molecule au o formulă de C4H4. Numai tetraedranele substituite (tetra t-butil și tetra trimetilsilil) au fost sintetizate și izolate cu succes până în prezent. - complexe Tricarbonil Ciclobutadien – și Benzociclobutadien-fier
F. Emerson, L. Watts, și R. Pettit
Jurnalul American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Ciclobutadieneiron Tricarbonil. Un nou sistem Aromatic
D. Fitzpatrick, L. Watts, G. F. Emerson și R. Pettit
Jurnalul Societății Americane de Chimie 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
un subiect bonus: ciclobutadiena poate fi stabilizată cu metale – complexul organometalic ciclobutadien tricarbonilul de fier este un solid cristalin stabil. După cum menționează autorii, este puțin probabil ca ciclobutadiena liberă să fie generată în sinteză. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
olanzapina antipsihotică adoptă o formă de „fluture” pentru a evita efectele antiaromatice, similare ciclooctatetraenei. Acest lucru este aparent critic pentru funcția sa.Ronald Breslow conturi de cercetare chimică 1973, 6 (12), 393-398 DOI: 1021/Ar50072a001 interesant, Prof.Breslow (Columbia) afirmă în acest cont că el a fost persoana care a sugerat mai întâi termenul „antiaromatic” pentru compușii ciclici deosebit de destabilizați cu electroni 4N P. M. J. S. Dewar și alții în care destabilizarea antiaromatică a ciclobutadienei este calculată a fi între 18-33 kcal/mol în raport cu butadiena liniară. - determinarea experimentală a Antiaromaticității Ciclobutadienei
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
știință 1999, 286 (5442), 1119-1122
DOI: 1126/știință.286.5442.1119
aceasta este o lucrare foarte riguroasă care folosește tehnici spectroscopice noi pentru a determina destabilizarea antiaromatică a ciclobutadienei. În raport cu o referință ipotetică de dienă conjugată, fără tulpină, ciclobutadiena este destabilizată cu un total de 87 kcal/mol, dintre care 32 kcal/mol pot fi atribuite tulpinii inelare și 55 kcal/mol antiaromaticității (comparativ cu 21 kcal/mol pentru stabilizarea aromatică a benzenului).Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ‘ Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Jurnalul American Chemical Society 1973, 95 (9), 3017-3018
doi: 10.1021 / ja00790a049
cationul ciclopentadienil poate fi preparat numai cu dificultate, așa cum descrie această lucrare. Odată format, are o stare de bază electronică tripletă (cu 2 electroni nepereche) și poate fi caracterizată prin spectroscopie EPR (rezonanță paramagnetică electronică). - Oxirene
Errol G. Lewars
recenzii chimice 1983, 83 (5), 519-534
DOI: 10.1021 / cr00057a002