tendințe periodice și efecte solvent în nucleofilicitate
există tendințe periodice previzibile în nucleofilicitate. Deplasându-se orizontal pe al doilea rând al tabelului, tendința nucleofilicității este paralelă cu tendința bazicității:
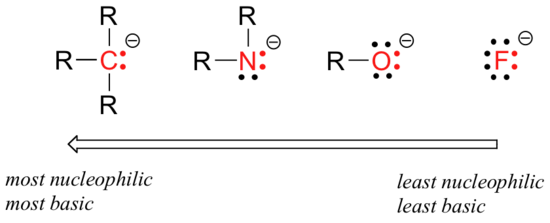
raționamentul din spatele tendinței de nucleofilicitate orizontală este același cu raționamentul din spatele tendinței de bazicitate: mai multe elemente electronegative își țin electronii mai strâns și sunt mai puțin capabili să-i doneze pentru a forma o nouă legătură.
aceste tendințe orizontale ne spun, de asemenea, că aminele sunt mai nucleofile decât alcoolii, deși ambele grupuri acționează în mod obișnuit ca nucleofili atât în reacțiile de laborator, cât și în cele biochimice.
reamintim că bazicitatea atomilor scade pe măsură ce ne deplasăm vertical pe o coloană din tabelul periodic: ionii de tiolat sunt mai puțin bazici decât ionii de alcoxid, de exemplu, iar ionul de bromură este mai puțin bazic decât ionul de clorură, care la rândul său este mai puțin bazic decât ionul de fluor. Reamintim, de asemenea, că această tendință poate fi explicată luând în considerare dimensiunea crescândă a norului de electroni în jurul ionilor mai mari: densitatea electronilor inerentă sarcinii negative este răspândită în jurul unei zone mai mari, ceea ce tinde să crească stabilitatea (și astfel să reducă bazicitatea).
tendința periodică verticală pentru nucleofilicitate este oarecum mai complicată decât cea pentru bazicitate: în funcție de solventul în care are loc reacția, tendința nucleofilicității poate merge în ambele direcții. Să luăm exemplul simplu al reacției SN2 de mai jos:
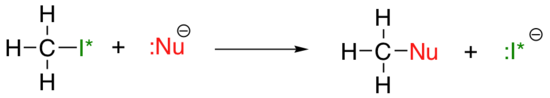
. . .unde Nu – este unul dintre ionii de halogenuri: fluorură, clorură, bromură sau iodură, iar grupul de plecare I* este un izotop radioactiv al iodului (care ne permite să distingem grupul de plecare de nucleofil în cazul în care ambele sunt iodură). Dacă această reacție are loc într – un solvent protic (adică un solvent care are un hidrogen legat de un oxigen sau azot-apa, metanolul și etanolul sunt cele mai importante exemple), atunci reacția va merge mai rapid atunci când iodura este nucleofilul și cel mai lent atunci când fluorura este nucleofilul, reflectând puterea relativă a nucleofilului.

nucleofilicitate relativă într-un solvent protic
aceasta, desigur, este opusă celei a tendinței periodice verticale pentru bazicitate, unde iodura este cea mai puțin bazică. Ce se întâmplă aici? Nu ar trebui ca baza mai puternică, cu electronii săi de valență mai reactivi, să fie și nucleofilul mai puternic? așa cum am menționat mai sus, totul are legătură cu solventul. Amintiți-vă, vorbim acum despre reacția care rulează într-un solvent protic ca etanolul. Moleculele de solvent Protic formează interacțiuni ion-dipol foarte puternice cu nucleofilul încărcat negativ, creând în esență o”cușcă de solvent”în jurul nucleofilului:

pentru ca nucleofilul să atace electrofilul, acesta trebuie să se elibereze, cel puțin parțial, de cușca sa de solvent. Electronii perechii singulare de pe ionul iodură mai mare, mai puțin bazic, interacționează mai puțin strâns cu protonii de pe moleculele de solvent protic – astfel nucleofilul iodurii este mai capabil să se elibereze de cușca sa de solvent în comparație cu ionul fluorură mai mic, mai bazic, ai cărui electroni perechi singuri sunt legați mai strâns de protonii cuștii.
Imaginea se schimbă dacă trecem la un solvent aprotic polar, cum ar fi acetona, în care există un dipol molecular, dar nu există hidrogeni legați de oxigen sau azot. Fluorura este cel mai bun nucleofil, iar iodura cel mai slab.
nucleofilicitate relativă într-un solvent aprotic polar
motivul inversării este că, cu un solvent aprotic, interacțiunile ion-dipol dintre solvent și nucleofilele sunt mult mai slabe: capătul pozitiv al dipolului solventului este ascuns în interiorul moleculei și astfel este protejat de sarcina negativă a nucleofilului.
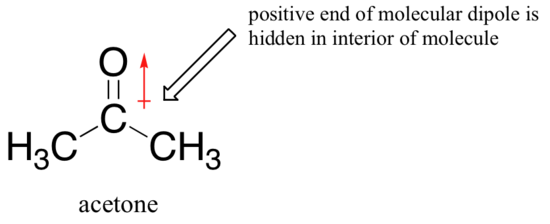
o interacțiune solvent-nucleofil mai slabă înseamnă o cușcă de solvent mai slabă pentru ca nucleofilul să pătrundă, astfel încât efectul solventului este mult mai puțin important, iar ionul de fluor mai bazic este, de asemenea, nucleofilul mai bun.
de ce să nu folosiți un solvent complet nepolar, cum ar fi hexanul, pentru această reacție, astfel încât cușca solventului să fie eliminată complet? Răspunsul la acest lucru este simplu – nucleofilul trebuie să fie în soluție pentru a reacționa la o rată apreciabilă cu electrofilul, iar un solvent precum hexanul nu va rezolva deloc un nucleofil încărcat (sau foarte polar). De aceea, chimiștii folosesc solvenți aprotici polari pentru reacțiile de substituție nucleofilă în laborator: sunt suficient de polari pentru a solvata nucleofilul, dar nu atât de polari încât să-l blocheze într-o cușcă de solvent impenetrabilă. În plus față de acetonă, alți trei solvenți aprotici polari utilizați în mod obișnuit sunt acetonitril, dimetilformamidă (DMF) și dimetil sulfoxid (DMSO).
în chimia biologică, unde solventul este protic (apă), cea mai importantă implicație a tendințelor periodice în nucleofilicitate este că tiolii sunt nucleofili mai puternici decât alcoolii. Grupul tiol dintr-un aminoacid cisteină, de exemplu, este un nucleofil puternic și acționează adesea ca un nucleofil în reacțiile enzimatice și, desigur, tiolații încărcați negativ (RS-) sunt și mai nucleofili. Acest lucru nu înseamnă că grupările hidroxil de pe serină, treonină și tirozină nu acționează și ca nucleofili – o fac.