Obiective
- soluții cunoscute și necunoscute ale ionilor metalici \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\Ce{Co^{2+}}\), \(\ce{Cu ^ {2+}}\) și \(\ce{Hg^{2+}}\) vor fi analizate folosind cromatografia pe hârtie.
- o soluție necunoscută care conține unii dintre acești cationi va fi identificată prin comparație cu valorile Rf și culorile petelor colorate ale soluțiilor cunoscute.
majoritatea chimiștilor și mulți alți oameni de știință trebuie să separe în mod obișnuit amestecurile și să le identifice componentele. Capacitatea de a identifica calitativ substanțele găsite într-o probă poate fi critică. De exemplu, un chimist de mediu care investighează probe de apă subterană poluată va dori să știe ce ioni toxici ar putea fi prezenți într-o probă.
cromatografia este unul dintre primele instrumente utilizate în astfel de situații. În această tehnică, multe tipuri de amestecuri pot fi separate în substanțele pure componente; prin comparație cu un eșantion standard, fiecare substanță componentă poate fi, de asemenea, identificată provizoriu.
există multe varietăți de cromatografie, fiecare concepută pentru a separa anumite tipuri de amestecuri. Caracteristica comună a fiecărui tip de cromatografie este că o fază mobilă (un lichid sau un gaz) este împinsă printr-o fază staționară (un solid). Tabelul 1 enumeră mai multe varietăți de cromatografie și identități tipice ale fazelor. Cromatografia pe hârtie va fi utilizată în acest experiment.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
exemplul cromatografiei pe coloane (Figura 1) demonstrează caracteristicile tipice găsite în această tehnică analitică. Diagrama arată un experiment în care un amestec bicomponent este supus cromatografiei coloanei. Coloana este ambalată cu un material solid numit faza staționară. Un solvent lichid sau o soluție de eluare este turnat în coloană și umezește complet materialul de ambalare solid. Apoi amestecul este încărcat pe partea superioară a coloanei umede și se adaugă mai mult eluent. Gravitația trage faza mobilă în jos prin faza staționară și componentele din amestec încep să se deplaseze prin coloană la viteze diferite. În diagramă, componenta a se mișcă mai repede decât componenta B; astfel, componenta B este reținută pe coloană pentru o perioadă mai lungă de timp decât componenta A. De obicei, aceasta se datorează unei diferențe de solubilitate a celor doi compuși din solvent și/sau unei diferențe de atracție față de materialul solid de ambalare. Pe măsură ce se adaugă mai mult eluent în partea de sus a coloanei, componentele vor ieși în cele din urmă din coloană separat. Timpul necesar pentru ieșirea din coloană, numit timp de retenție, va fi reproductibil pentru fiecare componentă în condițiile stabilite date—identități de fază mobilă și staționară, temperatură și lățimea coloanei. Odată ce componentele ies din coloană, solventul poate fi îndepărtat prin evaporare și componentele pure pot fi analizate sau identificate în continuare.
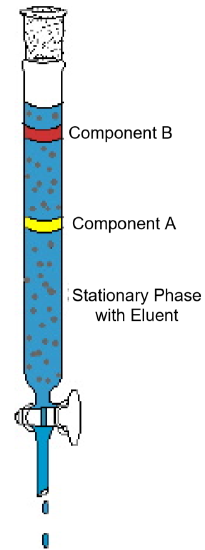
Figura 1: un experiment tipic de cromatografie pe coloană demonstrează separarea unui amestec bicomponent.
identificarea provizorie a componentelor poate fi realizată prin compararea amestecului necunoscut un amestec cunoscut preparat cu atenție: dacă o componentă cunoscută are același timp de retenție ca o componentă necunoscută în aceleași condiții, este probabil—dar nu concludent—că cele două componente sunt aceleași. Poate fi necesară o analiză suplimentară pentru a confirma această ipoteză. Dacă cunoscutul și necunoscutul au timpi de retenție diferiți, atunci nu este probabil ca cele două componente să fie identice.
alte variații ale cromatografiei folosesc acțiunea capilară—atracția unui lichid pe o suprafață solidă—pentru a trage un solvent prin material solid. O versiune informală a cromatografiei pe hârtie poate fi observată atunci când o pagină scrisă cu cerneală vine în contact cu apa sau alte lichide. Cerneala rulează și mai multe culori sunt separate în banda de cerneală.
diagrama de mai jos (Figura 2) arată rezultatul unui experiment de cromatografie în strat subțire. Două pete de cerneală neagră pe suprafața solidă au avut un solvent trecut prin ele. Solventul este apă sau alt lichid care este tras prin faza staționară prin acțiune capilară. În acest exemplu, o bucată de plastic acoperită cu un solid sub formă de pulbere este utilizată ca fază staționară. Alternativ, o bucată de hârtie de filtru poate fi utilizată ca fază staționară. Experimentul arată că cerneala neagră este un amestec care conține mai multe substanțe colorate diferite. Fiecare componentă are o solubilitate ușor diferită în faza mobilă, astfel încât atunci când lichidul este tras prin faza staționară, fiecare componentă se mișcă cu o viteză diferită, separând cerneala în pete de diferite culori.

Figura 2: cromatografia în strat subțire a cernelii negre după dezvoltare. Această imagine demonstrează o problemă comună în care petele se lărgesc pe măsură ce se deplasează în sus pe placă, fuzionând în cele din urmă în partea de sus a plăcii.
în acest experiment, principii similare sunt utilizate pentru a separa mai mulți cationi metalici printr-o procedură de cromatografie pe hârtie. Ionii metalici – \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\),\(\Ce{Co^{2+}}\), \(\ce{cu ^ {2+}}\) și \(\ce{Hg^{2+}}\)—au solubilitate diferită în faza mobilă—apoasă \(\ce{HCl}\) cu alcool etilic și butilic—și se va deplasa la viteze diferite în sus pe hârtie. Diferitele solubilități ale ionilor metalici se datorează probabil formării diferiților compuși cu ionul clorurat și capacității lor variate de a se dizolva în solventul organic.
o diagramă care arată modul de pregătire a hârtiei este prezentată mai jos. Soluțiile Standard care conțin fiecare dintre acești ioni vor fi observate pe hârtie folosind un tub capilar, împreună cu o soluție standard care conține toți cei cinci ioni. Un necunoscut va fi, de asemenea, reperat pe hârtie. Odată ce hârtia este pregătită, aceasta va fi dezvoltată prin plasarea hârtiei în eluent. După 75-90 de minute, hârtia este vizualizată umezind-o cu o soluție apoasă care conține iodură de potasiu, \(\ce{KI}\) și ferocianură de potasiu, \(\ce{K4}\). Culoarea unică observată pentru fiecare ion este produsă printr-o reacție chimică cu soluția de vizualizare. Aceasta este o modalitate utilă de a identifica ce ioni sunt prezenți într-un amestec necunoscut.
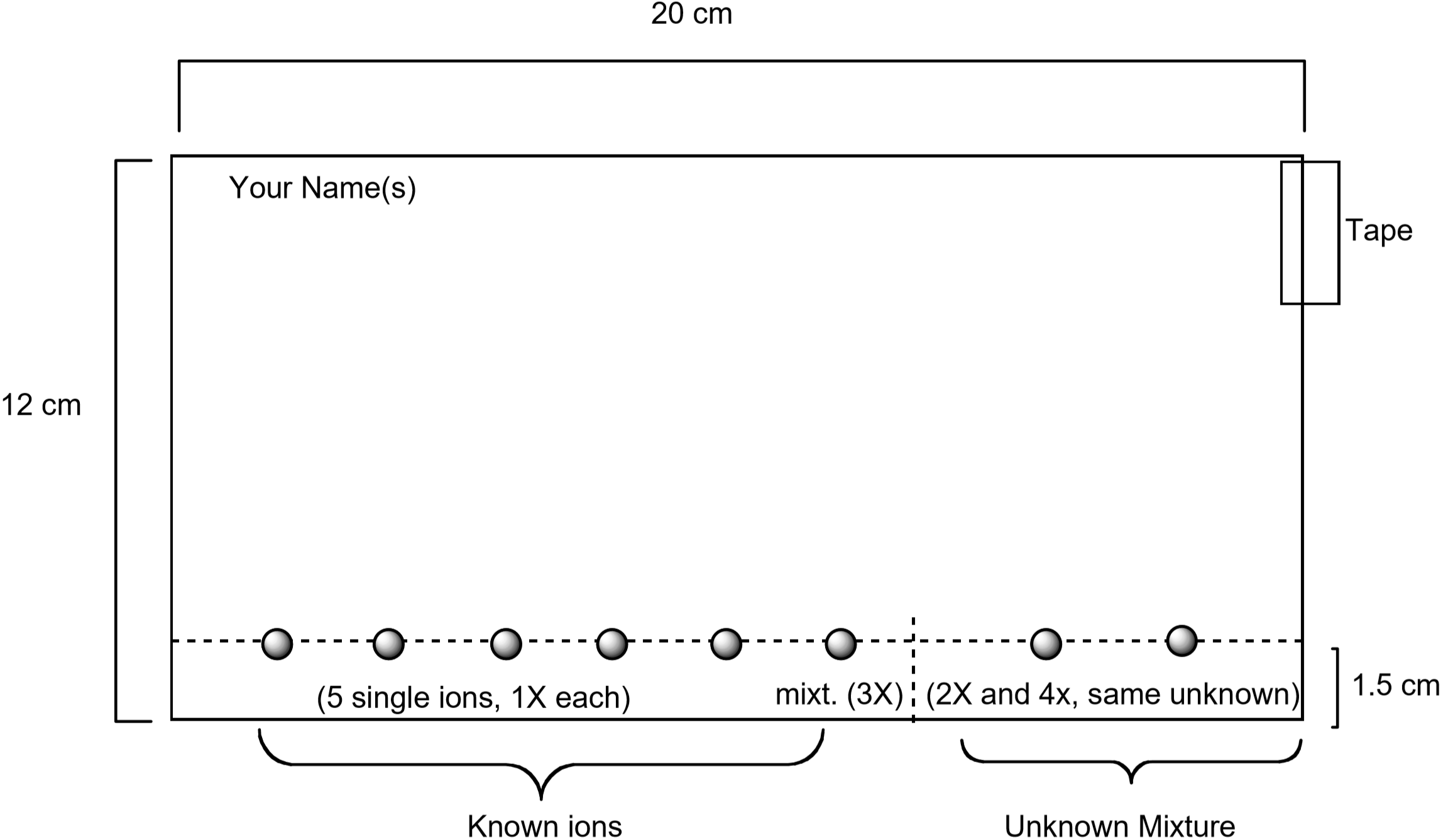
Figura 3: diagrama care arată modul de pregătire a hârtiei pentru experimentul de cromatografie
distanța pe care ionul o deplasează în sus poate fi utilizată și pentru identificarea ionului. Cu toate acestea, deoarece elevii își vor dezvolta experimentele de cromatografie pentru diferite perioade de timp și în condiții ușor diferite, fiecare elev va avea o distanță măsurată oarecum diferită pentru un ion dat. Raportul dintre distanța deplasată de un ion (\(D\)) și distanța deplasată de solvent (\(F\), Frontul solventului) este caracteristic și ar trebui să fie aproape același pentru toți elevii. Acest raport se numește Rf sau ” factor de retenție.”
\
procedura
materiale și echipamente
produse chimice: 0.1 m soluții apoase de \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\Ce{Fe(NO3)3}\), \(\Ce{Co(NO3)2}\) și \(\ce{Cu(NO3)2}\), fiecare cu tuburi capilare dedicate; soluție de eluare (apoasă \(\ce{HCl}\) cu alcool etilic și butilic); soluție de vizualizare (soluție apoasă de \(\ce{KI}\) și \(\ce{K4}\)).
echipament: bucată curată de hârtie cromatografică; mănuși de Latex de unică folosință (mănușile de nitril sunt disponibile în magazie pentru persoanele cu alergii la Latex); pahar de 600 mL; folie de plastic; forceps sau clești de pahar; riglă*
* articole obținute din magazie
siguranță
evitați contactul cu soluțiile de ioni metalici, solventul de eluare și soluția de vizualizare. Purtați mănuși de unică folosință pentru a vă atinge cromatograma după eluție și pentru restul experimentului. Nu respirați vaporii solventului de eluare sau ai soluției de vizualizare. Așezați cromatograma umedă pe un prosop de hârtie, nu direct pe banca de laborator. Utilizați soluția de vizualizare numai în spațiul oferit de instructorul dvs. Aruncați mănușile și cromatograma în recipientul de deșeuri specificat după terminarea experimentului. Spălați-vă bine mâinile după contactul cu toate soluțiile din acest laborator.
pregătirea hârtiei pentru cromatografie
- fiecare pereche de elevi trebuie să obțină o bucată de hârtie de filtru cu dimensiunile prezentate în Figura 3. Asigurați-vă că hârtia este curată și fără lacrimi sau pliuri. Folosiți un creion—nu un stilou-și o riglă pentru a trasa o linie peste hârtie la un cm de marginea lungă a hârtiei. Veți observa soluțiile de ioni metalici pe această linie. Scrieți-vă numele în creion în colțul din stânga sus al hârtiei.
- practicați identificarea soluțiilor de apă și / sau ioni pe o bandă de hârtie de filtru, astfel încât să știți cum să creați pete de dimensiunea corectă. Folosiți tuburi capilare de sticlă pentru a observa ionii pe hârtie. Soluția se aplică prin atingerea ușoară și rapidă a unui tub capilar care conține soluția pe linia pe care ați desenat-o pe hârtie. Petele trebuie să aibă un diametru cuprins între 5-8 mm. Petele mai mari decât acestea se vor răspândi excesiv în timpul experimentului și vor face dificilă analiza.
- cunoscut 0.1 m soluții apoase de \(\ce{AgNO3}\), \(\ce{Hg(NO3) 2}\), \(\Ce{Fe(NO3) 3}\), \(\Ce{Co(NO3) 2}\) și \(\ce{Cu(NO3) 2}\) sunt furnizate în eprubete, fiecare conținând două sau trei eprubete capilare. Începând din stânga, marcați identitatea ionului de sub fiecare punct cu un creion; apoi observați cu atenție fiecare ion cunoscut pe linie. Aveți grijă să evitați contaminarea tubului capilar cu alți ioni și înlocuiți tuburile capilare înapoi în eprubeta corectă. Un tub de testare care conține un amestec cunoscut de toți cei cinci ioni este, de asemenea, prevăzut cu un set de tuburi capilare. Spot acest amestec pe linie, de asemenea. Deoarece această soluție este mai diluată decât soluțiile cunoscute cu un singur ion, aplicați amestecul cunoscut de trei ori, lăsând pata să se usuce între fiecare aplicare. O lampă de căldură va ajuta la uscarea mai rapidă a locului.
- mai multe necunoscute sunt, de asemenea, furnizate în eprubete, împreună cu tuburi capilare. Instructorul dvs. vă va spune ce necunoscut trebuie utilizat. Necunoscutele vor conține între unul și patru cationi și sunt mai diluate decât soluțiile cunoscute cu un singur ion. Necunoscutul va trebui, de asemenea, aplicat de două și patru ori pentru cele două studii, lăsând locul să se usuce între fiecare aplicație. În caz de eroare, ar trebui să observați necunoscutul în două locuri de-a lungul liniei, astfel încât două studii să fie disponibile pentru analiză.
dezvoltarea hârtiei cromatografice
- așezați o bucată de bandă de-a lungul marginii din dreapta sus, așa cum se arată în Figura 3. Apoi formați un cilindru conectând cele două margini scurte ale hârtiei cu banda. Asigurați-vă că marginile nu se ating. Hârtia ar trebui să arate similar cu figura 4.
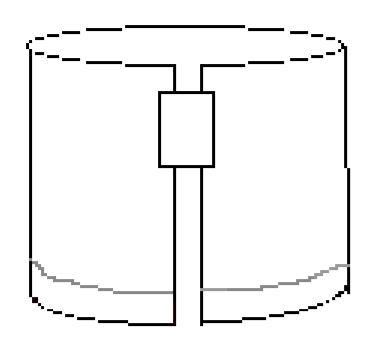
Figura 4: hârtia pliată ar trebui să arate astfel înainte de dezvoltarea experimentului.
- se obțin 15 mL soluție de eluare. Turnați cu grijă o parte din acest solvent într-un pahar de 600 mL și rotiți cu grijă o secundă sau două. Atenție: nu respirați vaporii din această soluție! Asigurați-vă că nivelul lichidului va fi sub linia spot de pe hârtie odată ce hârtia este plasată în camera de dezvoltare.
- așezați cilindrul de hârtie în pahar cu marginea marcată în jos. Petele trebuie să fie deasupra nivelului solventului. Hârtia nu trebuie să atingă părțile laterale ale paharului. Acoperiți cu grijă paharul cu folie de plastic și puneți-l în capotă timp de 75-90 de minute. Solventul ar trebui să înceapă să se deplaseze în sus pe hârtie. Odată ce paharul este acoperit, asigurați-vă că este nivelat și nu îl deranjați în timpul perioadei de dezvoltare. Instructorul dvs. poate avea o sarcină la care să lucrați în timp ce așteptați.
vizualizarea și analiza hârtiei
- după terminarea perioadei de dezvoltare, purtați mănuși de unică folosință și scoateți hârtia din pahar. Mănușile din Latex sunt disponibile în laborator, iar mănușile din nitril sunt disponibile în magazie pentru persoanele cu alergii la Latex. Lăsați orice solvent să picure înapoi în pahar, apoi scoateți banda. Așezați hârtia de cromatografie pe un prosop de hârtie și marcați imediat fața solventului cu un creion. Se toarnă solventul de eluare utilizat în recipientul pentru deșeuri furnizat. Uscați hârtia sub o lampă de căldură din capotă. Atenție: Nu respirați vaporii! Aveți grijă să nu ardeți hârtia sub lampă.
- odată ce hârtia este uscată, aduceți-o la stația de vizualizare de pe prosopul de hârtie. Scufundați scurt hârtia în soluția de vizualizare situată într-un vas superficial din hota de fum. Ridicați imediat hârtia din soluție și lăsați orice exces să se scurgă la stație. Așezați hârtia umedă pe un prosop de hârtie uscat și uscați-o imediat sub o lampă de căldură, apoi duceți-o la bancă pentru analiză.
- găsiți mai întâi fiecare singur ion cunoscut și înregistrați culorile pe care le observați. Unele pete se pot estompa în timp, deci înregistrați culorile în timp ce hârtia este încă umedă. Măsurați distanța fiecare loc mutat, D, cu o riglă. Măsurați în centrul fiecărui loc. Înregistrați datele în tabelul de date.
- măsurați distanța până la fața solventului, F. valoarea lui F trebuie să fie aproximativ aceeași pe întreaga hârtie. Utilizați aceste valori pentru a calcula Rf pentru fiecare ion. Efectuați măsurătorile așa cum se arată în Figura 5. Fiecare punct observat are propria sa valoare Rf. Înregistrați rezultatele în tabelul de date.
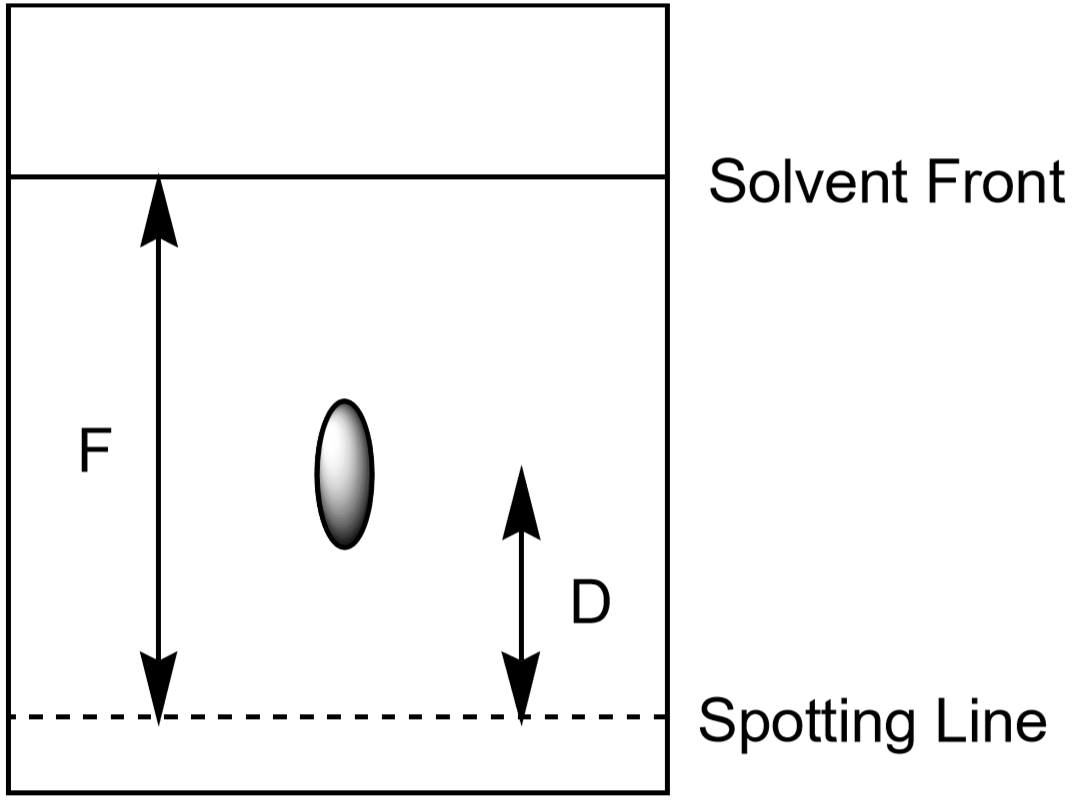
Figura 5: Măsurarea distanțelor utilizate în calculul Rf pentru un loc.
- în banda care conține amestecul, găsiți fiecare ion și înregistrați distanța parcursă de fiecare ion. Calculați Rf pentru fiecare ion din această bandă. Valorile trebuie să se potrivească îndeaproape cu cele observate în cunoștințele cu un singur ion.
- în banda care conține necunoscutele, localizați centrul fiecărui punct observat și înregistrați distanța acestuia și calculați valorile Rf. Folosiți banda care are cele mai clare pete. Valorile de culoare și Rf pentru petele necunoscute ar trebui să se potrivească îndeaproape cu unii dintre ionii cunoscuți. Acum ar trebui să puteți identifica ce ion sau ioni se găsesc în necunoscutul dvs. Înregistrați-vă datele în tabelul corespunzător.
- faceți o schiță a cromatogramei dvs. în spațiul furnizat pe formularul de raport de laborator, fiind sigur că indicați poziția și dimensiunea și forma aproximativă a fiecărui punct de pe hârtie. Aruncați hârtia în recipientul de deșeuri desemnat.
curățare
așezați hârtia cromatografică și mănușile folosite în recipientul pentru deșeuri furnizat. Soluția de eluare utilizată ar fi trebuit deja plasată într-un alt recipient pentru deșeuri. Rețineți că două containere diferite pentru deșeuri sunt furnizate pentru acest experiment, așa că asigurați-vă că citiți etichetele, astfel încât să o utilizați pe cea corectă! Asigurați-vă că vă spălați bine mâinile înainte de a părăsi laboratorul.
atribuire Pre-laborator: cromatografie pe hârtie
- un amestec bicomponent este analizat prin cromatografie pe hârtie. Componenta a este mai solubilă în faza mobilă decât componenta B. Se obține următorul rezultat. Calculați Rf pentru fiecare componentă și etichetați identitatea fiecărui spot.
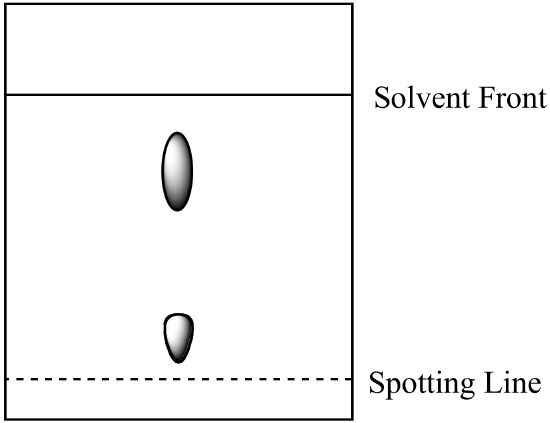
- amestecul de la întrebarea 1 (de mai sus) este analizat prin cromatografie pe coloană folosind aceeași fază mobilă și o fază staționară cu silicagel. Ce componentă are timpul de retenție mai scurt? Explică-ți răspunsul. (Să presupunem că același tip de forțe de legare între componente și faza staționară sunt prezente atât în cromatografia hârtiei, cât și în cromatografia coloanei.)
- o probă lichidă necunoscută este analizată utilizând cromatografia pe hârtie utilizând solventul X ca fază mobilă. Un punct este observat după ce placa este dezvoltată și vizualizată. Aceeași substanță necunoscută este reanalizată folosind solventul Y ca fază mobilă. De data aceasta, se observă trei pete după ce placa este dezvoltată și vizualizată.
- eșantionul necunoscut este o substanță pură sau un amestec? Explicați-vă răspunsul, inclusiv un posibil motiv pentru diferitele observații din cele două experimente.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| cod ID necunoscut | ioni identificați |
|---|---|
întrebări și concluzii
- ce criterii au fost folosite pentru a identifica ionii găsiți în necunoscutul tău? Explicați-vă răspunsul în cel puțin trei propoziții. Includeți orice dificultăți în identificarea oricăror ioni.
- dacă lăsați experimentul să ruleze doar 30 de minute, care ar fi rezultatul probabil? Ar apărea probleme în identificarea necunoscutului?
- Dacă \(\ce{Co^{2+}}\) și \(\ce{cu^{2+}}\) petele ar avea aceeași culoare, identificarea unui necunoscut ar fi mai dificilă? Explică-ți răspunsul.