Video \(\PageIndex{1}\): o scurtă introducere în geniul lui Mendeleev.
pe măsură ce chimiștii timpurii au lucrat la purificarea minereurilor și au descoperit mai multe elemente, și-au dat seama că diferite elemente ar putea fi grupate împreună prin comportamentele lor chimice similare. O astfel de grupare include litiu (Li), sodiu (Na) și potasiu (K): Toate aceste elemente sunt strălucitoare, conduc bine căldura și electricitatea și au proprietăți chimice similare. O a doua grupare include calciu (Ca), stronțiu (Sr) și bariu (Ba), care sunt, de asemenea, strălucitori, buni conductori de căldură și electricitate și au proprietăți chimice în comun. Cu toate acestea, proprietățile specifice ale acestor două grupări sunt deosebit de diferite unele de altele. De exemplu: Li, Na și K sunt mult mai reactive decât Ca, Sr și Ba; Li, Na și K formează compuși cu oxigen într-un raport de doi dintre atomii lor la un atom de oxigen, în timp ce Ca, Sr și Ba formează compuși cu unul dintre atomii lor la un atom de oxigen. Fluorul (F), clorul (Cl), bromul (Br) și iodul (I) prezintă, de asemenea, proprietăți similare între ele, dar aceste proprietăți sunt drastic diferite de cele ale oricăruia dintre elementele de mai sus.
Dimitri Mendeleev în Rusia (1869) și Lothar Meyer în Germania (1870) au recunoscut independent că există o relație periodică între proprietățile elementelor cunoscute la acea vreme. Ambele tabele publicate cu elementele aranjate în funcție de creșterea masei atomice. Dar Mendeleev a mers cu un pas mai departe decât Meyer: și-a folosit masa pentru a prezice existența unor elemente care ar avea proprietăți similare cu aluminiul și siliciul, dar care erau încă necunoscute. Descoperirile de galiu (1875) și germaniu (1886) au oferit un mare sprijin pentru opera lui Mendeleev. Deși Mendeleev și Meyer au avut o lungă dispută asupra priorității, contribuțiile lui Mendeleev la dezvoltarea tabelului periodic sunt acum recunoscute pe scară mai largă (figura \(\PageIndex{1}\)).
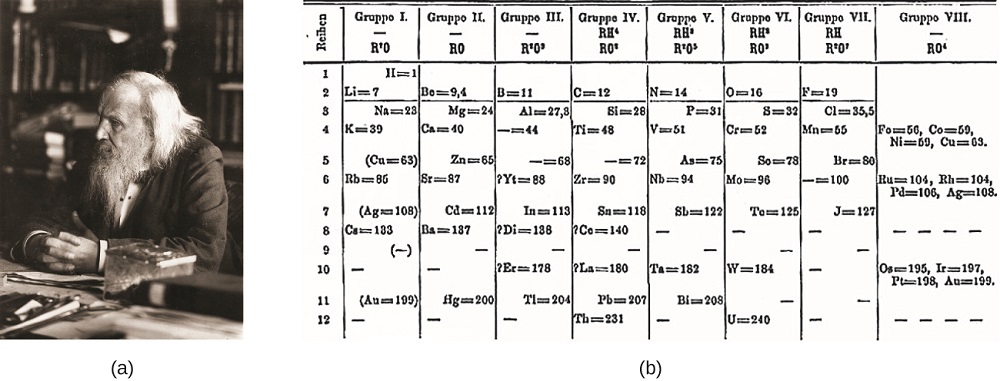
figura \(\PageIndex{1}\): (a) Dimitri Mendeleev este larg creditat cu crearea (b) primul tabel periodic al elementelor. (credit a: modificarea lucrării de către Serge Lachinov; credit b: modificarea lucrării de către „Den FJ inkttrade ankan”/Wikimedia Commons)
Video \(\PageIndex{2}\): O introducere în organizarea tabelului periodic în perioade și grupuri. Această organizație va fi importantă pe măsură ce continuăm să construim pe principiile chimiei.
până în secolul al XX-lea, a devenit evident că relația periodică implica numere atomice mai degrabă decât mase atomice. Declarația modernă a acestei relații, legea periodică, este după cum urmează: proprietățile elementelor sunt funcții periodice ale numerelor lor atomice. Un tabel periodic modern aranjează elementele în ordinea crescătoare a numărului lor atomic și grupează atomi cu proprietăți similare în aceeași coloană verticală (figura \(\PageIndex{2}\)). Fiecare cutie reprezintă un element și conține numărul său atomic, simbolul, masa atomică medie și (uneori) numele. Elementele sunt dispuse în șapte rânduri orizontale, numite perioade sau serii, și 18 coloane verticale, numite grupuri. Grupurile sunt etichetate în partea de sus a fiecărei coloane. În Statele Unite, etichetele erau în mod tradițional cifre cu majuscule. Cu toate acestea, IUPAC recomandă utilizarea numerelor de la 1 la 18, iar aceste etichete sunt mai frecvente. Pentru ca tabelul să se potrivească pe o singură pagină, părți din două rânduri, în total 14 coloane, sunt de obicei scrise sub corpul principal al tabelului.

figura \(\PageIndex{2}\): Elementele din tabelul periodic sunt organizate în funcție de proprietățile lor.
multe elemente diferă dramatic în proprietățile lor chimice și fizice, dar unele elemente sunt similare în comportamentele lor. De exemplu, multe elemente par strălucitoare, sunt maleabile (capabile să fie deformate fără rupere) și ductile (pot fi trase în fire) și conduc bine căldura și electricitatea. Alte elemente nu sunt strălucitoare, maleabile sau ductile și sunt conductori slabi de căldură și electricitate. Putem sorta elementele în clase mari cu proprietăți comune: metale (elemente strălucitoare, maleabile, conductori buni de căldură și electricitate—galben umbrit); nemetale( elemente care par plictisitoare, conductori slabi de căldură și electricitate—verde umbrit); și metaloizi (elemente care conduc căldura și electricitatea moderat bine și posedă unele proprietăți ale metalelor și unele proprietăți ale nemetalelor—violet umbrit).
elementele pot fi, de asemenea, clasificate în elementele grupului principal (sau elemente reprezentative) din coloanele etichetate 1, 2 și 13-18; metalele de tranziție din coloanele etichetate 3-12; și metalele de tranziție interioare din cele două rânduri din partea de jos a tabelului (elementele din rândul de sus se numesc lantanide, iar elementele din rândul de jos sunt actinide; figura \(\PageIndex{3}\)). Elementele pot fi subdivizate în continuare prin proprietăți mai specifice, cum ar fi compoziția compușilor pe care îi formează. De exemplu, elementele din grupa 1 (prima coloană) formează compuși care constau dintr-un atom al elementului și un atom de hidrogen. Aceste elemente (cu excepția hidrogenului) sunt cunoscute sub numele de metale alcaline și toate au proprietăți chimice similare. Elementele din grupa 2 (a doua coloană) formează compuși constând dintr-un atom al elementului și doi atomi de hidrogen: aceștia se numesc metale alcalino-pământoase, cu proprietăți similare între membrii acelui grup. Alte grupuri cu nume specifice sunt pnictogeni (grupa 15), calcogeni (grupa 16), halogeni (grupa 17) și gaze nobile (grupa 18, cunoscută și sub numele de gaze inerte). Grupurile pot fi menționate și de primul element al grupului: de exemplu, calcogenii pot fi numiți grupul de oxigen sau familia de oxigen. Hidrogenul este un element nemetalic unic, cu proprietăți similare atât elementelor din grupa 1, cât și celor din grupa 17. Din acest motiv, hidrogenul poate fi afișat în partea de sus a ambelor grupuri sau de la sine.
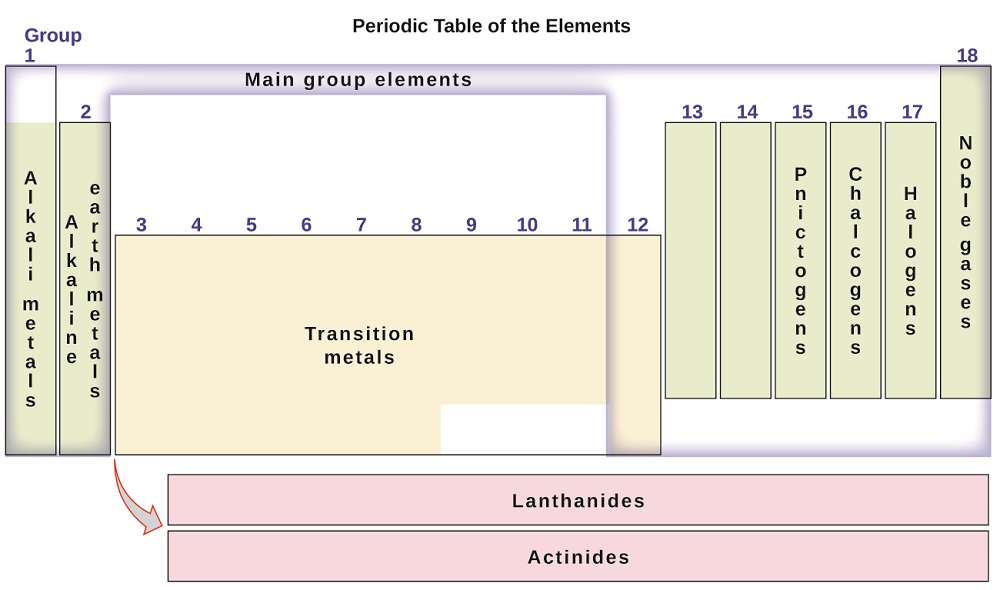
figura \(\PageIndex{3}\): tabelul periodic organizează elemente cu proprietăți similare în grupuri.
Example \(\PageIndex{1}\): Denumirea grupurilor de elemente
atomii fiecăruia dintre următoarele elemente sunt esențiali pentru viață. Dați numele grupului pentru următoarele elemente:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- kripton
- seleniu
- bariu
- litiu
răspuns a
gaz nobil
răspuns b
calcogen
răspuns c
metal alcalino-pământos
răspuns D
metal alcalin
în studierea tabelului periodic, este posibil să fi observat ceva despre masele atomice ale unor elemente. Elementul 43 (technețiu), elementul 61 (prometiu) și majoritatea elementelor cu număr atomic 84 (poloniu) și mai mare au masa atomică dată între paranteze pătrate. Acest lucru se face pentru elemente care constau în întregime din izotopi radioactivi instabili (veți afla mai multe despre radioactivitate în capitolul Chimie nucleară). O greutate atomică medie nu poate fi determinată pentru aceste elemente, deoarece radioizotopii lor pot varia semnificativ în abundență relativă, în funcție de sursă sau pot să nu existe nici măcar în natură. Numărul din paranteze pătrate este numărul de masă atomică (și masa atomică aproximativă) a celui mai stabil izotop al acelui element.
rezumat
Video \(\PageIndex{3}\): Un rezumat al descoperirii și proprietăților tabelului periodic.
descoperirea recurenței periodice a proprietăților similare între elemente a dus la formularea tabelului periodic, în care elementele sunt aranjate în ordinea creșterii numărului atomic în rânduri cunoscute sub numele de perioade și coloane cunoscute sub numele de grupuri. Elementele din același grup al tabelului periodic au proprietăți chimice similare. Elementele pot fi clasificate ca metale, metaloizi și nemetale sau ca elemente de grup principal, metale de tranziție și metale de tranziție interioare. Grupurile sunt numerotate 1-18 de la stânga la dreapta. Elementele din grupa 1 sunt cunoscute sub numele de metale alcaline; cei din grupa 2 sunt metale alcalino-pământoase; cei din 15 sunt pnictogeni; cei din 16 sunt calcogeni; cei din 17 sunt halogeni; iar cei din 18 sunt gazele nobile.