obiective de învățare
până la sfârșitul acestei secțiuni, veți putea:
- să explicați relațiile dintre cantitățile microscopice și macroscopice dintr-un gaz
- să rezolvați problemele care implică amestecuri de gaze
- să rezolvați problemele care implică distanța și timpul dintre coliziunile unei molecule de gaz
am examinat presiunea și temperatura pe baza definițiilor lor macroscopice. Presiunea este forța împărțită la zona pe care se exercită forța, iar temperatura este măsurată cu un termometru. Putem obține o mai bună înțelegere a presiunii și temperaturii din teoria cinetică a gazelor, teoria care leagă proprietățile macroscopice ale gazelor de mișcarea moleculelor din care constau. În primul rând, facem două presupuneri despre molecule într-un gaz ideal.
- există un număr foarte mare n de molecule, toate identice și fiecare având masa m.
- moleculele se supun legilor lui Newton și sunt în mișcare continuă, care este aleatorie și izotropă, adică aceeași în toate direcțiile.
pentru a obține legea gazului ideal și legătura dintre cantitățile microscopice, cum ar fi energia unei molecule tipice și cantitățile macroscopice, cum ar fi temperatura, analizăm un eșantion de gaz ideal într-un recipient rigid, despre care facem două ipoteze suplimentare:
- moleculele sunt mult mai mici decât distanța medie dintre ele, deci volumul lor total este mult mai mic decât cel al containerului lor (care are volumul V). Cu alte cuvinte, luăm Constanta Van der Waals b, volumul unui mol de molecule de gaz, pentru a fi neglijabil în comparație cu volumul unui mol de gaz din recipient.
- moleculele fac coliziuni perfect elastice cu pereții recipientului și unul cu celălalt. Alte forțe asupra lor, inclusiv gravitația și atracțiile reprezentate de Constanta Van der Waals a, sunt neglijabile (așa cum este necesar pentru asumarea izotropiei).
coliziunile dintre molecule nu apar în derivarea legii gazului ideal. Nici ele nu deranjează derivarea, deoarece coliziunile dintre moleculele care se mișcă cu viteze aleatorii dau noi viteze aleatorii. Mai mult, dacă vitezele moleculelor de gaz dintr-un recipient nu sunt inițial aleatorii și izotrope, coliziunile moleculare sunt cele care le fac aleatorii și izotrope.
facem și alte ipoteze care simplifică calculele, dar nu afectează rezultatul. În primul rând, lăsăm recipientul să fie o cutie dreptunghiulară. În al doilea rând, începem prin a lua în considerare gazele monatomice, cele ale căror molecule constau din atomi unici, cum ar fi heliul. Apoi, putem presupune că atomii nu au energie decât energia lor cinetică translațională; de exemplu, nu au nici energie rotativă, nici vibrațională. (Mai târziu, discutăm validitatea acestei presupuneri pentru gazele monatomice reale și renunțăm la aceasta pentru a lua în considerare gazele diatomice și poliatomice.)
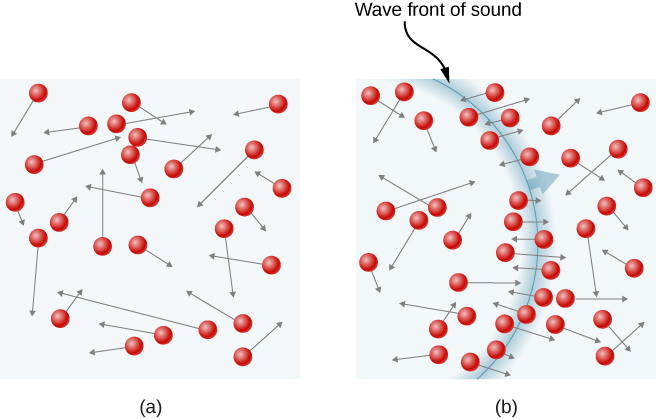
figura \(\PageIndex{1}\) arată o coliziune a unei molecule de gaz cu peretele unui container, astfel încât să exercite o forță pe perete (prin a treia lege a lui Newton). Aceste coliziuni sunt sursa de presiune într-un gaz. Pe măsură ce numărul de molecule crește, crește numărul de coliziuni și, astfel, presiunea. În mod similar, dacă viteza medie a moleculelor este mai mare, presiunea gazului este mai mare.
într-o probă de gaz dintr-un recipient, aleatoritatea mișcării moleculare determină fluctuația numărului de coliziuni ale moleculelor cu orice parte a peretelui într-un timp dat. Cu toate acestea, deoarece un număr mare de molecule se ciocnesc cu peretele într-un timp scurt, numărul de coliziuni pe scalele de timp și spațiu pe care le măsurăm fluctuează doar cu o fracțiune mică, de obicei neobservabilă din medie. Putem compara această situație cu cea a unui cazinou, unde rezultatele pariurilor sunt aleatorii, iar încasările cazinoului fluctuează în funcție de minut și oră. Cu toate acestea, de-a lungul unor perioade lungi, cum ar fi un an, încasările cazinoului sunt foarte apropiate de mediile așteptate din Cote. Un rezervor de gaz are enorm mai multe molecule decât un cazinou are pariorii într-un an, iar moleculele fac enorm mai multe coliziuni într-o secundă decât un cazinou are pariuri.un calcul al forței medii exercitate de molecule pe pereții cutiei ne conduce la Legea gazului ideal și la legătura dintre temperatură și energia cinetică moleculară. (De fapt, vom lua două medii: una în timp pentru a obține forța medie exercitată de o moleculă cu o viteză dată și apoi o altă medie asupra moleculelor cu viteze diferite.) Această abordare a fost dezvoltată de Daniel Bernoulli (1700-1782), care este cel mai bine cunoscut în fizică pentru munca sa asupra fluxului de fluide (hidrodinamică). În mod remarcabil, Bernoulli a făcut această lucrare înainte ca Dalton să stabilească punctul de vedere al materiei ca fiind format din atomi.
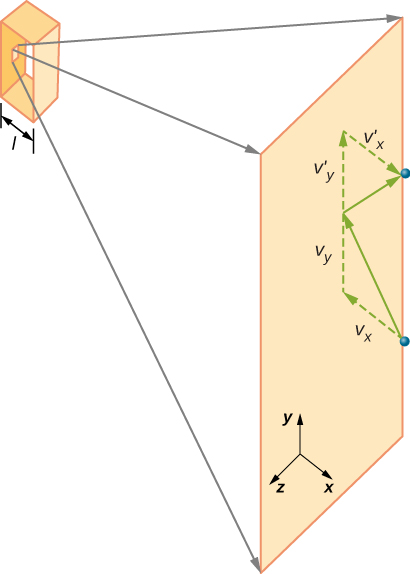
figura \(\PageIndex{2}\) prezintă un recipient plin de gaz și o vedere extinsă a unei coliziuni elastice a unei molecule de gaz cu un perete al recipientului, împărțit în componente. Am presupus că o moleculă este mică în comparație cu separarea moleculelor din gaz și că interacțiunea sa cu alte molecule poate fi ignorată. În aceste condiții, legea gazului ideal este valabilă experimental. Deoarece am presupus, de asemenea, că peretele este rigid și particulele sunt puncte, coliziunea este elastică (prin conservarea energiei—nu există unde să meargă energia cinetică a unei particule). Prin urmare, energia cinetică a moleculei rămâne constantă și, prin urmare, viteza și magnitudinea impulsului său rămân constante. Această presupunere nu este întotdeauna valabilă, dar rezultatele din restul acestui modul sunt obținute și în modele care permit moleculelor să facă schimb de energie și impuls cu peretele.
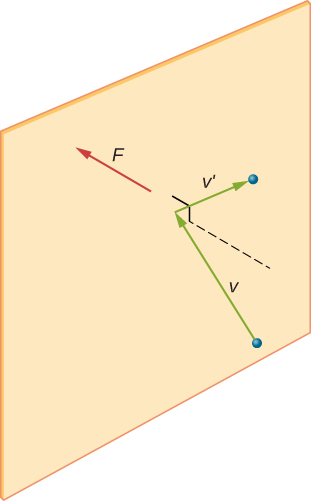
dacă viteza moleculei se schimbă în direcția x, impulsul său se schimbă de la \(- m_x\) la \(+mv_x\). Astfel, schimbarea sa în impuls este \(\Delta mv = + mv_x – (- mv_x) = 2mv_x\). Conform teoremei impuls-impuls dată în capitolul despre impulsul liniar și coliziuni, forța exercitată asupra moleculei i, unde eu etichetează moleculele de la 1 la N, este dată de \
(numai în această ecuație, p reprezintă impulsul, nu presiunea.) Nu există nicio forță între perete și moleculă, cu excepția cazului în care molecula atinge peretele. În timpul scurt al coliziunii, forța dintre moleculă și perete este relativ mare, dar aceasta nu este forța pe care o căutăm. Căutăm forța medie, așa că luăm \(\Delta t\) pentru a fi timpul mediu dintre coliziunile moleculei date cu acest perete, care este timpul în care ne așteptăm să găsim o coliziune. Fie l să reprezinte lungimea cutiei în direcția X. Apoi \(\Delta t\) este timpul pe care molecula L-ar lua pentru a merge peste cutie și înapoi, la o distanță 2L, la o viteză de \(v_x\). Astfel \(\delta t = 2L/v_x\), iar expresia forței devine
\
această forță se datorează unei molecule. Pentru a găsi forța totală pe perete, F, trebuie să adăugăm contribuțiile tuturor moleculelor N:
\
folosim acum definiția mediei, pe care o notăm cu o bară, pentru a găsi forța:
\
vrem forța în termeni de viteză v, mai degrabă decât componenta x a vitezei. Rețineți că viteza totală pătrată este suma pătratelor componentelor sale, astfel încât
\
cu ipoteza izotropiei, cele trei medii din partea dreaptă sunt egale, deci
\
înlocuind aceasta în expresia pentru F dă
\
presiunea este F/A, deci obținem
\ unde am folosit \(V = Al\) pentru volum. Acest lucru dă rezultatul important
\
combinând această ecuație cu \(pV = Nk_BT\) dă
\
putem obține energia cinetică medie a unei molecule, \(\frac{1}{2}m\overline{v}^2\), din partea stângă a ecuației împărțind N și înmulțind cu 3/2.
energia cinetică medie pe moleculă
energia cinetică medie a unei molecule este direct proporțională cu temperatura sa absolută:
\
ecuația \(\overline{K} = \frac{3}{2} k_BT\) este energia cinetică medie pe moleculă. Rețineți în special că nimic din această ecuație nu depinde de masa moleculară (sau de orice altă proprietate) a gazului, de presiune sau de orice altceva decât de temperatură. Dacă probele de heliu și xenon gazos, cu mase moleculare foarte diferite, sunt la aceeași temperatură, moleculele au aceeași energie cinetică medie.
energia internă a unui sistem termodinamic este suma energiilor mecanice ale tuturor moleculelor din el. Acum putem da o ecuație pentru energia internă a unui gaz ideal monatomic. Într-un astfel de gaz, singura energie a moleculelor este energia lor cinetică translațională. Prin urmare, denotând energia internă prin \(e_{int}\) avem pur și simplu \(e_{int} = n\overline{K}\), sau
\
de multe ori am dori să folosim această ecuație în termeni de moli:
\
putem rezolva \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_bt\) pentru o viteză tipică a unei molecule într-un gaz ideal în termeni de temperatură pentru a determina ceea ce este cunoscut sub numele de rădăcină-medie-pătrat (RMS) viteza unei molecule.
viteza RMS a unei Molecule
viteza rădăcină-medie-pătrată (rms) a unei molecule, sau rădăcina pătrată a mediei pătratului vitezei \(\overline{v}^2\), este
\
viteza rms nu este viteza medie sau cea mai probabilă a moleculelor, așa cum vom vedea în distribuția vitezei moleculare, dar oferă o estimare ușor calculată a vitezei moleculelor care este legate de energia lor cinetică. Din nou putem scrie această ecuație în ceea ce privește constanta gazului R și masa molară M în kg/mol:
\
ne abatem pentru o clipă pentru a răspunde la o întrebare care v-ar fi putut apărea: când aplicăm modelul atomilor în loc de particule punctuale teoretice, energia cinetică rotativă ne schimbă rezultatele? Pentru a răspunde la această întrebare, trebuie să apelăm la mecanica cuantică. În mecanica cuantică, energia cinetică de rotație nu poate lua orice valoare; este limitată la un set discret de valori, iar cea mai mică valoare este invers proporțională cu inerția de rotație. Inerția de rotație a unui atom este mică, deoarece aproape toată masa sa se află în nucleu, care are de obicei o rază mai mică de \(10^{-14} m\). Astfel, energia minimă de rotație a unui atom este mult mai mare decât \(\frac{1}{2}k_BT\) pentru orice temperatură realizabilă, iar energia disponibilă nu este suficientă pentru a face un atom să se rotească. Vom reveni la acest punct când vom discuta despre gazele diatomice și poliatomice în secțiunea următoare.
exemplu \(\PageIndex{1}\): Calcularea energiei cinetice și a vitezei unei Molecule de gaz
- care este energia cinetică medie a unei molecule de gaz la \(20,0^oC\) (temperatura camerei)?
- găsiți viteza rms a unei molecule de azot (\(n_2\)) la această temperatură.
strategie
(a) cea cunoscută în ecuație pentru energia cinetică medie este temperatura:
\
înainte de a înlocui valorile în această ecuație, trebuie să convertim temperatura dată în kelvin: \(T = (20,0 + 273) \, K = 293 \, K\). Putem găsi viteza rms a unei molecule de azot folosind ecuația
\
dar trebuie mai întâi să găsim masa unei molecule de azot. Obținând masa molară de azot \(N_2\) din tabelul periodic, găsim
\
soluție
- temperatura singură este suficientă pentru a găsi energia cinetică translațională medie. Înlocuirea temperaturii în ecuația energiei cinetice translaționale dă \
- înlocuind această masă și valoarea pentru\ (k_B\) în ecuația pentru\ (v_{RMS}\) produce \
semnificație
rețineți că energia cinetică medie a moleculei este independentă de tipul moleculei. Energia cinetică translațională medie depinde numai de temperatura absolută. Energia cinetică este foarte mică în comparație cu energiile macroscopice, astfel încât nu simțim când o moleculă de aer ne lovește pielea. Pe de altă parte, este mult mai mare decât diferența tipică de energie potențială gravitațională atunci când o moleculă se deplasează din, Să zicem, partea de sus în partea de jos a unei camere, astfel încât neglijarea gravitației noastre este justificată în situații tipice din lumea reală. Viteza rms a moleculei de azot este surprinzător de mare. Aceste viteze moleculare mari nu produc mișcare macroscopică a aerului, deoarece moleculele se mișcă în toate direcțiile cu probabilitate egală. Calea liberă medie (distanța pe care o moleculă o deplasează în medie între coliziuni, discutată puțin mai târziu în această secțiune) a moleculelor din aer este foarte mică, astfel încât moleculele se mișcă rapid, dar nu ajung foarte departe într-o secundă. Valoarea ridicată pentru viteza rms se reflectă în viteza sunetului, care este de aproximativ 340 m/s la temperatura camerei. Cu cât viteza RMS a moleculelor de aer este mai mare, cu atât vibrațiile sonore mai rapide pot fi transferate prin aer. Viteza sunetului crește odată cu temperatura și este mai mare în gazele cu mase moleculare mici, cum ar fi heliul (vezi figura \(\PageIndex{3}\)).
Example \(\PageIndex{2}\): calcularea temperaturii: viteza de evacuare a atomilor de heliu
pentru a scăpa de gravitația Pământului, un obiect din partea de sus a atmosferei (la o altitudine de 100 km) trebuie să călătorească departe de pământ la 11,1 km / s. această viteză se numește viteza de evacuare. La ce temperatură atomii de heliu ar avea o viteză rms egală cu viteza de evacuare?
strategie
identificați cunoștințele și necunoscutele și determinați ce ecuații să utilizați pentru a rezolva problema.
soluție
- identificați cunoștințele: v este viteza de evacuare, 11,1 km/s.
- identificați necunoscutele: trebuie să rezolvăm temperatura, T. De asemenea, trebuie să rezolvăm masa m a atomului de heliu.
- determinați ce ecuații sunt necesare.
- pentru a obține masa m a atomului de heliu, putem folosi informații din tabelul periodic: \
- pentru a rezolva temperatura T, putem rearanja \ pentru a produce \
- substitui valorile cunoscute în ecuații și de a rezolva pentru necunoscute, \ și \
semnificație
această temperatură este mult mai mare decât temperatura atmosferică, care este de aproximativ 250 K (\(-25^oC\) sau \(-10^de\)) la altitudine mare. Foarte puțini atomi de heliu au rămas în atmosferă, dar mulți au fost prezenți când s-a format atmosfera și mai mulți sunt întotdeauna creați de dezintegrarea radioactivă (vezi capitolul despre fizica nucleară). Motivul pierderii atomilor de heliu este că un număr mic de atomi de heliu au viteze mai mari decât viteza de evacuare a pământului chiar și la temperaturi normale. Viteza unui atom de heliu se schimbă de la o coliziune la alta, astfel încât, în orice moment, există o șansă mică, dar diferită de zero, ca viteza atomului să fie mai mare decât viteza de evacuare. Șansa este suficient de mare încât, de-a lungul vieții Pământului, aproape toți atomii de heliu care au fost în atmosferă au atins viteza de evacuare la altitudini mari și au scăpat de atracția gravitațională a Pământului. Moleculele mai grele, cum ar fi oxigenul, azotul și apa, au viteze rms mai mici și, prin urmare, este mult mai puțin probabil ca oricare dintre ele să aibă viteze mai mari decât viteza de evacuare. De fapt, probabilitatea este atât de mică încât sunt necesare miliarde de ani pentru a pierde cantități semnificative de molecule mai grele din atmosferă. Figura \(\PageIndex{4}\) arată efectul lipsei unei atmosfere pe lună. Deoarece atracția gravitațională a lunii este mult mai slabă, ea și-a pierdut aproape întreaga atmosferă. Atmosferele Pământului și ale altor corpuri sunt comparate în exercițiile acestui capitol.

Exercise \(\PageIndex{2}\)
dacă luăm în considerare un obiect foarte mic, cum ar fi un bob de polen, într-un gaz, atunci numărul de molecule care îi lovesc suprafața ar fi, de asemenea, relativ mic. V-ați aștepta ca bobul de polen să experimenteze fluctuații ale presiunii din cauza fluctuațiilor statistice ale numărului de molecule de gaz care îl lovesc într-o anumită perioadă de timp?
răspuns
Da. Astfel de fluctuații apar de fapt pentru un corp de orice dimensiune într-un gaz, dar din moment ce numărul de molecule este imens pentru corpurile macroscopice, fluctuațiile reprezintă un procent mic din numărul de coliziuni, iar mediile despre care se vorbește în această secțiune variază imperceptibil. Aproximativ vorbind, fluctuațiile sunt invers proporționale cu rădăcina pătrată a numărului de coliziuni, astfel încât pentru corpurile mici, ele pot deveni semnificative. Acest lucru a fost observat de fapt în secolul al XIX-lea pentru boabele de polen din apă și este cunoscut sub numele de mișcare browniană.
presiunea vaporilor, Presiunea parțială și Legea lui Dalton
presiunea pe care un gaz ar crea-o dacă ar ocupa volumul total disponibil se numește presiunea parțială a gazului. Dacă se amestecă două sau mai multe gaze, acestea vor ajunge la echilibru termic ca urmare a coliziunilor dintre molecule; procesul este analog cu conducerea căldurii așa cum este descris în capitolul despre temperatură și căldură. După cum am văzut din teoria cinetică, atunci când gazele au aceeași temperatură, moleculele lor au aceeași energie cinetică medie. Astfel, fiecare gaz respectă legea gazului ideal separat și exercită aceeași presiune asupra pereților unui recipient pe care ar face-o dacă ar fi singur. Prin urmare, într-un amestec de gaze, presiunea totală este suma presiunilor parțiale ale gazelor componente, presupunând un comportament ideal al gazului și fără reacții chimice între componente. Această lege este cunoscută sub numele de legea presiunilor parțiale a lui Dalton, după omul de știință englez John Dalton (1766-1844) care a propus-o. Legea lui Dalton este în concordanță cu faptul că presiunile se adaugă conform principiului lui Pascal.
într-un amestec de gaze ideale în echilibru termic, numărul de molecule ale fiecărui gaz este proporțional cu presiunea sa parțială. Acest rezultat rezultă din aplicarea legii gazului ideal pentru fiecare în forma \(p/n = RT / V\). Deoarece partea dreaptă este aceeași pentru orice gaz la o temperatură dată într-un recipient cu un volum dat, partea stângă este aceeași.
- presiunea parțială este presiunea pe care un gaz ar crea-o dacă ar exista singur.Legea lui Dalton afirmă că presiunea totală este suma presiunilor parțiale ale tuturor gazelor prezente.
- pentru oricare două gaze (etichetate 1 și 2) în echilibru într-un recipient, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
o aplicație importantă a presiunii parțiale este că, în chimie, funcționează ca concentrația unui gaz în determinarea vitezei unei reacții. Aici, menționăm doar că presiunea parțială a oxigenului din plămânii unei persoane este crucială pentru viață și sănătate. Respirația aerului care are o presiune parțială de oxigen sub 0,16 atm poate afecta coordonarea și judecata, în special la persoanele care nu sunt aclimatizate la o altitudine mare. Presiunile parțiale mai mici de \(O_2\) au efecte mai grave; presiunile parțiale sub 0,06 atm pot fi rapid fatale, iar daunele permanente sunt probabile chiar dacă persoana este salvată. Cu toate acestea, senzația de a respira, ca atunci când țineți respirația, este cauzată mult mai mult de concentrații mari de dioxid de carbon în sânge decât de concentrații scăzute de oxigen. Astfel, dacă o cameră mică sau un dulap este umplut cu aer având o concentrație scăzută de oxigen, poate pentru că un cilindru care scurge un gaz comprimat este stocat acolo, o persoană nu va simți nicio senzație de „sufocare” și poate intra în convulsii sau își poate pierde cunoștința fără să observe nimic greșit. Inginerii de siguranță acordă o atenție considerabilă acestui pericol.
o altă aplicație importantă a presiunii parțiale este presiunea vaporilor, care este presiunea parțială a unei vapori la care este în echilibru cu faza lichidă (sau solidă, în cazul sublimării) a aceleiași substanțe. La orice temperatură, presiunea parțială a apei din aer nu poate depăși presiunea de vapori a apei la acea temperatură, deoarece ori de câte ori presiunea parțială atinge presiunea de vapori, apa se condensează din aer. Roua este un exemplu al acestei condensări. Temperatura la care se produce condensarea pentru o probă de aer se numește punctul de rouă. Se măsoară cu ușurință prin răcirea lentă a unei bile metalice; punctul de rouă este temperatura la care condensul apare pentru prima dată pe bilă.
presiunile de vapori ale apei la unele temperaturi de interes pentru meteorologie sunt prezentate în tabelul\(\PageIndex{1}\).
| T(\(^oc\)) | presiunea vaporilor (Pa) |
|---|---|
| 0 | 610,5 |
| 3 | 757,9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) la o temperatură T este definită de
\
o umiditate relativă de \(100\%\) înseamnă că presiunea parțială a apei este egală cu presiunea vaporilor; cu alte cuvinte, aerul este saturat cu apă.
exemplu \(\PageIndex{3}\): calcularea umidității Relative
care este umiditatea relativă atunci când temperatura aerului este \(25^oC\) și punctul de rouă este \(15^oc\)?
strategie
pur și simplu ne uităm în sus presiunea de vapori la temperatura dată și că, la punctul de rouă și pentru a găsi raportul.
soluție
\
semnificație
R. H. este important pentru confortul nostru. Valoarea \(53.8\%\) este în intervalul de\ (40\%\) la\ (60\%\) recomandat pentru confort în interior.
după cum s-a menționat în capitolul despre temperatură și căldură, temperatura scade rar sub punctul de rouă, deoarece atunci când atinge punctul de rouă sau punctul de îngheț, apa se condensează și eliberează o cantitate relativ mare de căldură latentă de vaporizare.
calea liberă medie și timpul liber mediu
acum considerăm coliziunile în mod explicit. Primul pas obișnuit (care este tot ce vom face) este să calculăm calea liberă medie, \(\lambda\), distanța medie pe care o moleculă o parcurge între coliziuni cu alte molecule și timpul liber mediu \(\tau\), timpul mediu dintre coliziunile unei molecule. Dacă presupunem că toate moleculele sunt sfere cu o rază \(r\), atunci o moleculă se va ciocni cu alta dacă centrele lor se află la o distanță de 2r unul de celălalt. Pentru o particulă dată, spunem că aria unui cerc cu acea rază, \(4 \ pi r^2\), este „secțiunea transversală” pentru coliziuni. Pe măsură ce particula se mișcă, urmărește un cilindru cu acea zonă a secțiunii transversale. Calea liberă medie este lungimea \ (\lambda\) astfel încât numărul așteptat de alte molecule dintr-un cilindru de lungime \(\lambda\) și secțiune transversală \(4\pi r^2\) este 1. Dacă ignorăm temporar mișcarea moleculelor, alta decât cea la care ne uităm, numărul așteptat este densitatea numerică a moleculelor, N / V, ori volumul, iar volumul este \(4 \ pi r^2\ lambda\), deci avem \((N / V) 4 \ pi r^2\ lambda = 1\), sau
\
luând în considerare mișcarea tuturor moleculelor face calculul mult mai greu, dar singura modificare este un factor de \(\sqrt{2}\). Rezultatul este
\
într-un gaz ideal, putem înlocui \(V/N = k_BT/p\) pentru a obține
\
timpul liber mediu \(\tau\) este pur și simplu calea liberă medie împărțită la o viteză tipică, iar alegerea obișnuită este viteza rms. Apoi
\
calculul timpului liber mediu
găsiți timpul liber mediu pentru atomii de argon (\(M = 39,9 \, g / mol\)) la o temperatură de \(0^oC\) și o presiune de 1,00 atm. Luați raza unui atom de argon pentru a fi \(1,70 \ ori 10 ^ {-10} \ spațiu m\).
soluție
- identificați cunoștințele și convertiți-le în unități SI. Știm că masa molară este 0.0399 kg / mol, temperatura este de 273 K, presiunea este \(1,01 \ori 10^5 \, Pa\), iar raza este \(1,70 \ori 10^{-10} \, m\).
- găsiți viteza rms: \(v_{rms} = \sqrt{\frac{3RT}{m}} = 413 \, m/s\).
- înlocuiește în ecuație timpul liber mediu: \
semnificație
cu greu putem compara acest rezultat cu intuiția noastră despre moleculele de gaz, dar ne oferă o imagine a moleculelor care se ciocnesc cu o frecvență extrem de ridicată.
exercițiu \(\PageIndex{4}\)
care are o cale liberă medie mai lungă, apă lichidă sau vapori de apă în aer?
răspuns
într-un lichid, moleculele sunt foarte apropiate, ciocnindu-se constant între ele. Pentru ca un gaz să fie aproape ideal, deoarece aerul este în condiții obișnuite, moleculele trebuie să fie foarte îndepărtate. Prin urmare, calea liberă medie este mult mai lungă în aer.
colaboratori și atribuții
-
Samuel J. Ling (Universitatea de Stat Truman), Jeff Sanny (Universitatea Loyola Marymount) și Bill Moebs cu mulți autori care contribuie. Această lucrare este licențiată de OpenStax University Physics sub o licență Creative Commons Attribution (by 4.0).