orbitali moleculari ai unei Carbocații alilice
stabilitatea carbocației propenei se datorează unui sistem Electron conjugat cu Electron. O „legătură dublă” nu există cu adevărat. În schimb, este un grup de 3 orbitali p adiacenți, care se suprapun, ne-hibridizați, pe care îi numim un sistem Electron conjugat cu Electron. Puteți vedea clar interacțiunile dintre toți cei trei orbitali p Din cei trei atomi de carbon rezultând un cation cu adevărat stabil. Totul se reduce la locația carbonului cu deficit de electroni.
descrierile orbitale moleculare pot explica stabilitatea alilică într-un alt mod folosind 2-propenil. Fig.6
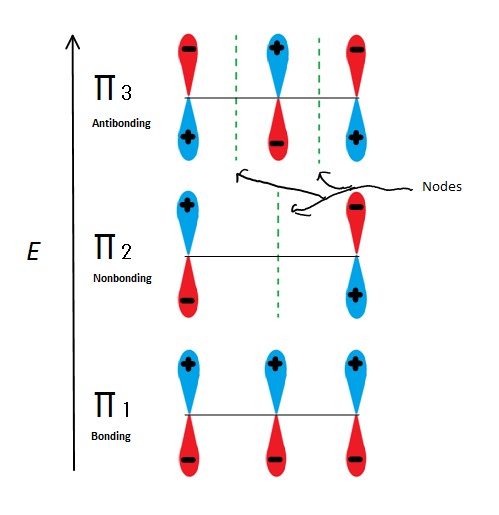
Fig.6 prezintă cele 3 posibile orbitali moleculari ai 2-propenilului
dacă luăm doar orbitalul molecular al centimetrului și nu oricare dintre s, obținem trei dintre ele. π1 este lipirea cu nr de noduri, π2 este nonbonding (cu alte cuvinte, aceeași energie ca un regular p-orbitale) cu un nod, și π3 este antibonding cu 2 noduri (nici unul dintre orbitalii interacționează). Primii doi electroni vor intra în orbitalul molecular al celui de-al 1-lea, indiferent dacă este un cation, un radical sau un anion. Dacă este un radical sau un anion, următorul electron intră în orbitalul molecular al celor 2 centimetrii. Ultimul electron anionic intră și în orbitalul nonbonding. Deci, indiferent ce fel de centru de carbon există, niciun electron nu va intra vreodată în orbitalul antibonding.
orbitalii de legătură sunt orbitalii cu cea mai mică energie și sunt favorabili, motiv pentru care sunt umpluți mai întâi. Chiar dacă orbitalii nonbonding pot fi umpluți, energia totală a sistemului este încă mai mică și mai stabilă datorită orbitalilor moleculari de legătură umpluți.
această cifră arată, de asemenea, că, în cazul în care un singur nod trece prin mijloc, acesta este singurul orbital molecular în care electrionul diferă, și este, de asemenea, în cazul în care un singur nod trece prin mijloc. Din această cauză, sarcinile moleculei se află în principal pe cei doi atomi de carbon terminali și nu pe carbonul Mijlociu.
această descriere orbitală moleculară poate ilustra, de asemenea, stabilitatea centrelor de carbon alilic în Figura 7.
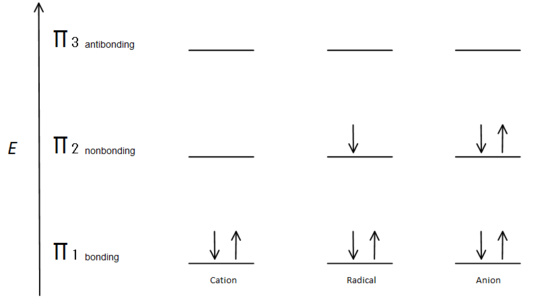
Fig.7 diagrama care arată modul în care electronii se umplu pe baza principiului Aufbau.
orbitalul de legătură cu numărul unu este mai mic în energie decât orbitalul P care nu se leagă. Deoarece fiecare centru de carbon prezentat are doi electroni în energia inferioară, legând orbitalii de la centimi, energia fiecărui sistem este redusă în general (și astfel mai stabilă), indiferent de cation, radical sau anion.