un bărbat în vârstă de 49 de ani, cu antecedente de abuz de alcool, prezintă ED cu plângeri de dureri abdominale generalizate și vărsături în ultimele 36 de ore. Pacientul este bine cunoscut Departamentului pentru vizitele legate de alcool și continuă să bea zilnic. La sosire, el este tahicardic și tahipneic, iar rezultatele examinării fizice includ membranele mucoase uscate, scăderea turgorului sakin, sensibilitatea epigastrică și un tremur în ambele mâini. Studiile de laborator arată un bicarbonat seric de 10 mEq/L, un decalaj anionic de 30, o glucoză serică de 95 mg / dL, o acidoză lactică cu pH 7,2, hipofosfatemie și urme cetonurie. Scanarea CT abdominală este normală. El neagă un istoric de diabet zaharat, ingestia de alcooli toxici sau boli recente.
acest pacient ar putea avea oricare dintre numeroasele diagnostice, dar prezentarea sa și descoperirile de laborator sunt cele mai consistente cu cetoacidoza alcoolică (AKA). AKA poate fi un diagnostic comun de ED și apare de obicei la consumatorii cronici de alcool care au o încetare bruscă a consumului de alcool, împreună cu scăderea aportului glicemic și epuizarea volumului intravascular.1
în majoritatea cazurilor, un eveniment precipitat, cum ar fi pancreatita, gastrita sau o pneumonie de aspirație duce la o scădere bruscă a aportului oral. Aproximativ 24 până la 72 de ore după încetarea aportului de PO, AKA se poate dezvolta.2 acești pacienți au de obicei o concentrație serică scăzută sau absentă de alcool și se pot prezenta cu diferite grade de retragere a alcoolului. Cu toate acestea, un senzoriu clar este un semn distinctiv al acestei afecțiuni. Prezența unei modificări a conștiinței sugerează cu tărie că este prezent un alt proces.3
deși fiziopatologia de bază este complexă, o înțelegere adecvată ajută foarte mult la diagnosticarea și gestionarea acestei afecțiuni.
există trei concepte generale care conduc AKA:
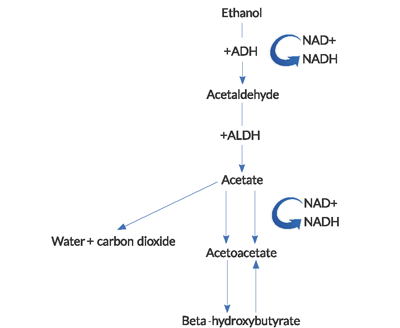
- ingestia de alcool, agravată de scăderea aportului caloric și deshidratare, favorizează o stare cetotică.cetoacidoza este cauzată de o combinație de factori, inclusiv hipoinsulinemia indusă de foame, oxidarea alcoolului la diferiții săi metaboliți cetonici, lipoliza cu eliberarea de acid gras liber (FFA) și contracția volumului intravascular. Starea relativă de foame în AKA duce la secreția excesivă de glucagon și la concentrații reduse de insulină periferică, care joacă un rol cheie în dezvoltarea cetoacidozei. Metabolismul grăsimilor prin lipoliză produce beta-hidroxibutirat (BHB) și acitil-acetat (ACA). Aceste cetone sunt utilizate pentru respirația celulară pentru a furniza energie prin producția de adenozin trifosfat (ATP), dar se adaugă la acidoza anionică observată în AKA.
- în timpul metabolizării etanolului, se generează cantități mari de NADH (forma redusă de nicotinamidă-adenină dinucleotidă).4
NAD + este o coenzimă utilizată pentru a transporta electroni în reacțiile redox intracelulare. Reducerea NAD + și acumularea consecventă și dezechilibrul NADH în metabolismul etanolului are câteva consecințe importante. Generația BHB predomină asupra producției de ACA în acest raport NADH ridicat la NAD+. Acest raport anormal duce la o inhibare a ciclului acidului citric și a gluconeogenezei hepatice, ceea ce explică parțial de ce hiperglicemia este rară la acești pacienți.Aproape contraintuitiv, există un eșec în regenerarea nivelurilor normale de NAD + și ACA în AKA. Reoxidarea NADH la NAD + pare a fi limitată de o combinație de factori, inclusiv hipofosfatemia și un bloc funcțional în mitocondrii.2acidoza lactică observată în AKA se datorează unei stări redox anormale. Piruvatul este un substrat utilizat în numeroase căi producătoare de energie, dar în cetoacidoza alcoolică, acesta este mutat de la căile sale metabolice normale la altele care cresc producția de lactat. În plus, regenerarea piruvatului din acidul lactic este afectată.
- o stare adrenergică sporită și epuizarea volumului agravează cetoza și inhibă gluconeogeneza, creând o stare care favorizează crearea și menținerea unui mediu cetotic.
organismul răspunde la înfometare, deshidratare și hipoglicemie cu eliberarea hormonilor contrareglatori. Acești hormoni cresc tonusul simpatic, scad eliberarea insulinei și cresc concentrația de cetonă prin eliberarea FFA și scăderea metabolismului cetonic periferic. Toate aceste modificări perpetuează starea cetotică până când glucoza este reintrodusă în sistem. Deshidratarea semnificativă datorată vărsăturilor și scăderea aportului oral duce la afectarea clearance-ului renal al cetonei, exacerbând și mai mult situația.2diagnosticul diferențial pentru AKA ar trebui să includă cetoza înfometată și cetoacidoza diabetică (DKA). Deși un istoric amănunțit poate ajuta la restrângerea diferențialului, un panou metabolic este esențial pentru confirmarea diagnosticului. Lacune anionice de 30 mEq / L sau mai mult pot fi observate în AKA, deși decalajul poate fi ascuns de o alcaloză metabolică primară concomitentă din cauza vărsăturilor. De fapt, există rapoarte de caz ale pacienților cu AKA care au un pH seric alcalemic din cauza vărsăturilor excesive.Decalajul anionic în cetoza înfometării este de obicei mult mai mic, cu niveluri de bicarbonat rareori sub 18 mEq/L, iar pH-ul seric de obicei peste 7,30.2 în DKA, în schimb, diferența de anioni poate fi destul de mare, nivelurile de bicarbonat ajungând frecvent la o singură cifră. Hiperglicemia cu glicozurie, observată de obicei în cetoacidoza diabetică (DKA), este rară cu AKA.4 malnutriția cronică duce la rezerve scăzute de glicogen, iar tonul adrenergic sporit duce la inhibarea gluconeogenezei hepatice. Cetonuria, prezentă în toate aceste trei condiții, poate confunda severitatea AKA.Cetonuria este măsurată prin testul nitroprusid, în care o schimbare de culoare indică concentrația relativă de acetonă și ACA în urină. Prezența BHB, cea mai proeminentă cetonă prezentă în AKA, nu este reflectată de testul nitroprusside. Acest lucru explică de ce pacienții cu AKA pot prezenta nici o cetonurie sau doar ușoară la prezentarea inițială, cu o creștere paradoxală pe măsură ce starea este inversată. Pe măsură ce raportul ACA:BHB se normalizează, atât Aca detectabil, cât și BHB sunt eliminate în urină.
diagnostic diferențial
alte afecțiuni care pot pune viața în pericol și care pot provoca o acidoză semnificativă a decalajului anionic trebuie, de asemenea, luate în considerare în diagnosticul diferențial. Alcoolii toxici, în special metanolul și etilenglicolul, pot fi ingerați intenționat sau accidental la această populație de pacienți. Aceste ingerări pot provoca morbiditate și mortalitate semnificative dacă nu sunt gestionate corespunzător.5 starea mentală modificată este o caracteristică comună a ingerării alcoolului toxic, dar nu este de obicei văzută în AKA.5
pacienții vor avea de obicei un decalaj osmolar inițial care trece la un decalaj anionic crescut pe măsură ce alcoolul toxic este metabolizat. Concentrația serică crescută de BHB poate fi destul de ridicată în AKA, dar acest lucru nu exclude neapărat posibilitatea ingestiei toxice de alcool; nici absența unui decalaj osmolar sau anionic nu exclude diagnosticul. În timp ce pacienții din AKA au o ușoară acidoză lactică, prezența unui nivel semnificativ crescut de lactat ar trebui să determine căutarea unei boli subiacente. Rareori, o combinație de AKA și unul dintre aceste alte evenimente pot să apară și să prezinte o enigmă de diagnostic. Luarea în considerare atentă a momentului, tipului și cantității de ingestie și a simptomelor asociate, în combinație cu studiile de observare și de laborator, trebuie utilizată pentru a face această diferențiere dacă lipsește un istoric clar și precis.
tratamentul
inversarea cetozei și rehidratarea viguroasă sunt esențiale în gestionarea AKA. În plus față de înlocuirea fluidelor izotonice, sunt necesare fluide intravenoase care conțin dextroză. De obicei, 5% dextroză cu soluție salină semi-normală la o rată de 150 mL pe oră oferă suficientă glucoză pentru a stimula pancreasul să secrete insulină, permițând țesuturilor periferice să metabolizeze cetonele și să inhibe eliberarea FFA.2 de asemenea, permite organismului să regenereze NAD+, care este inhibat de modificările metabolice cauzate de AKA. Perfuziile fluide care conțin dextroză intravenoasă trebuie oprite odată ce concentrațiile de bicarbonat au atins 18-20 mEq / L și pacientul tolerează administrarea orală. Aceasta apare de obicei la 8 până la 16 ore după inițierea tratamentului.2 retragerea alcoolului la acești pacienți trebuie gestionată agresiv cu benzodiazepine intravenoase. Tiamina, folatul și alți electroliți, în special fosfatul și potasiul, ar putea fi necesare la acești pacienți.6 interesant, majoritatea morbidității observate în AKA se datorează procesului de bază care a provocat încetarea alcoolului.
concluzia cazului
pacientul a primit 4 litri de soluție salină normală și a fost început pe D5-1/2 NS înainte de internare. I s-a administrat IV valium pentru retragerea alcoolului, iar tiamina, folatul și fosfatul au fost completate. El a fost internat în spital timp de trei zile pentru gestionarea AKA și retragerea alcoolului, apoi evacuat o dată tolerând aportul oral și în stare bună. El a fost văzut trei săptămâni mai târziu în departamentul de urgență pentru o prezentare similară.
Tabelul 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Calea metabolismului alcoolului
(ADH = alcool dehidrogenază, ALDH = acetaldehidă dehidrogenază).
- Palmer, Jerry P. cetoacidoza alcoolică: prezentare clinică și de laborator, Fiziopatologie și tratament. Clinici în endocrinologie și metabolism 12.2 (1983): 381-389.
- Duffens K, Marx JA. Revizuirea cetoacidozei alcoolice.Jurnalul de medicină de urgență 5.5 (1987): 399-406.
- Wrenn KD, Slovis CM, Minion GE și colab. Sindromul cetoacidozei alcoolice. Jurnalul American de medicină 91.2 (1991): 119-128.
- Marx JA, HOCKBERGER RS, Walls RM și colab., eds. Medicina de urgență Rosens inox: concepte și Practică Clinică. Philadelphia, PA: Mosby / Elsevier; 2013. Capitolul 185 boala legată de alcool de John T. Finnell.
- Kraut JA, Kurtz I. ingerări de alcool toxic: caracteristici clinice, diagnostic și management. Jurnalul Clinic al Societății Americane de Nefrologie 3.1 (2008): 208-225.
- Miller PD, Heinig R, Waterhouse C. tratamentul acidozei alcoolice: rolul dextrozei și fosforului. Arhive de Medicină Internă 138.1 (1978): 67-72.