六フッ化硫黄またはSF6は、無機、温室効果ガスです。 それは非可燃性、無臭、無色で、優秀な絶縁体です。 これは、化学愛好家の間で会話の興味深い話題となっている超原子価八面体分子です。
アンリ-モアッサンはSF6の存在を発見した。 ちなみに、彼はフッ素の発見者でもあります。 SF6を合成する標準的な方法は、S8をF2にさらすことです。 この方法は、いくつかの硫黄フッ化物の形成を引き起こすが、それらは加熱し、その後、任意の追加のSF4分子を除去するためにNaOHを使用することによSF6は合成直後は使用できません。
SF6は合成後すぐには使用できません。 それはすべての反応性フッ化物を取り除くために精製される必要があります。 その後、熱分解を経る必要があります。
このブログ記事では、SF6のルイス構造とその結合角、分子幾何学と形状を学び、この分子の物理的性質を理解するのに役立ちます。
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis 任意の分子の構造は、我々は最初の原子価電子の総数を知る必要があります。 ここでは、硫黄原子とフッ素原子の両方の価電子を追加することによって、SF6の価電子の総数を調べます。
SF6の価電子の総数–硫黄の価電子+フッ素の価電子
硫黄は六つの価電子を持っています。フッ素は7つの価電子を持っていますが、この分子には6つのフッ素原子があるので、この数に6を掛けます。
フッ素は7つの価電子を持っていますが、この分子には6つのフッ素原子があります。
=6 + 7*6
=6+42
=48価電子
したがって、SF6は48価電子を持ち、SF6のルイスドット構造を描くのに役立ちます。
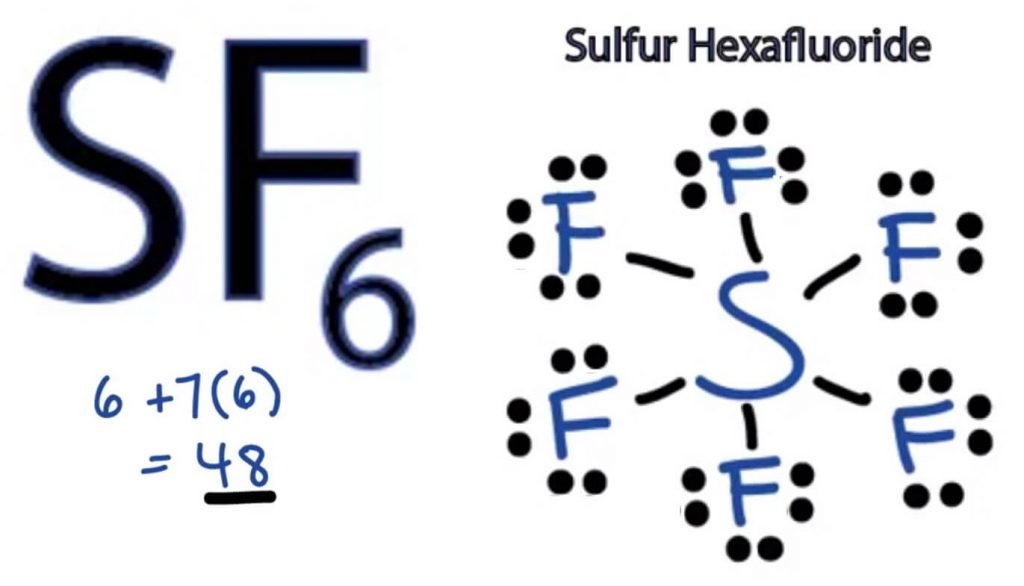
SF6ルイス構造
任意の分子のルイスドット構造は、構造とその個々の価電子の形成に関与する原子の絵の表現です。 この構造は、分子内の結合形成とその中の電子の配置を知るのに役立ちます。それはフッ素よりも電気陰性度が低いので、硫黄原子は中心位置を取るでしょう。
硫黄原子はフッ素よりも電気陰性度が低いので、中心位置を取 したがって、中心に置き、その周りのすべてのフッ素原子を次のように配置します。
フッ素原子は、そのオクテットを完了するために1つの価電子 すべての原子が安定した構造を達成するためにオクテット則に従うように、フッ素原子は硫黄原子の一つの価電子を共有します。 このように、硫黄は、SとFの間に六つの単結合を形成する結果、すべてのフッ素原子とその価電子の六つを共有します。
ルイス構造では、二つの原子の間に直線を描くことによって構造内の結合を示しています。 したがって、これらの結合はすべて48のうち12個の価電子を占有します。
フッ素原子の周りに残りのすべての価電子を配置し、すべてのフッ素原子のオクテットが完全であるかどうかを確認します。
それを行うと、すべてのフッ素原子の外殻に価電子が表示されますが、硫黄はその外殻に8つ以上の電子を持っています。
それを行うと、すべてのフッ素原子の外殻に価電子が表示されますが、硫黄はその外殻に8つ以上の電子があります。 これは、オクテットの役割の例外であり、より多くの電子を収容するためにその軌道を拡張することができるためです。したがって、これはSF6の右ルイス構造である。
SF6ハイブリダイゼーション
SF6のルイス構造がわかったので、分子内の原子のハイブリダイゼーションを決定することができるようになりました。 ここでは、硫黄がフッ素原子とその電子を共有しているので、そのハイブリダイゼーションを見ていきます。
基底状態のSF6の電子配置は3s23p4です。 しかし、それが電子を共有し、励起状態にあるとき、3s軌道と3p軌道の両方の電子対は対にならない。 これらの電子は、より高い空いている3d軌道を埋めるために移動する。 その結果、六つのハイブリッド軌道が形成される(3sのうちの一つ、3pのうちの三つ、および二つの3d)。 これらのハイブリッド軌道は、共有電子を収容するものです。 これらの軌道は、硫黄原子とフッ素原子が結合を形成するときにフッ素原子の2p軌道と重複する。 これらの6つの軌道は八面体の形の6つの方向にあります。
したがって、六フッ化硫黄はsp3d2ハイブリダイゼーションを有する。
SF6結合角
硫黄は6つのフッ素原子とその価電子を共有するので、硫黄原子の6つの電子すべてが共有されて結合を形成する F-S-Fの結合角は90度です。
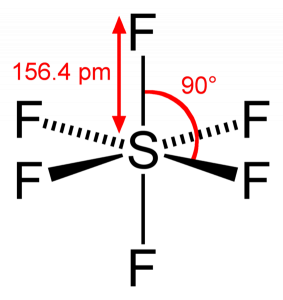
SF6分子幾何学
硫黄六フッ化物分子を見ると、硫黄は中心位置にあり、フッ素原子はその周りに対称的に配置されている。 原子は八面体パターンに配置されており、SF6の分子幾何学は八面体である。 分子の分子形状を見ると、SF6分子は八面体の形状をしていると言えます。 しかし、中心原子は六つのフッ素原子と結合し、SF6の形状は八面体である。P>

SF6は極性または非極性ですか?

SF6は極性または非極性ですか?
SF6は非極性分子である。 これは、VSEPR理論では、6つのフッ素原子が硫黄原子の周りに対称的に配置されていると、結合双極子が相殺されると言われているためです。 結果として、それは非極性分子である。P>

それはまた、水に非可溶性であり、非極性有機溶媒に可溶性であるなどの非極性分子と同じ特性を有する。
おわりに
この記事を要約すると、SF6のルイスドット構造では、すべての価電子が使い果たされ、孤立電子対を持たないS-Fの間に六つの単結合が形成されると言うことができる。
この分子中の硫黄のハイブリダイゼーションはsp3d2であり、結合角は90度である。
SF6の分子幾何学は八面体であり、それは非極性分子である。