o diagrama de Lewis de muitas moléculas, no entanto, não é consistente com as propriedades observadas da molécula.exemplo 1: Íon nitrato
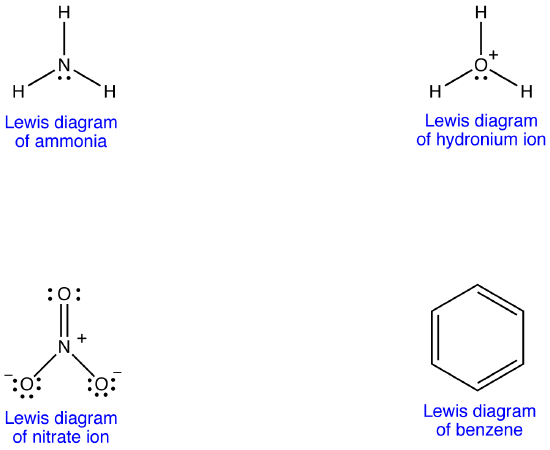
O íon nitrato, de acordo com seu diagrama de Lewis, tem dois tipos de ligações nitrogênio-oxigênio, uma ligação dupla e duas ligações únicas, sugerindo que uma ligação Nitrogênio-Oxigênio no íon nitrato é mais curta e mais forte do que cada uma das outras duas. Além disso, a estrutura de Lewis implica, em relação à carga formal, que existem dois tipos de átomos de oxigênio no íon nitrato, um formalmente neutro e cada um dos outros dois carregando uma carga formal de -1. Experimentalmente, no entanto, as três ligações Nitrogênio-Oxigênio no íon nitrato têm o mesmo comprimento de ligação e a mesma energia de ligação, e os três átomos de oxigênio são indistinguíveis. The Lewis diagram fails to explain the structure and bonding of the nitrate ion satisfatoriamente.dois diagramas adicionais de Lewis podem ser desenhados para o íon nitrato.
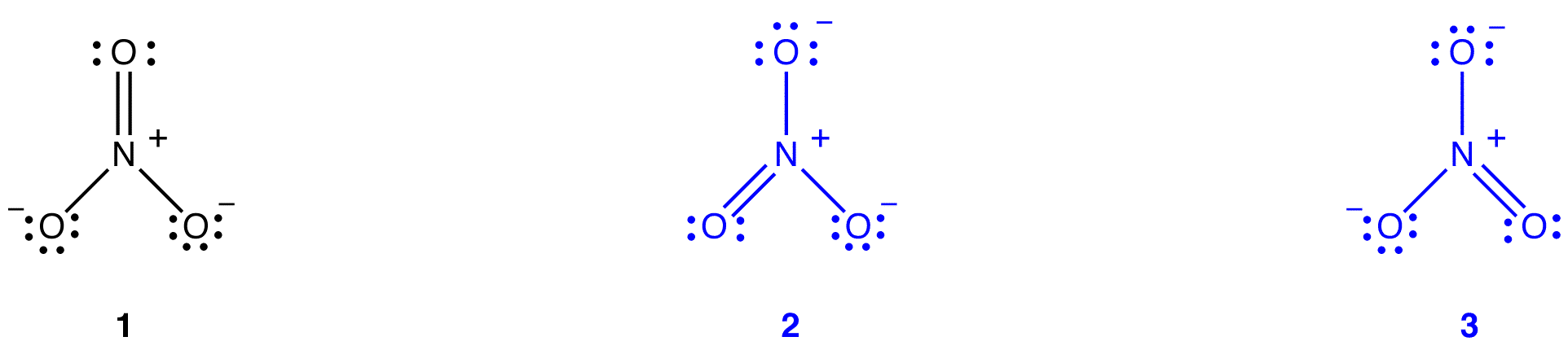
No entanto, nenhum deles é consistente com as propriedades observadas do íon nitrato e, portanto, não descreve corretamente o íon nitrato.
Exemplo 2: Benzeno
benzeno, de acordo com seu diagrama de Lewis, tem dois tipos de ligações carbono-carbono, três ligações duplas e três ligações únicas, sugerindo que cada uma das três ligações carbono-carbono no benzeno é mais curta e mais forte do que cada uma das outras três. Experimentalmente, no entanto, as seis ligações carbono-carbono no benzeno têm o mesmo comprimento de ligação e a mesma energia de ligação. The Lewis diagram fails to explain the structure and bonding of benzene satisfatoriamente.
um atributo de moléculas das quais o diagrama de Lewis clássico não é consistente com as propriedades observadas é que outros diagramas de Lewis válidos podem ser gerados para elas. Um diagrama adicional de Lewis pode ser desenhado para benzeno.

no Entanto, nenhum deles é consistente com o observado propriedades de benzeno e, portanto, não correctamente retratam o benzeno.
A Teoria da ressonância é uma tentativa de explicar a estrutura de uma espécie, como o íon nitrato ou benzeno, sem Diagrama de Lewis do qual é consistente com as propriedades observadas da espécie. A principal vantagem da teoria da ressonância é que, embora baseada em análise matemática rigorosa, a teoria da ressonância pode ser aplicada com sucesso invocando pouca ou nenhuma matemática. A teoria da ressonância é explicada abaixo usando o íon nitrato como exemplo.de acordo com a teoria da ressonância, a estrutura do íon nitrato não é 1 Nem 2 nem 3, mas a média dos três, ponderada pela estabilidade. Os diagramas de Lewis 1, 2 e 3 são chamados de formas de ressonância, estruturas de ressonância ou contribuidores de ressonância do íon nitrato. A estrutura do íon nitrato é dito ser um híbrido de ressonância ou, simplesmente, híbrido de formas de ressonância 1, 2 e 3. Sempre que é necessário mostrar a estrutura do íon nitrato, as formas de ressonância 1, 2 e 3 são desenhadas, conectadas por uma seta de duas cabeças.
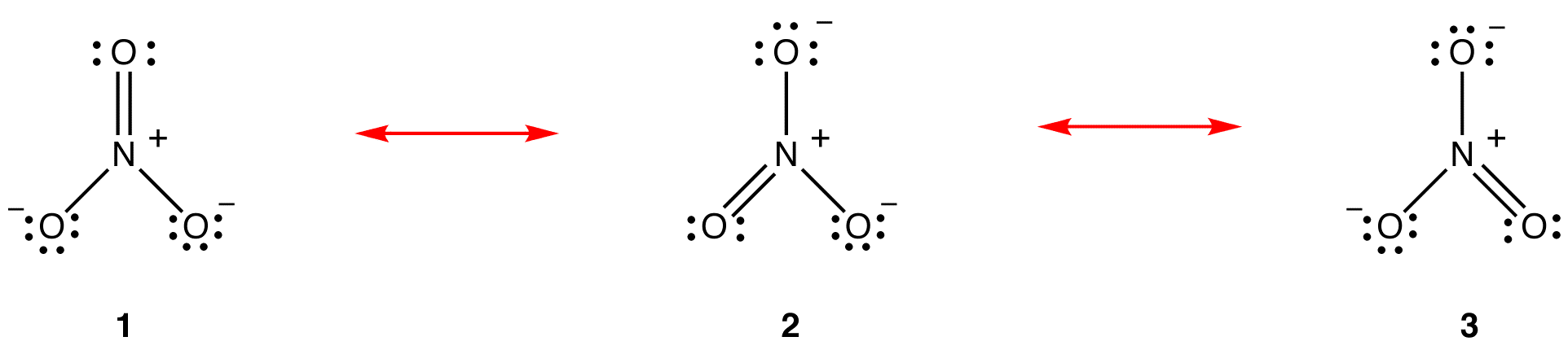
as três formas de ressonância do íon nitrato, 1, 2 e 3, são idênticas, por isso têm a mesma estabilidade e, portanto, contribuem igualmente para o híbrido. Uma vez que a extensão exata em que cada forma de ressonância do íon nitrato contribui para o híbrido é conhecida, a ordem de ligação de cada ligação nitrogênio-oxigênio, bem como a carga formal sobre cada átomo de oxigênio no híbrido pode ser facilmente determinada:
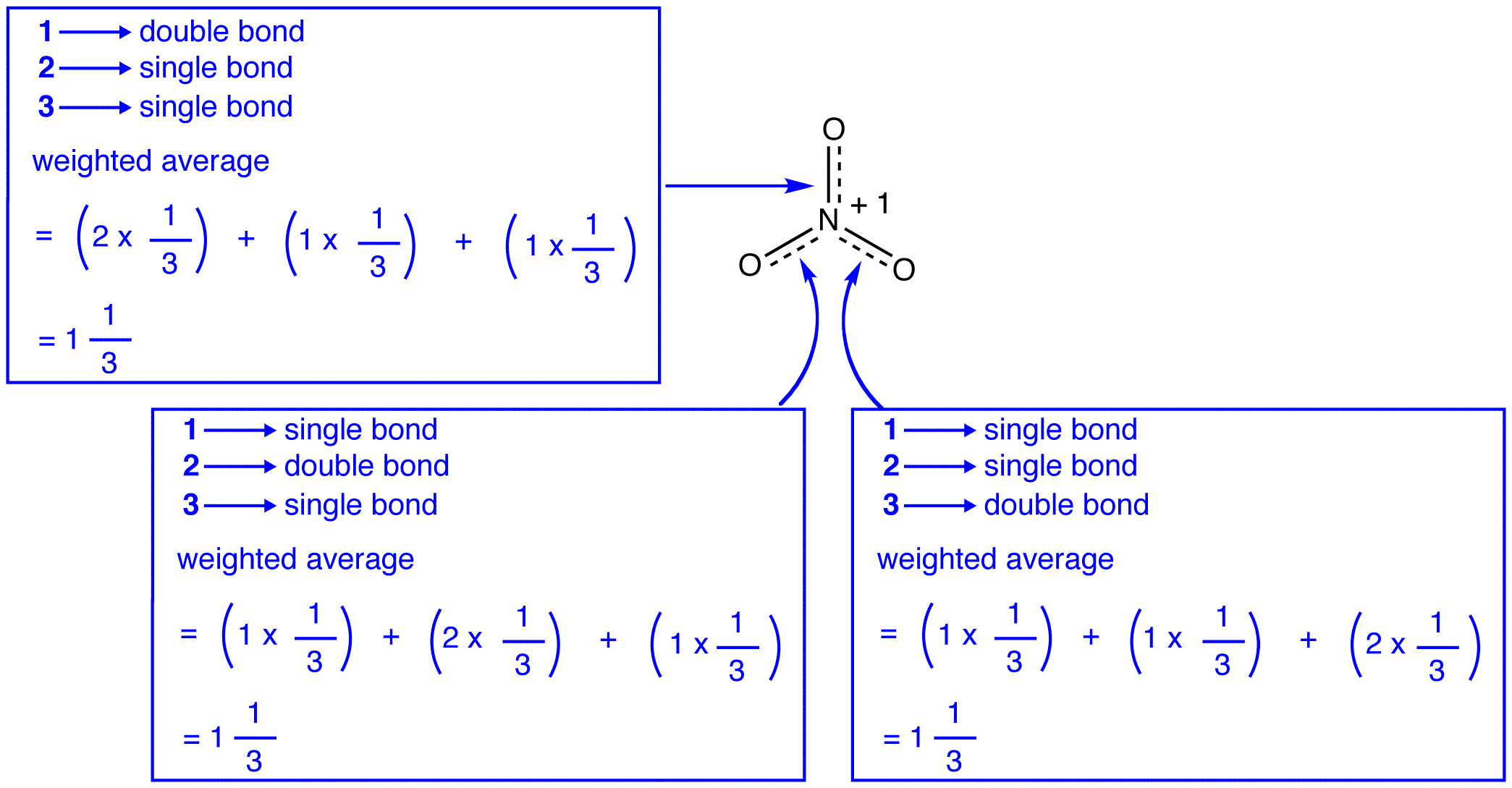
de Acordo com a teoria de ressonância, cada título do nitrato, íon é um e um terço de um título, o que é consistente com a observação de que os três títulos do nitrato, íon tem o mesmo comprimento de ligação e a mesma energia de ligação.
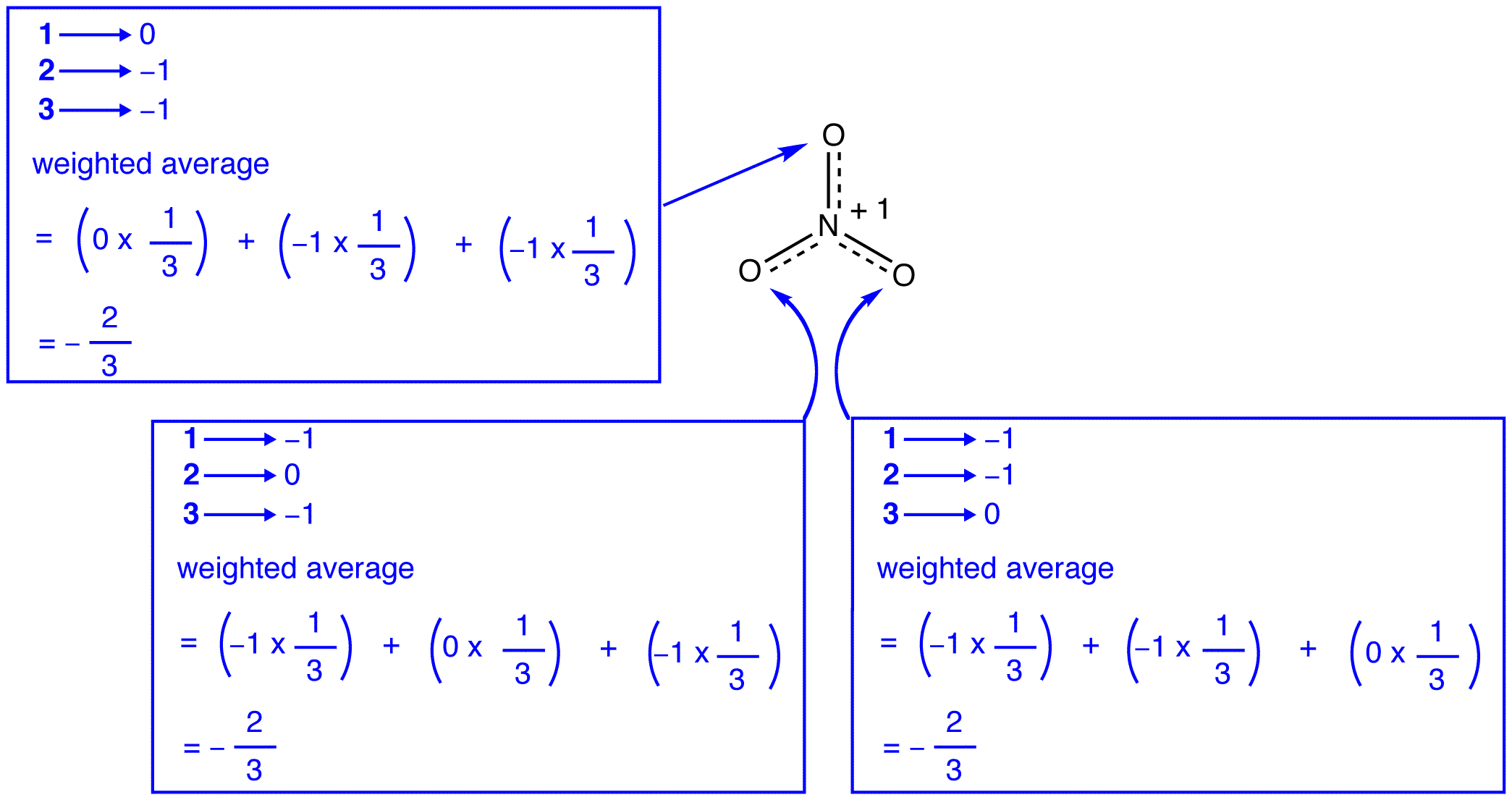
de Acordo com a teoria de ressonância, cada átomo de oxigênio do nitrato, íon tem uma carga formal de -2/3, que, em conjunto com o fato de que os três nitrogênio-oxigênio títulos são idênticos, é consistente com a observação de que os três átomos de oxigênio do nitrato de iões de são indistinguíveis.
em cada forma de ressonância do íon nitrato, existem dois elétrons pi, e eles são compartilhados apenas por dois átomos. Um elétron compartilhado apenas por dois átomos é dito ser localizado. Assim, os dois elétrons pi em cada forma de ressonância do íon nitrato são localizados. O nitrato de íons de lítio, como representado pela híbrido, tem dois elétrons pi:
# elétrons em um pi bond = 2
# elétrons em um terço de um pi bond = 2/3
# elétrons em três deles = 3 x (2/3) = 2
Os dois elétrons pi do nitrato de iões de são compartilhados por um total de quatro átomos, um átomo de nitrogênio e três átomos de oxigênio. Diz-se que um elétron compartilhado por mais de dois átomos é deslocalizado. Assim, os dois elétrons pi no íon nitrato são deslocalizados. A deslocalização dos elétrons pi no íon nitrato requer que os quatro átomos estejam no mesmo plano, permitindo a sobreposição lateral dos orbitais p sobre eles.

Se a energia do nitrato, íon foram a média ponderada das energias de seus três formas de ressonância, assim como a estrutura do nitrato, íon é a média ponderada das estruturas de suas três formas de ressonância, deve ser igual à energia de um dos três idênticos ressonância formas:

Se a energia do híbrido fosse igual ao de uma ressonância forma, dado que todas as substâncias químicas (partículas elementares, átomos, moléculas, etc. naturalmente tendem a estar no estado de energia mais baixo possível, não haveria nenhuma vantagem para o íon nitrato existir como o híbrido; poderia simplesmente existir como uma forma de ressonância. Uma vez que o íon nitrato existe como o híbrido, não como uma forma de ressonância, pode-se inferir que a energia do híbrido é menor do que a de qualquer uma das formas de ressonância.

de acordo com a teoria da ressonância então, a energia de uma molécula é menor do que a da forma de ressonância de menor energia. Uma vez que o íon nitrato tem menor energia e, portanto, é mais estável do que qualquer uma de suas formas de ressonância, o íon nitrato é dito ser ressonância estabilizada.
Existem dois equívocos sobre a teoria da ressonância entre os estudantes iniciantes, provavelmente devido à interpretação literal da palavra ressonância. Eles são descritos abaixo, usando o íon nitrato como exemplo.
equívoco 1: O íon nitrato existe como forma de ressonância 1 por um momento e então muda para a forma de ressonância 2 ou para a forma de ressonância 3, que interconverte, ou reverte para 1.

a estrutura do ião nitrato não é 1 Nem 2 nem 3, mas o híbrido e não muda com o tempo, a menos que seja submetido a uma reacção.
equívoco 2: em uma amostra de íons nitratos, em um dado momento, um terço dos íons existem como forma de ressonância 1, outro terço como forma de ressonância 2, e o restante um terço como forma de ressonância 3.

numa amostra de íons nitratos, num dado momento, todos os íons têm a mesma estrutura, que é o híbrido.
a analogia clássica usada para esclarecer estes dois equívocos é a mula (Morrison, R. T.; Boyd, R. N. E. Organic Chemistry, quinta edição; Allyn and Bacon: Boston, 1987, pg. 373). Biologicamente, uma mula é um híbrido de um cavalo e um burro. Isso não significa que uma mula se assemelha a um cavalo por um momento e, em seguida, muda para se assemelhar a um burro. A aparência de uma mula é uma combinação da de um cavalo e a de um burro e não muda com o tempo. Nem significa que, numa manada, algumas mulas se assemelham a um cavalo e as outras a um burro. Em uma manada, todas as mulas têm a mesma aparência, que é uma combinação de um cavalo e um burro. A fraqueza desta analogia é que cavalos e burros existem, enquanto as formas de ressonância são estritamente hipotéticas. Uma melhor analogia, citada em Morrison e Boyd, é o rinoceronte. Ao ver um rinoceronte, pode-se descrevê-lo como o híbrido de um dragão e um unicórnio, duas criaturas que não existem.
regras para desenhar formas de ressonância
1. Formas de ressonância são diagramas de Lewis, que são baseados na teoria de ligação de Valência.Devem, portanto, obedecer às regras básicas da teoria da ligação de Valência. Assim, hidrogênio não pode ter mais de dois elétrons de Valência; período-dois elementos não podem ter mais de oito elétrons de Valência; elementos no período três e abaixo podem ter mais de oito elétrons de Valência. eg: em cada forma de ressonância do íon nitrato, há dois elementos, nitrogênio e oxigênio, que são Período-Dois elementos. Em nenhuma das formas de ressonância do íon nitrato há mais de oito elétrons de Valência em qualquer um dos átomos. 2. Todas as formas de ressonância devem ter a mesma estrutura de ligação sigma, diferindo apenas nas localizações de elétrons pi e elétrons de Valência não fiados. eg: todas as três formas de ressonância do íon nitrato têm a mesma estrutura de ligação sigma:
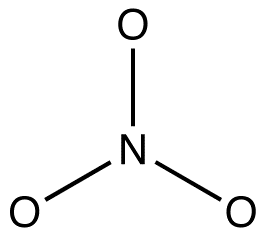
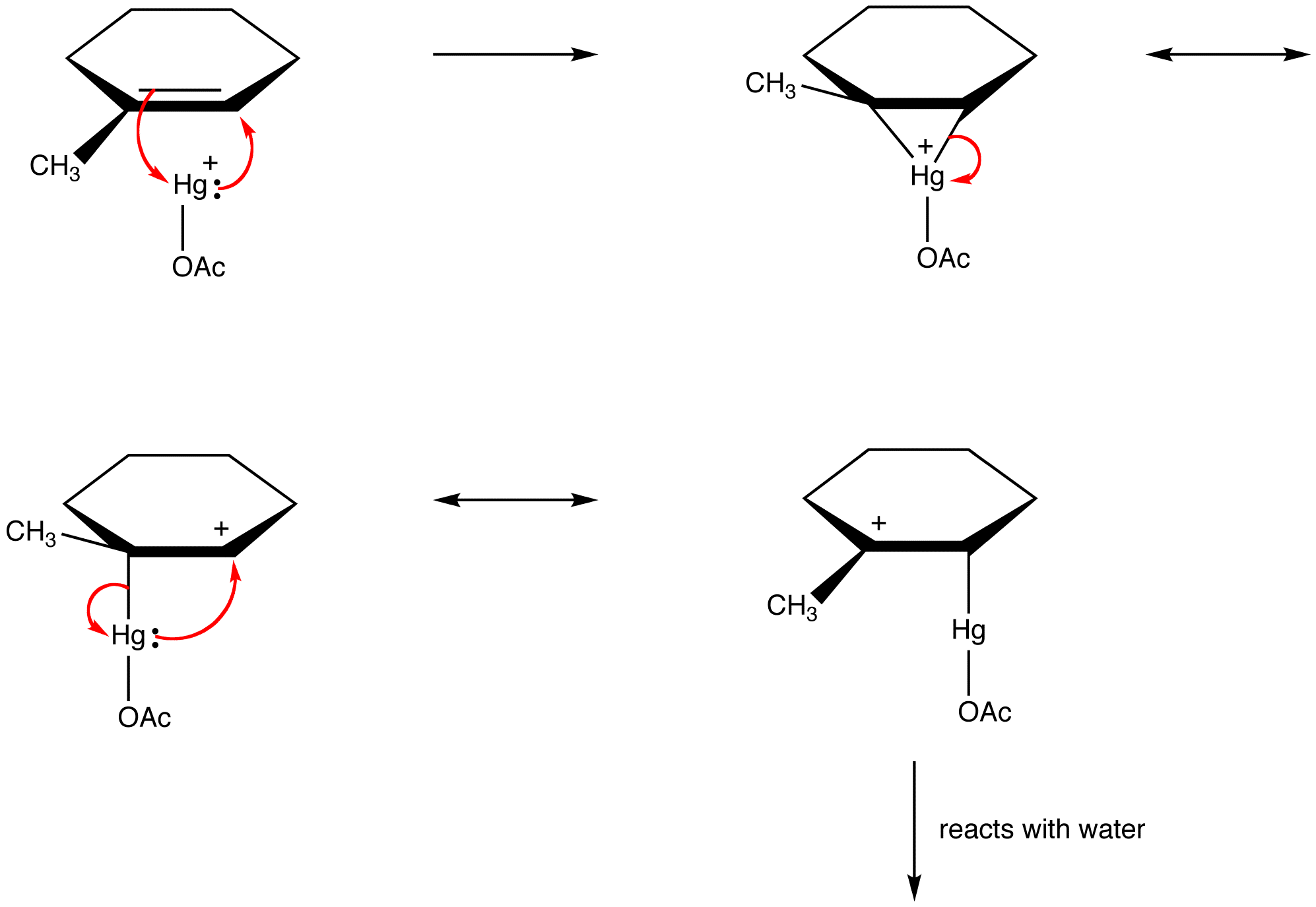
diferem umas das outras apenas nas localizações dos elétrons pi e pares solitários.químicos orgânicos violam cada vez mais esta regra para explicar as estruturas de intermediários reativos como espécies estabilizadas por ressonância. por exemplo: oxymercuration
a Determinação da Contribuição Relativa das Formas de Ressonância para o Híbrido
As três formas de nitrato de iões de são idênticas e, portanto, têm a mesma estabilidade. Consequentemente, contribuem igualmente para o híbrido. As formas de ressonância da maioria das moléculas estabilizadas por ressonância são diferentes umas das outras, de modo que não contribuem igualmente para o híbrido. Quanto mais estável a forma de ressonância, mais ela contribui para o híbrido. Assim, a determinação da contribuição relativa ou das formas de ressonância para o híbrido requer a determinação da sua estabilidade relativa. Use as seguintes regras para determinar a estabilidade relativa das formas de ressonância.
Rule 1:
a resonance form in which all atoms have an octet of valence electrons is more stable than one in which at least one atom does not. exemplo:
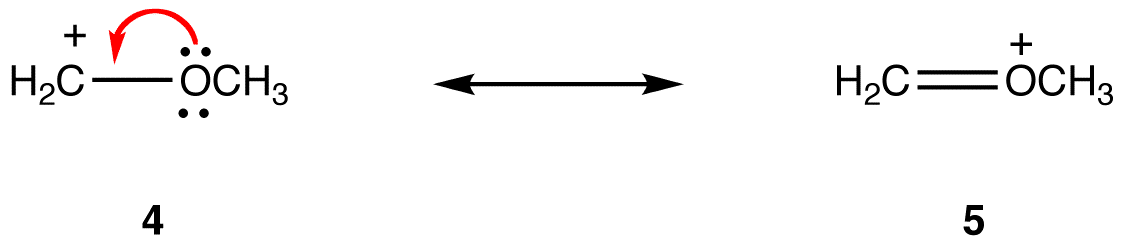
Em ressonância formulário 5, todos os átomos têm um octeto de elétrons de valência; em 4, um átomo, o átomo de carbono do rolamento formal de carga de +1, não. Assim, a forma de ressonância 5 é mais estável que a forma de ressonância 4.
Rule 2:
All else being equal, a resonance form that has a formal negative charge on a more electronegative atom is more stable than one that has a formal negative charge on a less electronegative atom. exemplo:
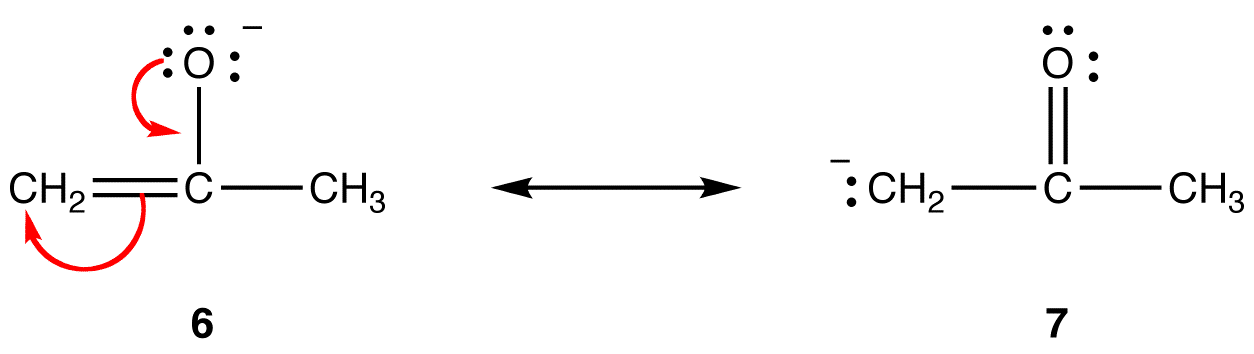
na forma de ressonância 6, a carga negativa formal está em um átomo de oxigênio; em 7, está em um átomo de carbono. O oxigênio é mais eletronegativo que o carbono. Assim, a forma de ressonância 6 é mais estável que a forma de ressonância 7.
a tendência é oposta no que diz respeito aos encargos formais positivos. Sendo tudo o resto igual, uma forma de ressonância que tem uma carga positiva formal sobre um átomo menos eletronegativo é mais estável do que uma que tem uma carga positiva formal sobre um átomo mais eletronegativo. exemplo:
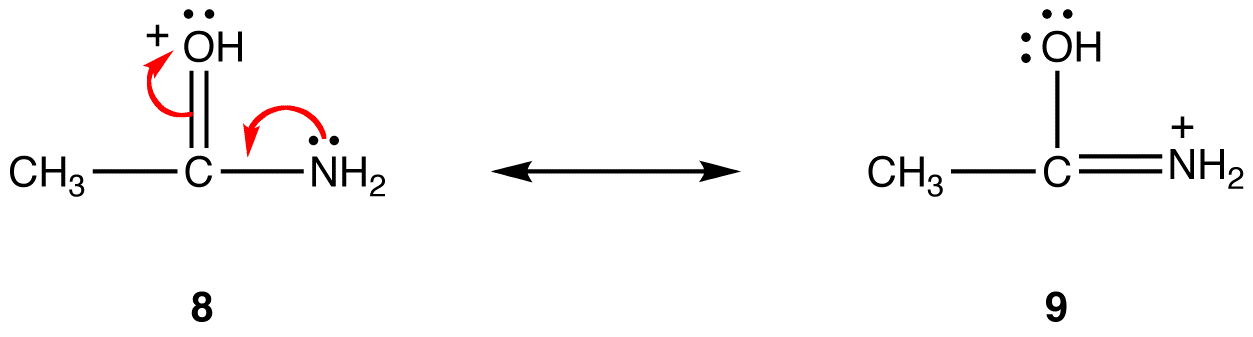
na forma de ressonância 8, a carga positiva formal é sobre um átomo de oxigênio; em 9, é sobre um átomo de nitrogênio. O nitrogênio é menos eletronegativo que o oxigênio, assim, a forma de ressonância 9 é mais estável que a forma de ressonância 8.
Rule 3:
All else being equal, a resonance form that does not have a charge separation, called a dipolar resonance form, is more stable than one that does. eg:
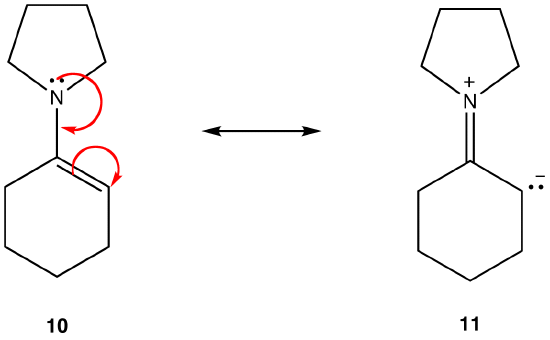
a forma de ressonância 11 é uma forma de ressonância dipolar; 10 não é. Assim, 10 é mais estável que 11. Esta regra é uma consequência da forma vetorial da lei de Coloumb, de acordo com a qual cargas opostas atraem. O corolário é que, para manter cargas opostas separadas, a energia é necessária, o que significa que 11 tem mais energia do que 10, então 10 é mais estável do que 11.
Regra 4:
em formas de ressonância dipolar, tudo o resto sendo igual,quanto maior a distância entre cargas separadas, mais estável a forma de ressonância. eg:
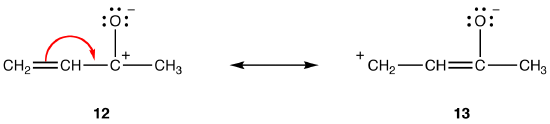
ambas as formas de ressonância 12 e 13 são formas de ressonância dipolar. A distância entre as cargas separadas é maior em 13 (três ligações) do que em 12 (uma ligação), por isso 13 é mais estável do que 12. Esta regra é uma consequência da forma escalar da lei de Coloumb, que afirma que a força atrativa entre cargas opostas é inversamente proporcional ao quadrado da distância entre elas. Assim, a energia necessária para manter as cargas opostas separadas em 12 é maior do que em 13, o que significa que 12 tem mais energia do que 13, por isso 13 é mais estável do que 12.
as regras acima podem não se aplicar à ressonância envolvendo elementos do período três e abaixo, devido à sua capacidade de acomodar mais de oito elétrons na camada de Valência. eg:
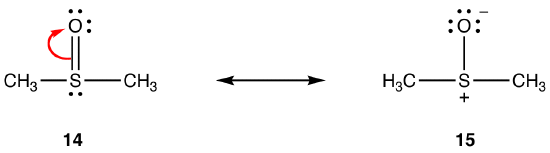
a ligação dupla em 14 consiste de uma ligação sigma e uma ligação formada pela sobreposição de uma orbital de 2p, com dois elétrons, no átomo de oxigênio e uma orbital 3d vazia no átomo de enxofre. Estes dois orbitais têm energias, tamanhos e formas muito diferentes, então a sobreposição entre eles, conhecida como uma interação pn–dn, é fraca. Consequentemente, há pouco caráter de ligação dupla na ligação enxofre-oxigênio no híbrido, isto é, 15 é a principal forma de ressonância.
contribuidores e atribuições
- Gamini Gunawardena do local OChemPal (Universidade do Vale do Utah)