objectivos de aprendizagem
no final desta secção, poderá:
- examinar a transferência de calor.calcular a temperatura final a partir da transferência de calor.
até agora temos discutido a mudança de temperatura devido à transferência de calor. Nenhuma mudança de temperatura ocorre a partir da transferência de calor se o gelo derrete e se torna água líquida (isto é, durante uma mudança de fase). Por exemplo, considere a água pingar de gelo derretendo em um telhado aquecido pelo sol. Inversamente, a água congela num tabuleiro de gelo arrefecido por um ambiente de baixa temperatura.

Figura 1. O calor do ar transfere-se para o gelo, fazendo-o derreter. (crédito: Mike Brand)
energia é necessária para derreter um sólido porque as ligações coesas entre as moléculas do sólido devem ser quebradas de tal forma que, no líquido, as moléculas podem mover-se em torno de energias cinéticas comparáveis; assim, não há aumento de temperatura. Da mesma forma, a energia é necessária para vaporizar um líquido, porque as moléculas de um líquido interagem entre si através de forças atraentes. Não há mudança de temperatura até que uma mudança de fase esteja completa. A temperatura de um copo de soda inicialmente a 0ºC permanece a 0ºC até todo o gelo derreter. Inversamente, a energia é liberada durante a congelação e condensação, geralmente na forma de energia térmica. O trabalho é feito por forças coesas quando as moléculas são reunidas. A energia correspondente deve ser libertada (dissipada) para que possam permanecer juntas na Figura 2.
A energia envolvida numa mudança de fase depende de dois factores principais: o número e a resistência de ligações ou pares de forças. O número de ligações é proporcional ao número de moléculas e, portanto, à massa da amostra. A força das forças depende do tipo de moléculas. O calor Q necessária para alterar a fase de uma amostra de massa m é dada por
Q = mLf (ponto de fusão/congelação,
Q = fornecedor multilíngue (vaporização/condensação),
, onde o calor latente de fusão Lf, e o calor latente de vaporização, Lv, são constantes de materiais que são determinados experimentalmente. Ver Quadro 1.

Figura 2. (A) A energia é necessária para superar parcialmente as forças atrativas entre moléculas em um sólido para formar um líquido. Essa mesma energia deve ser removida para que a congelação ocorra. B) As moléculas são separadas por grandes distâncias quando vão de líquido a vapor, necessitando de energia significativa para superar a atração molecular. A mesma energia deve ser removida para a condensação ocorrer. Não há mudança de temperatura até que uma mudança de fase esteja completa.o calor latente é medido em unidades de J/kg. Tanto a Lf como a Lv dependem da substância, em especial da força das suas forças moleculares, como referido anteriormente. Lf e Lv são coletivamente chamados coeficientes de calor latentes. Eles são latentes, ou ocultos, porque em mudanças de fase, a energia entra ou sai de um sistema sem causar uma mudança de temperatura no sistema; então, com efeito, a energia é escondida. O quadro 1 apresenta os valores representativos do Lf e do Lv, bem como os pontos de fusão e de ebulição.a tabela mostra que quantidades significativas de energia estão envolvidas em mudanças de fase. Vejamos, por exemplo, quanta energia é necessária para derreter um quilograma de gelo a 0ºC para produzir um quilograma de água a 0°C. Usando a equação para uma mudança de temperatura e o valor da água do Quadro 1, descobrimos que Q = mLf = (1.0 kg) (334 kJ / kg) = 334 kJ é a energia para derreter um quilograma de gelo. Esta é uma grande quantidade de energia, pois representa a mesma quantidade de energia necessária para elevar a temperatura de 1 kg de água líquida de 0ºC para 79,8 ºC. Ainda mais energia é necessária para vaporizar a água; seria necessário 2256 kJ para mudar 1 kg de água líquida no ponto de ebulição normal (100ºC à pressão atmosférica) para vapor (vapor de água). Este exemplo mostra que a energia para uma mudança de fase é enorme em comparação com a energia associada a mudanças de temperatura sem uma mudança de fase.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Tomemos, por exemplo, o fato de que as temperaturas do ar em climas húmidos raramente vão acima de 35,0 ºC, que é porque a maior parte da transferência de calor vai para a água evaporada no ar. Da mesma forma, as temperaturas em tempo úmido raramente caem abaixo do ponto de orvalho porque um calor enorme é liberado quando o vapor de água condensa.examinamos mais precisamente os efeitos da mudança de fase, considerando a adição de calor numa amostra de gelo a −20ºC (Figura 3). A temperatura do gelo sobe linearmente, absorvendo calor a uma taxa constante de 0,50 cal / g⋅ºC até atingir 0ºC. Uma vez a esta temperatura, o gelo começa a derreter até que todo o gelo tenha derretido, absorvendo 79,8 cal/g de calor. A temperatura permanece constante a 0ºC durante esta mudança de fase. Uma vez que todo o gelo derreteu, a temperatura da água líquida sobe, absorvendo calor a uma nova taxa constante de 1,00 cal/g⋅ºC. A 100ºC, a água começa a ferver e a temperatura permanece constante, enquanto a água absorve 539 cal/g de calor durante esta mudança de fase. Quando todo o líquido se tornou vapor, a temperatura sobe novamente, absorvendo calor a uma taxa de 0,482 cal / g⋅ºC.
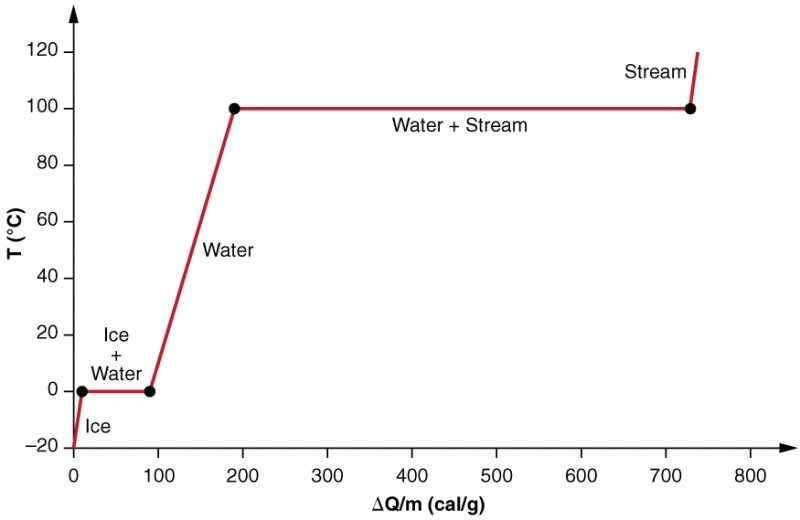
Figura 3. Um gráfico de temperatura versus energia adicionado. O sistema é construído de modo que nenhum vapor evapora enquanto o gelo aquece para se tornar água líquida, e de modo que, quando a vaporização ocorre, o vapor permanece no sistema. Os longos períodos de valores de temperatura constante a 0ºC e 100ºC refletem o grande calor latente de fusão e vaporização, respectivamente.a água pode evaporar a temperaturas abaixo do ponto de ebulição. É necessária mais energia do que no ponto de ebulição, porque a energia cinética das moléculas de água a temperaturas inferiores a 100ºC é menor do que a 100ºC, pelo que a energia disponível a partir de movimentos térmicos aleatórios é menor. Tomemos, por exemplo, o fato de que, à temperatura corporal, a transpiração da pele requer uma entrada de calor de 2428 kJ/kg, que é cerca de 10% maior do que o calor latente de vaporização a 100ºC. Este calor vem da pele, e assim fornece um mecanismo de resfriamento eficaz em tempo quente. A alta umidade inibe a evaporação, de modo que a temperatura do corpo pode subir, deixando suor não revaporado na testa.
exemplo 1. Calcular a temperatura Final a partir da mudança de fase: arrefecimento da Soda com cubos de gelo
são utilizados três cubos de gelo para arrefecer uma soda a 20ºC com massa de msoda = 0, 25 kg. O gelo está a 0ºC e cada cubo de gelo tem uma massa de 6,0 G. suponha que o refrigerante é mantido num recipiente de espuma para que a perda de calor possa ser ignorada. Suponha que a gasosa tem a mesma capacidade térmica que a água. Encontre a temperatura final quando todo o gelo derreter.os cubos de gelo estão à temperatura de fusão de 0ºC. O calor é transferido do refrigerante para o gelo para derreter. O derretimento do gelo ocorre em dois passos: primeiro, a mudança de fase ocorre e sólido (gelo) se transforma em água líquida à temperatura de fusão, em seguida, a temperatura desta água sobe. O derretimento produz água a 0ºC, por isso mais calor é transferido da soda para esta água até que a água Mais sistema de soda atinja o equilíbrio térmico, Qice = − Qsoda.
O calor transferido para o gelo é
Qice = mice = mice Lf + micecW(Tf−0ºC).
O calor emitido pela soda é Qsoda = msodacW (Tf−20ºC). Como não se perde calor, Qice=−Qsoda, de modo que
mice Lf + micecW(Tf –0ºC) = −msodacW(Tf-20ºC).
Bring all terms involving Tf on the left-hand-side and all other terms on the right-hand-side. Resolver para a quantidade desconhecida Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Solução
- Identificar as quantidades conhecidas. A massa de gelo é de ratos = 3 × 6,0 g = 0,018 kg e a massa de refrigerante é de msoda = 0,25 kg.
- Calcular os termos no numerador: m sodacW(20ºC)=(0,25 kg)(4186 J/kg ⋅ ºC)(20ºC) = 20,930 J e miceLf = (0.018 kg)(334,000 J/kg) = 6012 J.
- Calcular o denominador: (msoda + ratos)cW = (0,25 kg + 0.018 kg) (4186 K/(kg⋅ºC) = 1122 J / ºC.
- Calcular a temperatura final: \displaystyle{T}_{\text{f}}=\frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Discussão
Este exemplo ilustra o enorme energias envolvidas durante uma mudança de fase. A massa de gelo é de cerca de 7 por cento da massa de água, mas leva a uma mudança notável na temperatura dos refrigerantes. Embora tenhamos assumido que o gelo estava à temperatura de congelação, isso é incorreto: a temperatura típica é −6ºC. No entanto, esta correção dá uma temperatura final que é essencialmente idêntica ao resultado que encontramos. Pode explicar porquê?

Figura 4. Condensação num copo de chá gelado. (crédito: Jenny Downing)
vimos que a vaporização requer transferência de calor para um líquido do ambiente, de modo que a energia é libertada pelo ambiente. Condensação é o processo inverso, aumentando a temperatura do entorno. Este aumento pode parecer surpreendente, uma vez que associamos condensação com objetos frios—o vidro na figura, por exemplo. No entanto, a energia deve ser removida das moléculas de condensação para fazer um condensador de vapor. A energia é exatamente a mesma que é necessária para fazer a mudança de fase na outra direção, de líquido para vapor, e assim pode ser calculada a partir de Q = mLv.
forma-se condensação na Figura 4 porque a temperatura do ar próximo é reduzida para abaixo do ponto de orvalho. O ar não pode conter tanta água como a temperatura ambiente, e assim a água condensa. A energia é libertada quando a água condensa, acelerando o derretimento do gelo no vidro.
Real-World Application
Energy is also released when a liquid freezes. Este fenômeno é usado pelos produtores de frutas na Flórida para proteger laranjas quando a temperatura está próxima ao ponto de congelamento (0ºC). Os produtores pulverizam água nas plantas em pomares para que a água congele e o calor é liberado para as laranjas em crescimento nas árvores. Isto evita que a temperatura dentro da laranja caia abaixo do congelamento, o que danificaria a fruta.

figura 14.11. O gelo nestas árvores libertava grandes quantidades de energia quando congelava, ajudando a evitar que a temperatura das árvores descesse abaixo dos 0ºC. A água é intencionalmente pulverizada em pomares para ajudar a evitar geadas duras. sublimação é a transição da fase sólida para a fase vapor. Você pode ter notado que a neve pode desaparecer no ar sem um traço de água líquida, ou o desaparecimento de cubos de gelo em um congelador. O inverso também é verdadeiro: a geada pode formar-se em janelas muito frias sem passar pelo estágio líquido. Um efeito popular é a produção de” fumaça ” a partir de gelo seco, que é dióxido de carbono sólido. A sublimação ocorre porque a pressão de vapor de equilíbrio dos sólidos não é zero. Alguns Ambientadores usam a sublimação de um sólido para injectar um perfume na sala. As bolas de mariposa são um exemplo ligeiramente tóxico de um fenol (um composto orgânico) que sublima, enquanto alguns sólidos, como o tetroxide de ósmio, são tão tóxicos que eles devem ser mantidos em recipientes selados para evitar a exposição humana a seus vapores produzidos por sublimação.

Figura 5. Transições diretas entre sólido e vapor são comuns, às vezes úteis, e até mesmo bonitas. a) o gelo seco sublima directamente para o gás dióxido de carbono. O vapor visível é feito de gotículas de água. (crédito: Windell Oskay) (B) geada forma padrões em uma janela muito fria, um exemplo de um sólido formado diretamente a partir de um vapor. (crédito: Liz West)
Todas as transições de fase envolvem calor. In the case of direct solid-vapor transitions, the energy required is given by the equation Q = mLs, where Ls is the heat of sublimation, which is the energy required to change 1.100 kg de uma substância da fase sólida à fase vapor. Ls é análogo ao Lf e Lv, e seu valor depende da substância. A sublimação requer entrada de energia, de modo que o gelo seco é um refrigerante eficaz, enquanto o processo inverso (i.e., cobertura) libera energia. A quantidade de energia necessária para a sublimação é da mesma ordem de magnitude que para outras transições de fase.
O material apresentado nesta secção e na secção anterior permite-nos calcular qualquer número de efeitos relacionados com a temperatura e a mudança de fase. Em cada caso, é necessário identificar quais as mudanças de temperatura e fase que estão ocorrendo e, em seguida, aplicar a equação apropriada. Tenha em mente que a transferência de calor e trabalho pode causar mudanças de temperatura e de fase.
estratégias de resolução de problemas para os efeitos da transferência de calor
- Examine a situação para determinar que há uma mudança na temperatura ou fase. Há transferência de calor dentro ou fora do sistema? Quando a presença ou ausência de uma mudança de fase não é óbvia, você pode querer primeiro resolver o problema como se não houvesse mudanças de fase, e examinar a mudança de temperatura obtida. Se for suficiente para levar você além de um ponto de ebulição ou fusão, você deve então voltar e fazer o problema em passos—mudança de temperatura, mudança de fase, mudança de temperatura subsequente, e assim por diante.identificar e listar todos os objetos que mudam a temperatura e a fase.
- identificar exatamente o que precisa ser determinado no problema (identificar as incógnitas). Uma lista escrita é útil.
- Faça uma lista do que é dado ou o que pode ser inferido a partir do problema como indicado (identificar os knowns).
- resolve a equação apropriada para a quantidade a ser determinada (o desconhecido). Se houver uma mudança de temperatura, o calor transferido depende do calor específico (Ver Tabela 1 Em Mudança de temperatura e capacidade de calor) enquanto, para uma mudança de fase, o calor transferido depende do calor latente. Ver Quadro 1.
- substitua os conhecimentos, juntamente com as suas unidades, pela equação apropriada e obtenha soluções numéricas completas com as unidades. Você terá que fazer isso em etapas se houver mais de uma etapa para o processo (como uma mudança de temperatura seguida por uma mudança de fase).Verifique a resposta para ver se é razoável: faz sentido? Como exemplo, esteja certo de que a mudança de temperatura também não causa uma mudança de fase que você não tenha levado em conta.porque é que a neve permanece nas encostas das montanhas mesmo quando as temperaturas diurnas são mais elevadas do que a temperatura de congelação?
solução
neve é formada a partir de cristais de gelo e, portanto, é a fase sólida da água. Uma vez que é necessário um calor enorme para as mudanças de fase, é preciso um certo tempo para que este calor seja acumulado a partir do ar, mesmo que o ar esteja acima de 0ºC. Quanto mais quente o ar é, mais rápido esta troca de calor ocorre e mais rápido a neve derrete.
Resumo da secção
- A maioria das substâncias pode existir quer nas formas sólida, líquida e gasosa, que são referidas como “fases”.”
- mudanças de fase ocorrem a temperaturas fixas para uma dada substância a uma dada pressão, e estas temperaturas são chamadas de ponto de ebulição e congelação (ou fusão).durante as alterações de fase, o calor absorvido ou libertado é dado por: Q = mL, em que L é o coeficiente de calor latente.
questões conceptuais
- a transferência de calor pode causar mudanças de temperatura e de fase. O que mais pode causar estas mudanças?como é que o calor latente da fusão da água ajuda a abrandar a diminuição das temperaturas do ar, talvez impedindo que as temperaturas caiam significativamente abaixo de ºC, nas proximidades de grandes massas de água?Qual é a temperatura do gelo logo após ser formado por água gelada?se colocar gelo em água num recipiente isolado, o que vai acontecer? Um pouco de gelo derreterá, mais água congelará, ou nenhum deles terá lugar?que efeito tem a condensação num copo de água gelada na velocidade a que o gelo derrete? A condensação acelerará o processo de fusão ou atrasá-lo-á?em climas muito húmidos, onde existem numerosas massas de água, como na Flórida, é incomum que as temperaturas subam acima de cerca de 35ºC (95ºF). Nos desertos, no entanto, as temperaturas podem subir muito acima disso. Explique como a evaporação da água ajuda a limitar as altas temperaturas em climas húmidos.nos invernos, é frequentemente mais quente em São Francisco do que em Sacramento, 150 km para o interior. No verão, é quase sempre mais quente em Sacramento. Explique como as massas de água em torno de São Francisco moderam suas temperaturas extremas.colocar uma tampa num vaso a ferver reduz grandemente a transferência de calor necessária para mantê-lo a ferver. Explicar.os alimentos liofilizados foram desidratados no vácuo. Durante o processo, o alimento congela e deve ser aquecido para facilitar a desidratação. Explique como o vácuo acelera a desidratação e porque a comida congela como resultado.quando o ar ainda arrefece por irradiar à noite, é incomum que as temperaturas caiam abaixo do ponto de orvalho. Explicar.numa demonstração de física em sala de aula, um instrutor inflama um balão por boca e depois arrefece-o em nitrogénio líquido. Quando frio, o balão encolhido tem uma pequena quantidade de líquido azul claro nele, bem como alguns cristais tipo neve. À medida que aquece, o líquido ferve, e parte dos cristais sublimam, com alguns cristais permanecendo por algum tempo e, em seguida, produzindo um líquido. Identifique o líquido azul e os dois sólidos no balão frio. Justificar as suas identificações utilizando dados da Tabela 1.
Problemas & Exercícios
- Quanto a transferência de calor (em kcal) é necessário para descongelar um 0.450 kg pacote de legumes congelados originalmente a 0º c, se o seu calor de fusão é a mesma que a da água?um saco contendo gelo de 0ºC é muito mais eficaz na absorção de energia do que um saco contendo a mesma quantidade de água de 0ºC. (a) QUANTA transferência de calor é necessária para elevar a temperatura de 0,800 kg de água de 0ºC para 30,0 ºC? (b) quanta transferência de calor é necessária para derreter primeiro 0.800 kg de gelo 0ºC e depois aumentar a temperatura? (C) explique como sua resposta apoia a afirmação de que o gelo é mais eficaz.
- (a) QUANTA transferência de calor é necessária para aumentar a temperatura de um pote de alumínio de 0,750 kg contendo 2,50 kg de água de 30,0 ºC até ao ponto de ebulição e, em seguida, ferver 0,750 kg de água? b) Quanto tempo demora esta transferência se a velocidade de transferência de calor for de 500 W 1 watt = 1 joule/segundo (1 W = 1 J/s)?a formação de condensação em um copo de água gelada faz com que o gelo derreta mais rápido do que de outra forma. Se 8.00 g de condensação forma-se em um vidro contendo água e 200 g de gelo, quantos gramas de gelo derreterão como resultado? Suponha que não ocorre outra transferência de calor.numa viagem, nota-se que um saco de gelo de 3,50 kg dura, em média, um dia no frigorífico. Qual é a potência média em watts entrando no gelo se ele começa a 0ºC e derrete completamente a 0ºC água em exatamente um dia 1 watt = 1 joule/segundo (1 W = 1 J / s)?num determinado dia seco e ensolarado, a temperatura da piscina aumentaria 1,50 ºC se não fosse por evaporação. Que fracção da água deve evaporar para transportar precisamente energia suficiente para manter a temperatura constante?a) QUANTA transferência de calor é necessária para aumentar a temperatura de um pedaço de gelo de -20,0 ºC para 130 ºC, incluindo a energia necessária para mudanças de fase? (b) Quanto tempo é necessário para cada etapa, assumindo uma taxa constante de transferência de calor de 20,0 kJ/s? (c) faça um gráfico de temperatura versus tempo para este processo.em 1986, um iceberg gigantesco partiu da plataforma de Gelo Ross na Antártica. Era aproximadamente um retângulo de 160 km de comprimento, 40.0 km de largura e 250 m de espessura. a) qual é a massa deste iceberg, dado que a densidade do gelo é de 917 kg / m3? b) quanta transferência de calor (em joules) é necessária para a derreter? c) quantos anos levaria apenas a luz solar para derreter gelo desta espessura, se o gelo absorvesse uma média de 100 W/m2, 12.00 h por dia?quantos gramas de café devem evaporar de 350 g de café num copo de 100 g para arrefecer o café de 95,0 ° C a 45,0 ° C? Você pode assumir que o café tem as mesmas propriedades térmicas que a água e que o calor médio de vaporização é 2340 kJ/kg (560 cal/g). (Você pode negligenciar a mudança na massa do café como ele arrefece, o que lhe dará uma resposta que é ligeiramente maior do que correto.)
- um cubo de gelo de 0, 0500 kg a -30, 0 ºC é colocado em 0, 400 kg de água de 35, 0 ºC num recipiente muito bem isolado. Qual é a temperatura final?se despejar 0,0100 kg de água 20,0 ºC num bloco de gelo de 1,20 kg (inicialmente a -15,0 ºC), Qual é a temperatura final? Você pode assumir que a água arrefece tão rapidamente que os efeitos do ambiente são negligenciáveis.os povos indígenas às vezes cozinham em cestas estanques colocando pedras quentes na água para fervê-la. Que massa de rocha de 500ºC deve ser colocada em 4,00 kg de água de 15,0 ºC para levar a sua temperatura a 100ºC, se 0,0250 kg de água escapar como vapor do sizle inicial? Você pode negligenciar os efeitos do ambiente e tomar o calor específico médio das rochas para ser o de granito.
- Qual seria a temperatura final do pan de água e Calcular a Temperatura Final, Quando o Calor É Transferido Entre Dois Corpos: Vazamento de Água Fria em uma Panela Quente se 0.260 kg de água foi colocado na panela e 0.0100 kg de água evaporada, imediatamente, deixando o restante para chegar a uma temperatura comuns com o pan?em alguns países, o nitrogênio líquido é usado em caminhões de leite em vez de refrigeradores mecânicos. A 3.A viagem de entrega de 00 horas Requer 200 L de nitrogênio líquido, que tem uma densidade de 808 kg/m3. a) calcular a transferência de calor necessária para evaporar esta quantidade de azoto líquido e elevar a sua temperatura para 3,00 ºC. (Use cp e assuma que é constante ao longo da faixa de temperatura.) Este valor é a quantidade de resfriamento das fontes de nitrogênio líquido. b) Qual é a taxa de transferência de calor em quilowatts-hora? C) comparar a quantidade de arrefecimento obtida por fusão de uma massa idêntica de gelo de 0ºC com a da evaporação do azoto líquido.alguns fãs de armas fazem suas próprias balas, O que envolve derreter e fundir as lesmas de chumbo. Quanta transferência de calor é necessária para aumentar a temperatura e derreter 0,500 kg de chumbo, a partir de 25,0 ºC?coeficiente de calor latente: uma constante física igual à quantidade de calor transferida para cada 1 kg de uma substância durante a mudança de fase da substância sublimação: the transition from the solid phase to the vapor phase
Selected Solutions to Problems & Exercises
1. 35, 9 kcal
3. a) 591 kcal; B) 4.94 × 103 s
5. 13, 5 W
7. (a) 148 kcal; (b) 0, 418 s, 3, 34 S, 4, 19 S, 22, 6 s, 0, 456 s
9. 33, 0 g
10. a) 9,67 L; B) O petróleo bruto é menos denso que a água, pelo que flutua sobre a água, expondo-a assim ao oxigénio no ar, que utiliza para queimar. Além disso, se a água está sob o óleo, é menos eficiente na absorção do calor gerado pelo óleo.12. a) 319 kcal; (b) 2, 00 ºC
14. 20, 6 ºC
16. 4, 38 kg
18. (a) 1.57 × 104 kcal; (B) 18.3 kW kW h; (c) 1.29 × 104 kcal
- valores cotados à fusão normal e à temperatura de ebulição à pressão atmosférica normal (1 atm). ↵
- 37,0 ºC (temperatura do corpo), o calor de vaporização Lv para a água é de 2430 kJ/kg ou 580 kcal/kg ↵
- 37,0 ºC (temperatura do corpo), o calor de vaporização Lv para a água é de 2430 kJ/kg ou 580 kcal/kg ↵
(A) é difícil extinguir um incêndio em um petroleiro de petróleo bruto, porque cada litro de petróleo bruto libera 2,80 × 107 J de energia quando queimado. Para ilustrar esta dificuldade, calcule o número de litros de água que deve ser gasto para absorver a energia libertada pela queima de 1,00 L de petróleo bruto, se a água tem a sua temperatura elevada de 20,0 ºC para 100ºC, ferve, e o vapor resultante é elevado para 300ºC. B) discutir as complicações adicionais causadas pelo facto de o petróleo bruto ter uma densidade inferior à da água.a energia libertada pela condensação em trovoadas pode ser muito grande. Calcule a energia libertada na atmosfera para uma pequena tempestade de raio de 1 km, assumindo que 1,0 cm de chuva é precipitado uniformemente sobre esta área.para ajudar a prevenir danos causados pela geada, são pulverizados 4,00 kg de água de 0ºC numa árvore de fruto. a) QUANTA transferência de calor ocorre à medida que a água congela? b) Quanto diminuiria a temperatura da árvore de 200 kg se esta quantidade de calor transferida da árvore? Leve o calor específico para 3,35 kJ / kg * ºC, e assuma que não ocorre alteração de fase.uma tigela de alumínio de 0,250 kg com 0,800 kg de sopa a 25,0 ºC é colocada num congelador. Qual é a temperatura final se 377 kJ de energia é transferida da tigela e da sopa, assumindo que as propriedades térmicas da sopa são as mesmas que a da água?