A Microbial Biorealm page on the genus Enterococcus faecalis
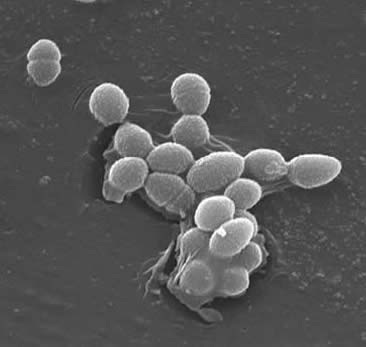
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Espécie
Enterococcus faecalis
Descrição e significado
os Enterococos são cocos Gram-positivos que podem sobreviver a condições adversas de natureza. Eles podem ser encontrados no solo, água e plantas. Algumas estirpes são usadas no fabrico de alimentos, enquanto outras são a causa de infecções humanas e animais graves (por exemplo, eles são conhecidos por colonizar os tractos gastrointestinal e genital dos seres humanos). Eles estão associados com infecções adquiridas tanto pela comunidade quanto pelo hospital. Enterococci pode crescer a uma temperatura de 10 a 42 ° C e em ambientes com valores de pH amplos. Alguns são conhecidos por serem móveis. Enquanto existem mais de 15 espécies do gênero Enterococcus, 80-90% dos isolados clínicos são E. faecalis (8). Os Enterococci normalmente formam cadeias curtas ou são dispostos em pares. No entanto, sob certas condições de crescimento, eles alongam e parecem cocobacilares. Em geral,os enterococos são alfa-hemolíticos. Alguns possuem o antigénio Lancefield do Grupo D e podem ser detectados utilizando testes de aglutinação monoclonal à base de anticorpos.Enterococci são tipicamente catalase negativa, e são anaeróbicos. Eles são capazes de crescer em 6,5% NaCl, podem hidrolizar esculina na presença de 40% de sais biliares e são pirrolidonil arilamidase e leucina arilamidase positivo (8). Enterococci provou apresentar um desafio terapêutico por causa de sua resistência a muitas drogas antimicrobianas, “incluindo agentes ativos da parede celular; aminoglicosidos, penicilina e ampicilina, e vancomicina” (1). O Enterococci tem a capacidade de adquirir uma grande variedade de fatores de resistência antimicrobiana, que apresentam problemas graves no tratamento de pacientes com infecções enterocócicas (8). Em geral, isolados enterocócicos com susceptibilidade reduzida à vancomicina podem ser categorizados como vanA, vanB e vanC. vanA e vanB representam a maior ameaça porque são os mais resistentes e os genes de resistência são transportados em um plasmídeo. Uma vez que os genes de resistência são transportados num plasmídeo, são facilmente transferíveis, E. fecalis pode transferir estes plasmídeos por conjugação (2). E. as fezes também são resistentes à teicoplanina. Foram encontradas estirpes enterocócicas dependentes da vancomicina, mas raras e menos comuns do que estirpes resistentes à vancomicina (referidas como “Enterococci resistente à vancomicina” ou “VRE”) (1).
Genoma estrutura

devido a muitos perigos para a saúde pública, the genome sequence data from a strain of Enterococcus was necessary. A estirpe escolhida para a sequenciação do ADN do genoma foi E. faecalis V583, o primeiro isolado resistente à vancomicina nos Estados Unidos. O genoma da estirpe V583 foi sequenciado pelo Institute for Genome Research (TIGR). O genoma enterocócico mostra que o e. fecalis é metabolicamente diverso e contém uma ampla gama de sistemas regulatórios. A estirpe V583 contém quatro moléculas de ADN: o principal cromossoma bacteriano do par base 3,218,030 e três plasmídeos circulares. O cromossomo contém cerca de 3.500 quadros de leitura aberta( ORFs), cerca de 1/3 destes ORFs não têm função atribuível (8). Os três plasmídeos são moléculas circulares de DNA identificadas como plasmídeo-1, plasmídeo-2 e plasmídeo-3. O Plasmid – 1 contém 66.320 bp, o Plasmid-2 contém 17.963 bp e o Plasmid-3 contém 57.660 bp. Os plasmídeos codificam uma série de genes, incluindo transposases, proteínas de Resistência a múltiplos fármacos, e um inibidor de crescimento regulado pela ppGpp (8). A composição média G+C do cromossoma E. fecalis é de 37,38%. Como a molécula de ADN é tão grande, ocorrem desvios regionais da média. Um desses locais é o grande segmento associado com o” cluster de resistência à vancomicina posicionado perto de 2,22 Mb”, mostrando um grande aumento em percentagem de conteúdo G+C (8). Estas diferenças associadas à resistência aos antibióticos ou à virulência sugeriram a aquisição de material genético de uma espécie estrangeira através da transferência horizontal. Ainda não se sabe se as transferências são responsáveis pelas variações na composição do DNA. A informação contida no genoma de E. fecalis V583 irá ajudar grandemente a compreensão de como o organismo se adaptou para ser um patógeno humano versátil. Utilizando a genómica comparativa, o papel dos diferentes elementos regulamentares será melhor compreendido na forma como respondem a vários factores ambientais e na expressão de potenciais factores de virulência (8). Mais estudos como estes irão sugerir novos medicamentos para infecções bacterianas causadas pelo Enterococci.O genoma também contém 3 operões Ebp (codificação para a endocardite pili associada a biofilm) que são importantes para a produção de biofilm da estirpe OG1RF E. faecalis. Esta estirpe usa estes operões para produzir pili de superfície. . A pili superficial é usada para “fixação às superfícies hospedeiras e são antigênicas no ser humano durante a endocardite” (9).
O TIGR contém uma lista completa de genes para os cromossomas E. fecalis.
estrutura celular e metabolismo
metabolismo celular
os enterococos habitam ambientes ásperos, como os tractos intestinais de seres humanos e animais. O crescimento nestas condições hostis requer que E. fecalis tenha um metabolismo flexível. E. faecalis são capazes não apenas de fermentação para a produção de ácido láctico, mas também pode “catabolizar um espectro de fontes de energia a partir de carboidratos, glicerol, lactato, malato, citrato, diamino ácidos e manya-ceto ácidos” (3).Tem sido demonstrado que, sob selecionadas as condições de crescimento de E. faecalis pode aumentar o crescimento através da fosforilação oxidativa utilizando um próton motivo de força estabelecidas pelo transporte de elétrons. Uma consequência da” respiração Nascente é a produção de oxidantes potentes ” (por exemplo, superóxido e peróxido de hidrogénio), stress oxidativo que a E. fecalis pode tolerar (3). A tolerância a este estresse, combinada com outras condições graves de crescimento, permite que a E. fecalis cresça de 10 a 45°C, em sais biliares, e em pHs extremamente baixo e alto. Além disso, E. fecalis pode resistir a azida, detergentes, metais pesados e etanol. Uma vez que E. fecalis pode utilizar diversas fontes de açúcar, pode viver em diversos ambientes, especialmente no intestino, onde os nutrientes são limitados (2). No intestino, E. fecalis obtém a maior parte da sua energia da fermentação de açúcares não absorvidos. E. faecalis também pode obter energia por degradação de mucinas, um hidrato de carbono que é fortemente glicosilado e produzido por células de cálice intestinal (2).A E. faecalis utiliza um “sistema fosfoenolipiruvato fosfotransferase (PTS) para detectar açúcares fora da célula e a absorção de açúcares por casais com fosforilação” (2). Ao fazê-lo, menos energia (ATP) é desperdiçada em comparação com a forma como o açúcar é acumulado por sistemas não PTS. Os açúcares metabolizados por E. fecalis incluem: D-glicose, D-frutose, lactose, maltose (todos os substratos PTS). No Enterococci, o PTS também regula o metabolismo do glicerol, a expulsão dos indutores e a repressão à catabolite (8). E. fecalis é uma das poucas bactérias G+C de baixo teor em Gram-positivo que expelem o açúcar durante o crescimento da glicose, um fenômeno conhecido como expulsão indutora (8). E. fecalis pode até fermentar glicerol em condições aeróbias e microaerofílicas. E. faecalis também pode crescer com glicerol em condições anaeróbicas porque “expressa um gene para a atividade anaeróbica de glicerol NAD+” (8). O glicerol pode atravessar a membrana celular usando uma proteína chamada facilitador de difusão do glicerol (GlpF). O GlpF torna a concentração de glicerol dentro e fora da célula igual, a proteína é inibida pela glicólise. E. fecalis são capazes de viver em pH alcalino extremo e alta concentração de sal. Estas características requerem transporte catiónico para manter a composição constante de iões citosólicos essencial para a homeostase. Todas as células devem expelir o excesso de sódio para manter concentrações citosólicas no intervalo que favorece a homeostase. E. faecalis expressa tanto um antiportador na+ / H + e uma ATPase tipo vacuolar (2). O potássio é um catião intracelular principal. A concentração de potássio dentro de E. fecalis de 0,4 a 0,6 M é essencial para o metabolismo celular normal, “neutraliza aniões intracelulares, ativa diversas enzimas, e regula o pH citosólico” (8). E. fecalis exprime pelo menos dois transportadores de potássio para executar a regulação, o KtrI e o Ktri, juntamente com o sistema Kep para a extrusão de K+ (8). Embora se saiba que o KtrI e o Ktri são sistemas de captação do K+ (eles são sympressers K+/H+), pouco mais se conhece as proteínas.
Estrutura celular
Enterococci São cocci Gram-positivos que tipicamente formam cadeias curtas ou são dispostos em pares (3). Sob certas condições de crescimento, podem alongar e parecer cocobacilares. A parede celular de E. fecalis é de 20 a 38% do peso da célula seca (nas células de fase exponencial e estacionária). Dado que a E. faecalis é uma bactéria Gram-positiva, existem três componentes principais que compõem a sua parede celular: peptidoglicano, ácido teicóico e polissacárido. 40% da parede celular é constituída por peptidoglicano, enquanto o resto da parede celular é constituído por um “polissacárido contendo ramnose e um ácido teicóico contendo ribitol” (3). O peptidioglicano funciona (como na maioria das células gram-positivas) para resistir à ruptura induzida pela alta pressão osmótica citoplásmica. E. fecalis é geralmente considerado um organismo não encapsulado, demonstrado pela” falta de um fenótipo mucóide detectável ” (3). No entanto, os subconjuntos de E. fecalis isolados possuem um polissacárido capsular. E. fecalis pode trocar material genético (plasmídeos) por processos de conjugação induzidos por pequenas feromonas péptidas (2). Substâncias de agregação da proteína de superfície que reconhecem um ligante específico nas células receptoras garantem conexões bem sucedidas para a conjugação (2).E. faecalis também tem a capacidade de fazer pili de superfície que pode levar à formação de um biofilme. As estirpes E. faecalis que causam endocardite contêm grandes quantidades destas pili. O pili permite a fixação de superfícies hospedeiras (por exemplo, o tecido do coração). As estirpes de E. as fezes que causam endocardite produzem o “biofilme significativamente mais frequentemente e também em maior grau do que os isolados não-endocardite” (9).
Ecologia
E. fecalis é uma espécie de enterococo muito diversificada. Interage com muitos outros organismos e tem efeitos no ambiente. Os Enterococci são membros da comunidade bacteriana que habita o intestino grosso em humanos. Eles também são uma parte natural da flora intestinal na maioria dos outros mamíferos e aves (8). Os enterococos também são encontrados no solo, plantas e água. Quando são encontrados na água é tipicamente porque a água tinha sido contaminada com matéria fecal. Embora a E. fecalis não apareça muitas vezes em plantas, outras estirpes de enterococos foram encontradas entre as plantas e é mais provável que o façam a uma fonte de água contaminada (8).A ecologia da resistência aos antibióticos e da transferência de genes de virulência no ambiente ainda não é bem compreendida. Insetos, como moscas-da-casa (HF), que se desenvolvem em material orgânico em decomposição podem transmitir bactérias resistentes aos antibióticos do estrume de animais e outros substratos orgânicos em decomposição para ambientes residenciais (7). Os HF são transmissores perfeitos devido às comunidades microbianas vivas presentes nos habitats onde se desenvolvem (por exemplo, fezes). A adição às boas qualidades de transferência é a forma como o HF alimenta os seus filhotes (regurgitação) e a sua atracção por alimentos humanos. Uma vez que HF pode voar longas distâncias, este inseto é muito bom para a propagação de bactérias fecais, incluindo patógenos humanos e animais, e possivelmente estirpes resistentes a antibióticos de enterococos (7). Um estudo recente mostrou resistência a antibióticos e genes de virulência em Enterocococos de HF em restaurantes de fast-food em Kanasas. Este estudo mostrou que” as moscas-da-casa no manuseio de alimentos e instalações de serviço podem transportar enterococos resistentes a antibióticos e potencialmente virulentos que têm a capacidade de transferência horizontal de genes de Resistência a antibióticos para outras bactérias ” (7).Os efeitos que E. fecalis tem no ambiente tendem a ser mais negativos. Eles tipicamente contaminam o abastecimento de água que pode levar a plantas infectadas, bem como infecções em pessoas (8). Os fatores antibióticos também podem ser transportados por vários insetos (por exemplo moscas da casa) e animais, levando a um número crescente de E. fecalis virulentos.
patologia
Enterococci surgiu como uma das principais causas de infecções nosocomiais, e dentro deste grupo Enterococcus faecalis causa a maioria das infecções enterocócicas humanas. Estas infecções podem ser locais ou sistemáticas e incluem infecções do tracto urinário e abdominais, infecções de feridas, bacteremia e endocardite (2). Uma vez que E. fecalis são capazes de sobreviver a inúmeros desafios ambientais (tais como temperaturas extremas e a presença de sais biliares) e porque eles podem adquirir resistência a múltiplos antibióticos, estas bactérias tornaram-se um grande problema de saúde. O Sistema Nacional de Vigilância das infecções nosocomiais (NNIS) tem relatado aumentos na incidência de infecções devidas a Enterocococos resistentes à vancomicina (VRE) desde 1989 (1). Isto pode significar sérios problemas de saúde, que incluem a falta de terapia antibiótica disponível para infecções VRE, porque a maioria das estirpes VRE abrigam resistência a múltiplos antibióticos além da vancomicina (por exemplo, aminogliscoides e ampicilina). A transferência de genes resistentes à vanocmicina do VRE para outros agentes patogénicos Gram-positivos constitui um grave problema de saúde pública. A maneira mais comum de A E. fecalis causar infecção ocorre em um hospital/unidade de cuidados de longo prazo é a transmissão de E. fecalis entre os pacientes (8). Enterococci pode ser transportado nas mãos de profissionais de saúde e ser transportado (transferido) de um paciente para outro. Foi demonstrado que o VRE nas mãos pode persistir por até 60 minutos (8). A transmissão das mãos de um trabalhador de saúde para o paciente pode ocorrer em contato com os cateteres intravenosos ou urinários do paciente. Termómetros rectais, não devidamente limpos após o uso, podem transmitir o VRE de paciente para paciente também. Às vezes, a transmissão pode resultar na colonização do trato gastrointestinal do paciente com a estirpe adquirida. A nova estirpe torna-se então parte da flora endógena do doente (8). A estirpe adquirida, transportando genes de Resistência a antibióticos, é capaz de viver no trato gastrointestinal. As infecções surgem então a partir destas estirpes recém-adquiridas E. fecalis.E. fecalis pode causar muitas infecções no corpo humano. A infecção mais comum causada pelo Enterococci é a infecção do tracto urinário. E. fecalis pode causar infecções do tracto urinário inferior( itu), tais como cistisis, prostatite e epididimite (8). E. fecalis também são encontrados em infecções intra-abdominais, pélvicas e dos tecidos moles. O E. fecalis pode causar bacteremia nosocomial. A fonte de bacteremia é, na maioria das vezes, o trato urinário, ocorrendo a partir de um cateter intravenoso infectado. A endocardite é a infecção enterocócica mais grave, uma vez que causa inflamação das válvulas cardíacas. Em muitos casos de endocardite, o tratamento com antibióticos falha e cirurgia para remover a válvula infectada é necessário (8). As infecções menos comuns causadas por E. fecalis incluem meningite, hematógena, osteomielite, artrite séptica e (muito raramente) pneumonia. Devido à resistência do Enterococci a muitos antibióticos, o tratamento destas infecções é difícil.
a aplicação à biotecnologia
Enterococci foi estudada para possível utilização como probiótico (um suplemento dietético que contém células microbianas vivas não virulentas que, quando ingeridas, se pensa que afectam beneficialmente a composição da microflora intestinal). A administração da estirpe E. faecalis demonstrou reduzir a diarreia. Os probióticos E. fecalis são usados na alimentação de galinhas/porcos/bovinos para diminuir a diarréia nos animais (8).devido à elevada doença causadora de propriedades da E. fecalis, foram realizadas muito mais pesquisas sobre como parar a virulência da E. fecalis do que o uso benéfico da E. fecalis.
investigação actual
1.) Esperança para infecções causadas por Enterococcus faecalis (4)
sabe-se que bactérias resistentes à vancomicina (por exemplo, E. fecalis) colocam muitos problemas à sociedade, causando infecções bacterianas em seres humanos que são difíceis de tratar. As infecções enterocócicas são um desafio porque os organismos têm a capacidade de rapidamente adquirir e disseminar genes de resistência. O ceftobiprol (BPR) foi utilizado como cefalosporina experimental contra cocci Gram-positivo. A BPR é uma cefalosporina parentérica de largo espectro com afinidades elevadas de proteínas Gram-positivas e Gram-negativas de ligação à penicilina. Também mostra estabilidade contra hidrólise Por β-lactamases.Este estudo examinou a atividade da BRP contra uma grande coleção de E. fecalis, olhando para a atividade bactericida BPR contra isolados resistentes à vancomicina. O estudo revelou que a BPR na E. fecalis não é afetada pela presença de resistência à vancomicina ou pela produção de β-lactamase. Nas estirpes de E. fecalis que mostraram resistência à vancomicina (fenótipos VanA e VanB) ou resistência à ampicilina, a BPR foi bactericida. Os investigadores mostraram que o BPR exibiu actividade bactericida contra a E. fecalis numa dose de 750 mg, inibindo 100% da actividade da E. fecalis. Embora a presença da enzima β-lactamase seja rara em E. fecalis, a sua presença compromete o uso das β-lactamas anti-enterocócicas mais eficazes (por exemplo, ampicilina). A BPR é um substrato pobre para a enzima β-lactamase, explicando a sua excelente actividade contra a E. fecalis produtora de β-lactamase.Esta pesquisa demonstrou que a BPR tem uma atividade potente contra uma coleção muito grande de E. fecalis. A actividade do BPR não foi afectada pela resistência à vancomicina nem pela produção de β-lactamase. Portanto, o BPR é um agente esperançoso para o uso no tratamento de infecções E. faecalis resistentes à vancomicina e à β-lactamase no ser humano.2.) Examinando como Enterococcus faecalis se torna resistente ao medicamento linezolid (5)
Quando os antibióticos são utilizados no tratamento de uma infecção bacteriana, eles podem ter um impacto na flora intestinal. As bactérias resistentes podem ser selecionadas durante o tratamento, como o Enterococci, e são potencialmente patogénicas. O aparecimento de resistências é uma questão para novos antibióticos, porque pode pôr em risco a utilidade dos antibióticos.Este estudo examinou o aparecimento de resistência aos antibióticos por E. fecalis. Mais especificamente, os pesquisadores analisaram a resistência à linezolida (a primeira de uma nova classe de antibióticos conhecidos como “oxazolidinonas”). Linezolid pode ser usado contra cocci Gram – positivo resistente a múltiplos fármacos, incluindo VRE. Inibe a síntese proteica bacteriana ligando-se especificamente a um domínio na subunidade ribossómica 50S e não é afectada pelos mecanismos de resistência que afectam outros antibióticos. Este estudo analisou a taxa de emergência de mutantes E. faecalis resistentes aos linezolídeos no tracto digestivo de ratinhos gnotobióticos. O faz de linezolida foi alimentado na água com doses variando de 0,5, de 0,005 0,005 g/L. Os mutantes foram todos dependentes do linezolid dado, níveis de resistência aumentou com a duração da exposição. Nenhum mutante foi isolado na ausência de linezolida, sugerindo que a resistência de novo à linezolida era incomum nos enterococos.A pesquisa descobriu que uma mutação em um único gene rRNA 23S foi o passo crítico no surgimento de resistência linezolida. A colonização primária com mutantes de mutação única foi observada logo 5 dias após o início do tratamento em ratinhos.Estas experiências envolvendo ratinhos ajudam a explicar o padrão de emergência de resistência à linezolida observada em isolados clínicos. A equipe de pesquisa mostrou que a dose é fundamental para a dinâmica da resistência. Estes achados devem ajudar a definir as melhores estratégias terapêuticas para minimizar o aparecimento de resistência no ambiente clínico, possivelmente salvando muitas vidas.3.) Um Ser/Thr quinase em Enterococcus faecalis é encontrado para mediar a resistência antimicrobiana (6)
Enterococcus faecalis faz com que muitas das infecções resistentes a antibióticos em hospitais, em conseqüência de sua inerente a resistência a certos antibióticos e de sua capacidade de sobreviver e proliferar no trato intestinal.A base genética da resistência vista em E. fecalis não é bem conhecido, esta pesquisa tenta identificar uma causa da resistência. Os investigadores mostraram que o PrkC, uma proteína sinalizadora de um componente contendo um domínio ser/Thr kinase de tipo eucariótico, permitia resistência antimicrobiana inerente e persistência intestinal de E. faecalis. Eles descobriram que um mutante E. faecalis sem PrkC cresceu a uma taxa de tipo selvagem na ausência de estresse antimicrobiano, mas mostrou maior sensibilidade aos compostos celulares-envelope-ativos, incluindo antibióticos que visavam a biogênese da parede celular e detergentes biliares.O PrkC regula os processos fisiológicos em E. fecalis que são fundamentais para o seu sucesso como patógeno nosocomial. A estrutura prevista dos pesquisadores do PrkC era um domínio citoplásmico cinase separado por um segmento transmembranar que se pensava ligar peptidoglicano não-ligado. Isto sugere que o PrkC era um receptor transmembranar que monitora a integridade da parede celular E. faecalis e Medeia respostas adaptativas para manter essa interligação. PrKC é importante para E. fecalis para causar infecções nosocomiais, sugerindo que a proteína sinalizadora é um alvo para o desenvolvimento de terapias para prevenir infecções por enterococos resistentes aos antibióticos.1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Ler, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Silva, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. “Role of Mobile DNA in the Evolution of vancomicina-Resistant Enterococcus faecalis.” Ciência. Março de 2003. Volume. 299, No. 5615. P. 2071-2074
2.) Murrary BE. Maio de 1998. “Diversidade entre os enterococos multidrogresistentes.”Emerging Infectious Diseases. Volume. 4, No. 1. P. 46-65.3.) De la Maza, Luis M., Marie T. Pezzlo, and Janet T. Shigei. Color Atlas of Medical Bacteriology. Washington, DC: American Society for Microbiology Press, 2004.4.) Arias C., Singh K., Panesso D., Murray BE. “Time-Kill and Synergism Studies of ceftobiprol against Enterococcus faecalis, Including ß-Lactamase-Producing and Vancomycin-Resistant Isolates.”Antimicrobial Agents and Chemistion. Junho de 2007. Volume. 51, No. 6. P. 2043-2047.5.)- Burguesa Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. “Dose Dependência do Surgimento de Resistência à Linezolida em Enterococcus faecalis In Vivo.”The Journal of Infectious Diseases. 2007. Volume. 195. P. 1480-1488.6.) Kristich C., Wells C., Dunny G. “Um ser/Thr quinase de tipo eucariótico em Enterococcus faecalis mediata a resistência antimicrobiana e a persistência intestinal.”Proceedings of the National Academy of Sciences of the United States of America. Fevereiro de 2007. Volume. 104, No. 9. P. 3508-3513.7.) Macovei, L., Zurek, L. “Ecology of Antibiotic Resistance Genes: Characterization of Enterococci from Houseflies Collected in Food Settings.”Applied and Environmental Microbiology. Junho de 2006. Volume. 72, No. 6. P. 4028-4035.8.) Gilmore, Michael. The Enterococci: Pathogenesis, Molecular Biology, and Antibiotic Resistance. Washington, DC: American Society for Microbiology Press, 2002.9.)Nallapareddy SR, Singh KV, Sillanpää J, Garsin da, Höök M, Erlandsen SL, Murray BE.. “Endocardite and biofilm-associated pili of Enterococcus faecalis.”The Journal of Clinical Investigation. Outubro de 2006. No. 116. P. 2799-2807.Edited by Richard A. Martinez of UC San Diego, student of Rachel Larsen.