Chemguide: Núcleo de Química 14 – 16
Duplas e triplas ligações covalentes
Esta página introduz a possibilidade de múltiplos (duplos ou triplos) ligações covalentes entre os átomos de utilizar o oxigênio, o nitrogênio, dióxido de carbono e o eteno como exemplos. Estes são escolhidos porque são todos comumente especificados em programas do Reino Unido para jovens de 14-16 anos.
estou assumindo que você leu a página introduzindo ligação covalente e tem acesso a uma tabela periódica como a que você pode baixar a partir deste site.
colagem Dupla de oxigênio
Se você olhar para cima de oxigênio na Tabela Periódica, você vai descobrir que ele tem um número atómico de 8 – e então, o átomo neutro tem 8 prótons e 8 elétrons. Estes serão organizados 2,6.
Então, você tem dois átomos como este:
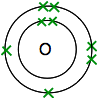
Cada um tem dois electrões desemparelhados. Para obter a máxima estabilidade energética, todos estes terão de ser emparelhados.
de modo que os oxigenados partilham dois pares de electrões:
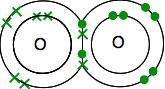
Este é muito mais fácil ver o uso de linhas para representar pares de elétrons compartilhados:
![]()
Tripla ligação em nitrogênio
Se você encontrar nitrogênio na Tabela Periódica, você será capaz de descobrir que a sua estrutura electrónica é de 2,5. Comparando-o com o oxigénio, tem, portanto, um par de electrões e três electrões não emparelhados no seu nível exterior.
para torná-lo tão energeticamente estável quanto possível, ele vai precisar par todos estes em ligações covalentes. Dois átomos de nitrogênio será, portanto, combinar assim:
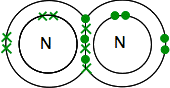
Novamente, isto é muito mais fácil ver o uso de linhas para representar pares de elétrons compartilhados:
![]()
colagem Dupla em dióxido de carbono
de Carbono da estrutura eletrônica é 2,4 com 4 electrões desemparelhados em nível externo.
Oxygen is 2,6 with 2 pairs of electrons and 2 Unpair electrons in the outer level.
Você precisa acabar com todos os elétrons emparelhados-e só há uma maneira de fazê-lo.
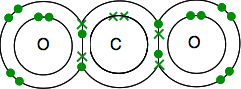
Como antes, a ligação é mais fácil de ver usando linhas para pares de ligações de elétrons.
![]()
Se existem dois pares de elétrons de ligação entre dois átomos, é chamada, não surpreendentemente, uma ligação dupla. Assim, cada oxigênio é unido ao átomo de carbono no meio por uma dupla ligação.
colagem Dupla em eteno, C2H4
Eteno e outros similares, compostos com ligações duplas entre átomos de carbono são importantes substâncias na química. Você vai encontrá-los mais detalhadamente mais tarde no curso.
olhe cuidadosamente para o diagrama de pontos e cruzes e certifique-se de que compreende como tudo se encaixa. Tem de ser assim, para que todos os electrões isolados nos Carbões e nos hidrogénios sejam emparelhados em pares de ligações.
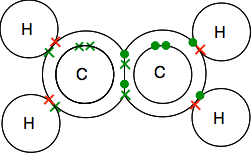
Se encontrar diagramas que mostrem os pares de ligações como linhas, poderá encontrar uma de duas versões.
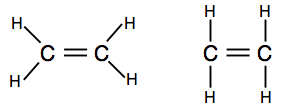
a primeira mostra a forma real da molécula melhor, mas a segunda também é perfeitamente aceitável a este nível.
onde você gostaria de ir agora?
para a página seguinte nesta secção sobre ligações covalentes . . .
ao menu Estrutura Atómica e ligações . . .
para o menu Química 14-16 . . .
para o menu principal de Chemguide . . .