O que é ligação iónica?as ligações químicas formam-se quando a energia total dos átomos ligados é inferior à energia total dos átomos separados.A forma que a ligação assume é determinada pelo arranjo de elétrons que minimiza a energia.
em alguns casos, elétrons são compartilhados entre átomos – isto é chamado de ligação covalente.em outros casos, há uma transferência completa de um ou mais elétrons de um átomo para outro.O átomo que perde elétrons torna-se um íon carregado positivamente.O átomo que recebe elétrons torna-se um íon carregado negativamente.
isto conduz à ligação iónica – a atracção electrostática mútua de positivo e negativo charges.In sua forma mais pura, ligação iônica não é direcional. Pode ser considerada como uma simples atracção Coulombiana entre taxas pontuais.Isto é diferente da ligação covalente, na qual a partilha de elétrons resulta em ligações direcionais.
Transferência de Electrões
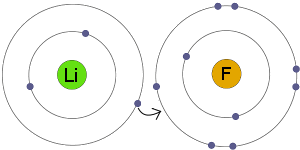
Li transfere um elétron para F. O resultado é que tanto a resultante íons tornar eletricamente carregado e ter completa, estável escudos do elétron.
Atração Eletrostática
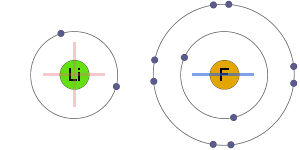
Os íons positivos e negativos são atraídos eletrostaticamente para um outro, resultando em um iônica bond.
a força coulombiana não tem nenhuma direção preferida, com o resultado que os compostos iónicos tendem a existir como estruturas cristalinas gigantes de iões embalados juntos.
Um Exemplo de Fluoreto de Lítio é cristalina

Electronegativity e Iônica Ligação
Dois elementos tendem a ligação ionically quando eles diferem amplamente em electronegativity.
Tabela Periódica de eletronegatividade
quanto mais clara a tonalidade de verde, maior a eletronegatividade. Cinzento significa que nenhum valor é conhecido. (Clique em imagem para uma vista maior.)

Ligação Covalente Caractere
Absolutamente puro ionically ligada compostos verdadeiramente não existe, porque a carga positiva do íon polariza o íon negativo da nuvem de elétrons.Isto é particularmente visível quando se lida com iões metálicos pequenos e altamente carregados, como o Al3+, embora o efeito polarizante esteja presente em certa medida em todos os compostos iônicos.A polarização é efetivamente um efeito direcional de compartilhamento de elétrons, daí que introduz uma pequena quantidade de covalência em compostos iônicos.
a proporção de comportamento iônico/covalente em uma ligação pode ser avaliada de forma muito aproximada usando a escala de Pauling da eletronegatividade.Linus Pauling estimou que uma diferença de eletronegatividade de 1,7 entre elementos leva à ligação que é 50% iônica.
os valores abaixo de 1 correspondem à ligação covalente dominante e os valores acima de 2 à ligação iónica dominante.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
a ligação C-H com uma diferença de 0.35 será covalente, enquanto a ligação NaCl a 2.23 será iónica.A ligação HCl a 0,96 será covalente polar, e a ligação LiI a 1,68 será 50/50 iónica/covalente.a maior diferença de eletronegatividade é de 3,19, entre césio (0,79) e flúor (3,98). A ligação resultante é de cerca de 95 por cento de caráter iônico.
