um homem de 49 anos com antecedentes de abuso de álcool apresenta ao ED queixas de dor abdominal generalizada e vómitos nas últimas 36 horas. O doente é bem conhecido pelo departamento para consultas relacionadas com o álcool e continua a beber diariamente. Na chegada, ele é taquicárdico e taquipneico, e os resultados do exame físico incluem membranas mucosas secas, turgor de pele diminuída, sensibilidade epigástrica, e um tremor em ambas as mãos. Os estudos laboratoriais mostram um bicarbonato sérico de 10 mEq/L, uma lacuna aniónica de 30, uma glucose sérica de 95 mg / dL, uma acidose láctica com pH 7.2, hipofosfatemia e vestígios de cetonúria. Tac Abdominal normal. Ele nega uma história de diabetes mellitus, ingestão de quaisquer álcoois tóxicos, ou doença recente.
Este doente pode potencialmente ter qualquer um de muitos diagnósticos, mas a sua apresentação e resultados laboratoriais são mais consistentes com cetoacidose alcoólica (também conhecida por cetoacidose alcoólica). AKA pode ser um diagnóstico ED comum e normalmente ocorre em bebedores crônicos de álcool que têm uma interrupção abrupta em sua ingestão de álcool, juntamente com a diminuição da ingestão glicêmica e depleção do volume intravascular.1
na maioria dos casos, um acontecimento precipitante como pancreatite, gastrite ou pneumonia por aspiração conduz a uma diminuição abrupta da ingestão oral. Cerca de 24 a 72 horas após a cessação da ingestão de pó, AKA pode desenvolver-se.Estes doentes apresentam normalmente uma concentração sérica de álcool baixa ou ausente e podem apresentar vários graus de abstinência do álcool. No entanto, um sensorium claro é uma característica desta condição. A presença de uma alteração na consciência sugere fortemente que outro processo está presente.3
embora a fisiopatologia subjacente seja complexa, uma compreensão adequada ajuda grandemente no diagnóstico e gestão desta condição.
existem três conceitos gerais que conduzem:
- A ingestão de álcool, agravada pela diminuição da ingestão calórica e desidratação, favorece um estado cetótico.a cetoacidose é causada por uma combinação de fatores, incluindo hipoinsulinemia induzida pela fome, oxidação do álcool em seus vários metabolitos de cetona, lipólise com libertação de ácido gordo livre (FFA), e contração do volume intravascular. O estado de fome relativo em AKA leva a secreção excessiva de glucagon e concentrações reduzidas de insulina periférica, que desempenha um papel fundamental no desenvolvimento de cetoacidose. O metabolismo das gorduras através da lipólise produz beta-hidroxibutirato (BHB) e acetato de acitilo (ACA). Estas cetonas são utilizadas para a respiração celular para fornecer energia através da produção de trifosfato de adenosina (ATP), mas adicionam à acidose de anião gap vista em AKA.durante o metabolismo do etanol, geram-se elevadas quantidades de NADH (a forma reduzida de dinucleótido nicotinamida-adenina).NAD+ é uma coenzima usada para transportar electrões em reacções intracelulares redox. A redução do NAD+ e consequente acumulação e desequilíbrio do NADH no metabolismo do etanol tem várias consequências importantes. A geração BHB predomina sobre a produção de ACA nesta elevada razão NADH – NAD+. Esta razão anormal conduz a uma inibição do ciclo do ácido cítrico e da gluconeogénese hepática, o que explica parcialmente a razão pela qual a hiperglicemia é rara nestes doentes.Quase contraintuitivamente, há uma falha em regenerar níveis normais de NAD+ e ACA em AKA. A reoxidização de NADH para NAD+ parece ser limitada por uma combinação de fatores, incluindo hipofosfatemia e um bloco funcional dentro da mitocôndria.A acidose láctica observada em AKA é devida a um estado redox anormal. Piruvato é um substrato usado em inúmeras vias produtoras de energia, mas na cetoacidose alcoólica, é deslocado de suas vias metabólicas normais para outras que aumentam a produção de lactato. Além disso, a regeneração do piruvato a partir do ácido láctico está comprometida.um estado adrenérgico elevado e a depleção do volume agravam a cetose e inibem a gluconeogénese, criando um estado que favorece a criação e manutenção de um meio cetótico.o corpo responde à fome, desidratação e hipoglicemia com a liberação de hormônios contra-regulatórios. Estas hormonas aumentam o tom simpático, diminuem a libertação de insulina e aumentam a concentração de cetona através da libertação de FFAs e diminuem o metabolismo periférico da cetona. Todas estas mudanças perpetuam o estado cetótico até que a glicose seja reintroduzida no sistema. Desidratação significativa devido a vómitos e diminuição da ingestão oral levam a uma diminuição da depuração renal da cetona, exacerbando ainda mais a situação.2 o diagnóstico diferencial para AKA deve incluir cetose de fome e cetoacidose diabética (DKA). Embora uma história completa possa ajudar a estreitar o diferencial, um painel metabólico é essencial para confirmar o diagnóstico. Lacunas aniônicas de 30 mEq / L ou mais podem ser vistas em AKA, embora a lacuna possa ser obscurecida por uma alcalose metabólica primária concomitante devido ao vômito. De facto, existem casos notificados de doentes com AKA que têm um pH sérico alcalémico devido a vómitos excessivos.A lacuna aniônica na cetose de fome é tipicamente muito menor, com níveis de bicarbonato raramente abaixo de 18 mEq / L, e pH sérico tipicamente acima de 7.30.2 em DKA, em contraste, a abertura do ânion pode ser bastante alta, com níveis de bicarbonato frequentemente atingindo os dígitos únicos. Hiperglicemia com glicosúria, tipicamente observada em cetoacidose diabética( DKA), é rara com Também conhecido por.A desnutrição crónica conduz a reservas de glicogénio baixas e o tom adrenérgico elevado conduz à inibição da gluconeogénese hepática. Cetonúria, presente em todas as três condições, pode confundir a gravidade de AKA.A cetonúria é medida pelo teste nitroprussido, no qual uma mudança de cor indica a concentração relativa de acetona e ACA na urina. A presença de BHB, a cetona mais proeminente presente em AKA, não é refletida pelo teste de nitroprussida. Isto explica porque pacientes com AKA podem mostrar não ou apenas ligeira cetonúria na apresentação inicial, com um aumento paradoxal à medida que a condição é revertida. À medida que a razão ACA:BHB normaliza, tanto o ACA detectável como o BHB são eliminados na urina.no diagnóstico diferencial, devem também ser consideradas outras condições com risco de vida que possam causar uma lacuna aniónica significativa. Os álcoois tóxicos, especificamente metanol e etilenoglicol, podem ser ingeridos intencionalmente ou acidentalmente nesta população de doentes. Estas ingestões podem causar morbilidade e mortalidade significativas se não forem adequadamente geridas.5 estado mental alterado é uma característica comum da ingestão de álcool tóxico, mas não é geralmente visto em AKA.5
pacientes tipicamente têm uma lacuna osmolar inicial que transita para uma lacuna aniônica aumentada como o álcool tóxico é metabolizado. A elevada concentração sérica de BHB pode ser bastante elevada em AKA, mas isso não exclui necessariamente a possibilidade de ingestão de álcool tóxico; nem a ausência de um osmolar ou um gap anião descartam o diagnóstico. Embora os doentes AKA tenham uma ligeira acidose láctica, a presença de um nível de lactato significativamente elevado deve levar à procura de uma doença subjacente. Raramente, uma combinação de AKA e um destes outros eventos podem ocorrer e apresentar um enigma de diagnóstico. A consideração ponderada do tempo, tipo e quantidade de ingestão, e sintomas associados, em combinação com a observação e estudos laboratoriais, deve ser usada para fazer esta diferenciação se uma história clara e precisa está faltando.
Tratamento
a reversão da cetose e a rehidratação vigorosa são centrais no tratamento da T. c. p. Além da reposição de fluidos isotônicos, fluidos intravenosos contendo dextrose são necessários. Tipicamente, a dextrose a 5% com solução salina semi-normal a uma taxa de 150 mL por hora fornece glucose suficiente para estimular o pâncreas a segregar insulina, permitindo que os tecidos periféricos metabolizem cetonas e inibam a libertação de FFA.2 Ele também permite que o corpo regenere NAD+, que é inibido pelas alterações metabólicas causadas por AKA. As perfusões de fluido contendo dextrose intravenosa devem ser interrompidas logo que os níveis de bicarbonato tenham atingido 18-20 mEq/L e o doente esteja a tolerar a ingestão oral. Isto ocorre normalmente 8 a 16 horas após o início do tratamento.A interrupção do consumo de álcool nestes doentes deve ser controlada agressivamente com benzodiazepinas intravenosas. A tiamina, o folato e outros electrólitos, principalmente o fosfato e o potássio, podem precisar de ser repletados nestes doentes.6 curiosamente, a maioria da morbilidade vista em AKA é devido ao processo subjacente que causou a cessação do álcool.
conclusão do caso
O doente recebeu 4 litros de solução salina normal e foi iniciado em D5-1/2 NS antes da admissão. Ele recebeu valium IV para a retirada do álcool, e tiamina, folato e fosfato foram repletados. Ele foi hospitalizado por três dias para o tratamento de AKA e abstinência de álcool, em seguida, liberado uma vez tolerando a ingestão oral e em bom estado. Ele foi visto três semanas depois no departamento de emergência para uma apresentação semelhante.
Quadro 1. Characteristics of Common Ketoacidoses
Diabetic Ketoacidosis Alcoholic Ketoacidosis Starvation Ketoacidosis Bicarbonate Can reach single digits Can reach single digits > 18 Glucose Elevated Low to mildly elevated Low to normal Measurable ketonuria Present Absent or present Present Figure 1. Via metabólica
(ADH = desidrogenase alcoólica, ALDH = acetaldeído desidrogenase).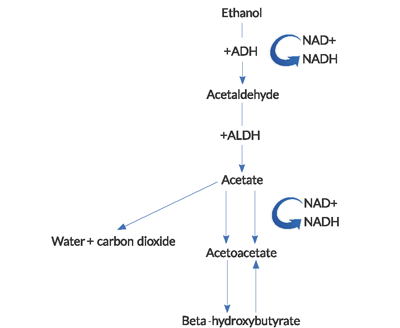
- Palmer, Jerry P. cetoacidose alcoólica: Clinical and laboratory presentation, pathophysiology and treatment. Clinics in endocrinology and metabolism 12.2 (1983): 381-389.Duffens K, Marx JA. Revista alcoólica cetoacidosisa.The Journal of emergency medicine 5.5 (1987): 399-406.Wrenn KD, Slovis CM, Minion GE, et al. Síndrome de cetoacidose alcoólica. The American journal of medicine 91.2 (1991): 119-128.Marx JA, Hockberger RS, Walls RM, et al., disfuncao. Rosens™ Emergency Medicine: Concepts and Clinical Practice. Philadelphia, PA: Mosby/ Elsevier; 2013. Chapter 185 Alcohol-Related Disease by John T. Finnell.Kraut JA, Kurtz I â € œToxic alcohol ingestions: clinical features, diagnosis, and management. Clinical Journal of the American Society of Nephrology 3.1 (2008): 208-225.Miller PD, Heinig R, Waterhouse C. Treatment of alcool acidose: the role of dextrose and phosphorus. Archives of internal medicine 138.1 (1978): 67-72.