compostos Antiaromáticos são invulgarmente instáveis
Quais são os principais factores que determinam se uma molécula é antiaromática?
Em nossos posts anteriores na nossa série sobre a aromaticity , vimos que as moléculas aromáticas são extraordinariamente estável. Eles têm energias de ressonância particularmente grandes, tendem a sofrer substituição ao invés de reações de adição, e têm deslocalizado elétrons pi (todos os comprimentos de ligação C-C em benzeno são iguais, por exemplo).
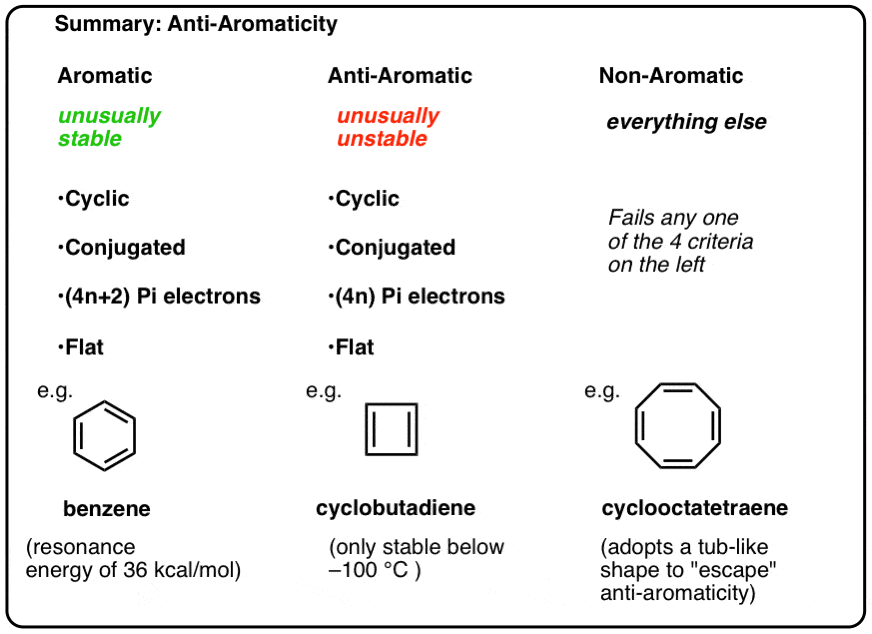
a fim de ser aromático, uma molécula deve possuir as seguintes quatro características estruturais:
- cíclica
- conjugated todo o anel
- tem elétrons pi
- plano (planar)
Se estas quatro condições forem satisfeitas, a molécula é aromático.se falhar mesmo uma pergunta no ensaio, não é aromático.isso parece ser bastante claro. Ou será?
Você pode adivinhar pela forma como estou enquadrando esta pergunta que a resposta é “não é bem”. : – )
Índice
- Algumas Moléculas São Tão Espectacular E muito Instável E De Difícil Isolar o Que Eles Merecem Sua Própria Categoria:Antiaromatic
- Cyclopentadienyl Cação: A “Ressonância Estabilizada” Carbocation Que não é Estável
- Antiaromatic Três-Lembrou Anéis: Oxirene, 1H-Azirene, Thiirene
- Cyclobutadiene É Antiaromatic
- 8 Pi-Elétron Exemplo de um Antiaromatic Composto: Pentaleno
- O que torna uma molécula Anti-aromática?conclusão: compostos Antiaromáticos notas avançadas: referências e leituras adicionais
1. Moléculas espectacularmente instáveis que formam uma categoria para si mesmas:”Anti-aromático”
Aqui está a coisa. Há um pequeno número de moléculas que chumbam no teste de aromaticidade que não são apenas não aromáticas.: eles têm a propriedade de serem tão espectacularmente e invulgarmente instáveis e difíceis de isolar que merecem outro nome.
chamamos estas moléculas de “anti-aromáticas”.
O que é interessante é que em muitos casos as moléculas em si não parecem particularmente instáveis a partir dos primeiros princípios, em contraste com, digamos, cubano. Engraçado o suficiente, você pode comprar cubano (mais ou menos) de Aldrich, mas a maioria das moléculas anti-aromáticas que vamos discutir abaixo só são estáveis a temperaturas extremamente baixas – se eles podem ser isolados em tudo!2. Catião Ciclopentadienilo: A Carbocalização “estabilizada por ressonância” que não é estável
vamos começar a nossa jornada pela toca do coelho com um exemplo simples que deve parecer familiar da Química Orgânica do primeiro semestre.Lembras-te da reacção SN1? O gato que deixa a cadeira confortável primeiro?revisão rápida: começar com um haleto de alquilo. Deixando as folhas do grupo, formando um carbocation. Ataques nucleófilos. É chamado de SN1 porque o passo de determinação de taxa (formação de carbocação) é unimolecular. Conclusão: quanto mais estável o carbocation, mais rápida a reação prossegue. Assim, a taxa de reação dos haletos de alquilo é terciária> secundária> primária, e a carbocação recebe pontos de bônus especiais se estiver estabilizada por ressonância.veja estas duas reacções SN1. Qual deles você acha que aconteceria mais rápido – a reação SN1 que passa por uma carbocação secundária (a), ou a reação SN1 que passa por uma carbocação secundária e pode formar múltiplas formas de ressonância (B)?
de tudo o que você aprendeu até agora, você esperaria que a resposta fosse B).
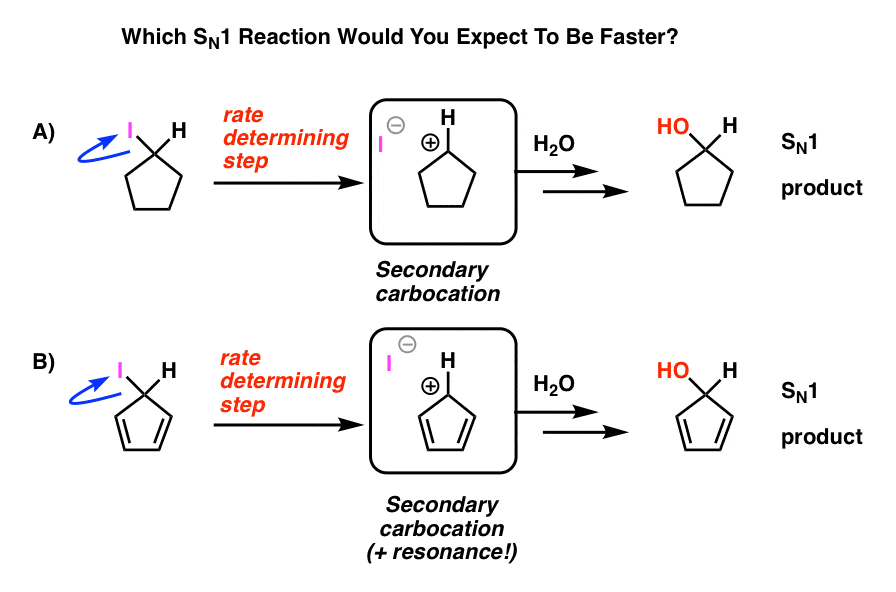
It’s not.
A resposta é que a reação a) Acontece mais rápido. A reacção B não acontece de todo. isto deve parecer-te profundamente estranho.é! como é que esta carbocação supostamente estabilizada por ressonância é menos estável que uma carbocação secundária?afinal de contas, quantas vezes é perfurado na tua cabeça que a ressonância estabiliza moléculas, especialmente carbocações?mas aqui, parece estar desestabilizando. É … é …

mas instável é! O catião ciclopentadienil é incrivelmente instável e difícil de fazer – e não é por falta de tentativa. Há algo muito estranho na estrutura do catião ciclopentadienil que lhe dá instabilidade incomum.

Cíclico, conjugado, plano… e tem 4 elétrons pi. Interessante!
3. Anéis antiaromáticos de três membros: Oxirene, 1H-Azirene, Tiirene
outra classe de moléculas “elusivas” é uma família de anéis de três membros. Deves lembrar-te do Org 1 que é fácil fazer epóxidos de alcenos usando um oxidante como o M-CPBA.alguma vez te perguntaste porque nunca cobrimos a mesma reacção para o alkynes?bem, não é por falta de tentativas. Os químicos tentaram todo o tipo de métodos para epoxidar alcynes, e sabes que mais? A reacção não funciona.por exemplo, a epoxidação do acetileno daria a molécula abaixo (oxireno).o Oxireno em si nunca foi observado, embora existam vestígios tentadores da sua existência fugaz. E a propósito, o análogo de azoto, o 1H-azireno, ou o tiireno também não.
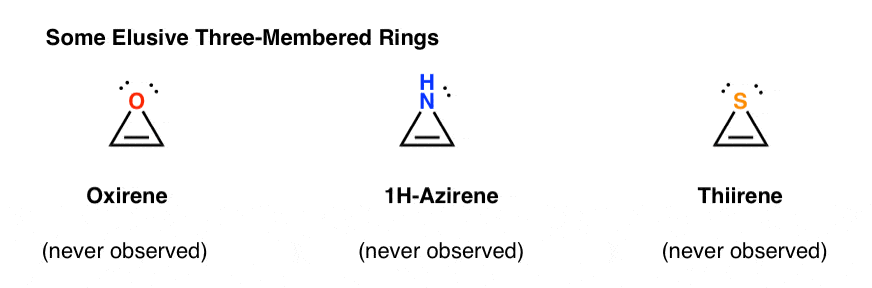
Por que não? O que há de especial em cada um destes casos?
pode notar-se que, tal como o catião ciclopentadienil, estas moléculas são cíclicas, conjugadas, planas, e têm 4 elétrons pi (dois na ligação pi, e dois de um par solitário). OK. O que mais pode ser cíclico, conjugado, plano, e ter 4 elétrons pi?4. Ciclobutadieno é Antiaromático
Ciclobutadieno parece uma molécula simples o suficiente, mas não foi realmente sintetizado até 1965. E mesmo assim, descobriu-se que não é estável a temperaturas acima de 35 Kelvin. a questão é, porquê?

claro, é um anel de quatro membros, e sim, tem uma grande variedade de anel, mas moléculas mais tensas foram feitas que são realmente estáveis à temperatura ambiente.
Você também pode notar que, como os exemplos acima, ciclobutadieno é outro exemplo de uma molécula que é cíclica, conjugada, tem 4 pi-elétrons, e é plana.
O que é ainda mais interessante é o que se aprendeu sobre a geometria do ciclobutadieno. Ao invés de ser uma molécula com comprimentos de ligação idênticos (como benzeno), ciclobutadieno foi encontrado para ter uma forma retangular, indicando que os elétrons não foram deslocalizados.
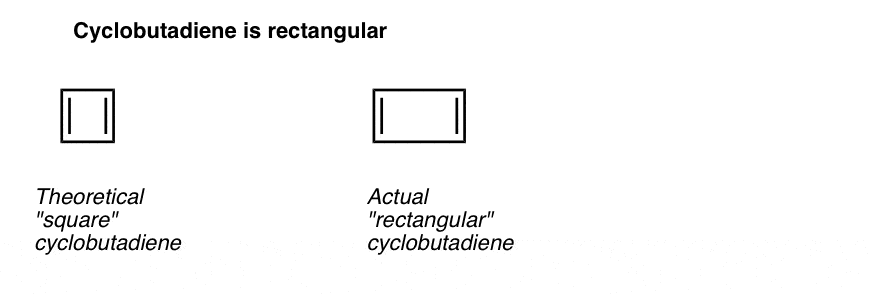
o Que isso nos diz é que, mesmo quando uma molécula cumpre todas as condições (cíclico, conjugados, televisão, 4 elétrons pi), a geometria simétrica é particularmente instável. . Muito interessante!
An 8 Pi-Electron Example of an Antiaromatic Compound: Pentalene
So far all the examples we have seen so far had 4 pi electrons. Você deve estar se perguntando: existem alguns exemplos de moléculas anti-aromáticas que têm mais de 4 elétrons pi? Sim.
a molécula abaixo é chamada “Pentaleno”. Ela foi sintetizada, mas é apenas estável abaixo de -100 °C. acima desta temperatura, ela se combina com outra molécula de si mesma (referência). Outro exemplo de instabilidade espetacular.

Pentalene tem 8 elétrons pi. Isto pode fazer soar algum alarme de reconhecimento. Lembre-se de como o número de pi-elétrons em moléculas aromáticas seguiu a sequência (2, 6, 10, 14….) ?este exemplo sugere que o número de electrões pi em moléculas anti-aromáticas segue a sequência (4, 8, 12…)
o que faz uma molécula Anti-aromática?
então o que todas estas moléculas nesta galeria de patifes têm em comum?cada um deles é cíclico, conjugado e plano – e quando se conta o número de electrões pi, são múltiplos de 4. Assim, enquanto moléculas aromáticas têm (4n+2) elétrons pi, a “regra” para moléculas anti-aromáticas é (4n). (outra maneira de olhar para ele: o número de elétrons pi será duas vezes um número par).
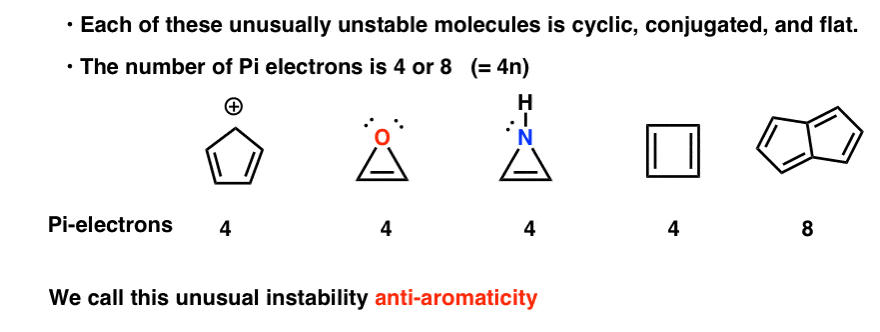
esta instabilidade incomum é chamada de “anti-aromaticidade”.
Isto significa que agora podemos elaborar três categorias para as moléculas de acordo com os seguintes critérios:
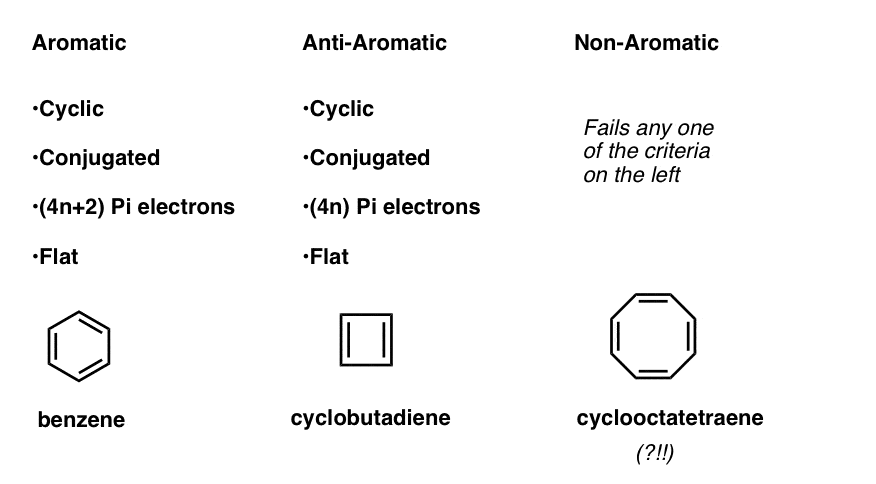
- as moléculas Aromáticas são cíclicos, conjugados, têm (4n+2) pi elétrons, e são planas.as moléculas anti-aromáticas são cíclicas, conjugadas, têm (4N) electrões pi e são planas.as moléculas não aromáticas são todas as outras moléculas que falham numa destas condições.
espere um segundo-pode perguntar-se porque é que o ciclooctatetraeno é classificado como “não aromático”. Com 8 elétrons pi (duas vezes um número par) não deveria ser “anti-aromático”?
Ciclooctatetraeno “escapa” à Anti-aromaticidade através da torção para fora da plana
pense em preencher as condições para a “anti-aromaticidade” como um pouco como qualificação para um imposto de renda extremamente punitivo. Dada a oportunidade de encontrar uma escapatória para sair do imposto, fá-lo-ias? Provavelmente.o Ciclooctatetraeno só é anti-aromático se for Plano. No entanto, a estrutura relativamente “floppy” do ciclooctatetraeno permite alguma flexibilidade. As ligações podem rodar para longe da lisonja de tal forma que a molécula adota uma forma de “tub-like”, evitando assim o “imposto antiaromaticity” de 18 12 kcal/mol que seria pago se todos os orbitais p na molécula fossem conjugados uns com os outros.
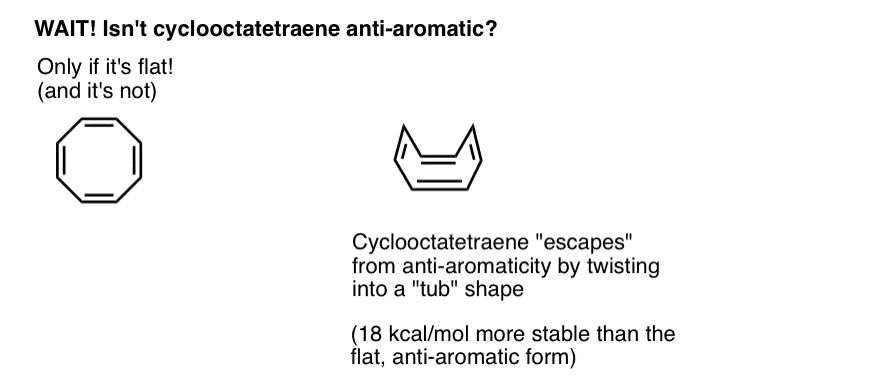
acontece que cyclooctatetraene foi sintetizada, é estável (você pode comprá-lo aqui, por exemplo) e se comporta como um “normal” alkene, em adição, reações de hidrogenação, e assim por diante.
Pentaleno (acima), que também tem 8 elétrons pi, tem uma estrutura bicíclico muito rígida que impede a rotação de ligação longe da plana. Por isso, está preso na sua conformação anti-aromática.
Anti-aromaticity for molecules with more than 8 pi electrons is known, but very unusual. (Aqui está um exemplo divertido de outra “fuga” da aromaticidade para uma molécula com 18 elétrons pi.)
Conclusion: Antiaromatic Compounds
So far our treatment of aromaticity and anti-aromaticity has been purely descriptive and empirical. Nós mostramos muitos exemplos, e demos muitas regras, mas faltar na discussão tem sido qualquer explicação profunda do “porquê”.o que há de tão especial no anel de benzeno que o torna tão estável? Porque é estável?o que é tão especial no sistema ciclobutadieno que o torna tão instável. Porque é que é instável?
A fim de responder a essas questões mais profundas, vamos ter que dar um passo atrás e examinar os orbitais moleculares dessas duas moléculas, e então chegar a uma compreensão mais profunda da aromaticidade e anti-aromaticidade.é o que faremos no próximo post.graças a Matthew Knowe pela ajuda na preparação deste post.
notas
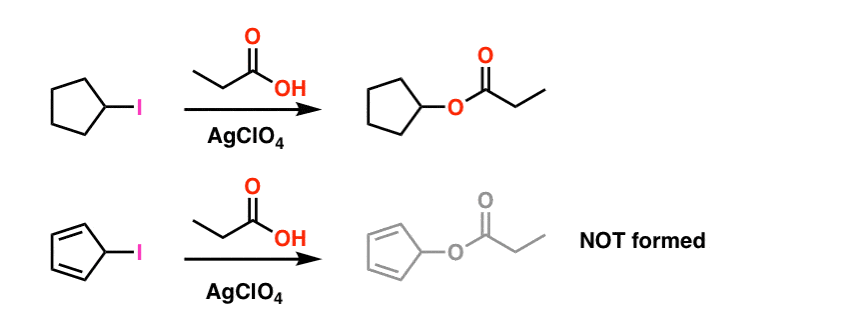
Nota de rodapé 1. Para simplificar, a imagem mostrada no artigo principal fudges sobre as condições reais de reação. As condições experimentais reais são mostradas abaixo. O solvente é ácido propiónico, e o perclorato de prata do ácido de Lewis é adicionado para ajudar a retirar o iodo. .
mesmo sob estas condições a carbocação ciclopentadienil não é formada, o que é um testemunho de sua extrema instabilidade.
Nota de rodapé 2. A epoxidação em eteno (também conhecido como etileno) é feita com uma quantidade de 15 milhões de toneladas, anualmente. Desconhece-se a epoxidação do acetileno para formar oxireno.
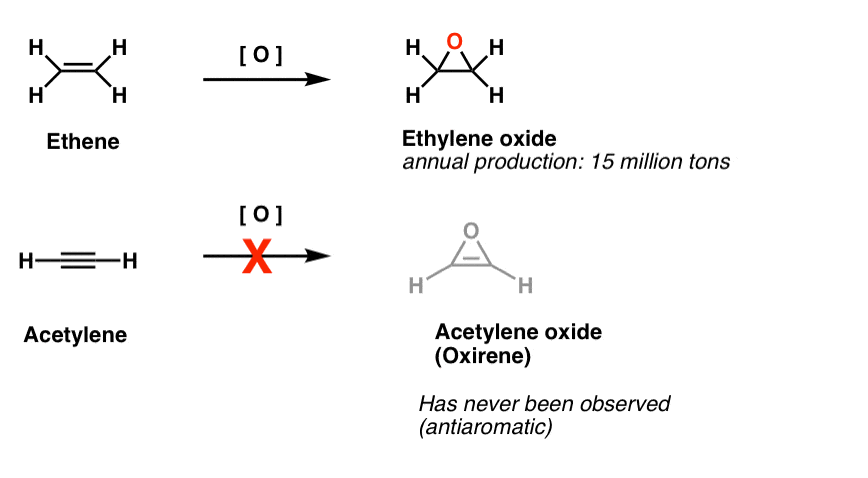
evidência fugaz da existência de oxirenos foi encontrada. Há boas evidências de estudos de rotulagem de isótopos de que os oxirenos são intermediários fugazes em certos rearranjos de Wolff. Há também dois exemplos de oxirenes que foram presos em temperatura extremamente baixa, mas decompostos acima de 35 Kelvin.
a existência fugaz de uma 1H-azirina tem sido postulada na adição de um nitreno a um acetileno, que rapidamente rearranja para um (estável) 2h-azireno (abaixo).
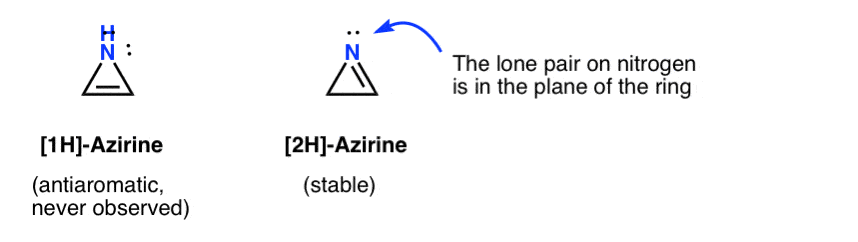
Note que em 2H-azirene o par solitário sobre o nitrogênio é, em ângulos retos, para o sistema pi, de modo que este sistema é não-aromáticos como oposição ao anti-aromáticos.
para mais discussão, veja a Química Orgânica avançada de March. Tenho trabalhado na 5ª edição, páginas 62-63.
. Nota 3. A very clever experiment determined that 1,2-dideutero cyclobutadiene has two isomers, not one (see below). Isto indica que as ligações duplas no ciclobutadieno não são deslocalizadas como estão no benzeno, mas são mais como ligações duplas em um dieno convencional.
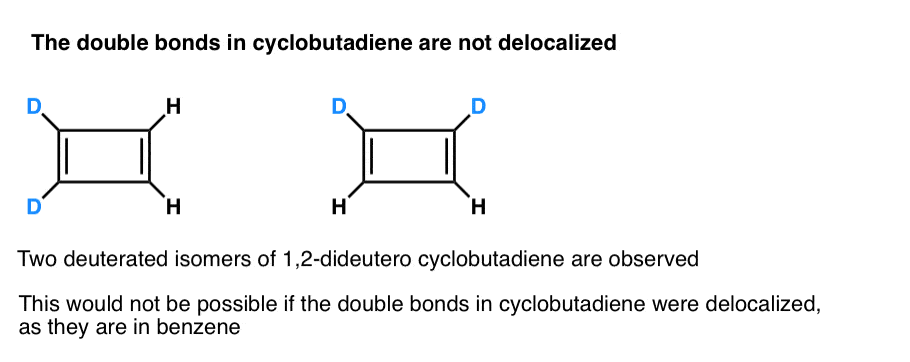
Ciclobutadieno reage com ele próprio a 35 K para formar um “dímero”, num exemplo de uma reacção de Diels-Alder.
Nota de rodapé 4. Sim, é verdade que o par solitário em azirene pode ser colocado em um orbital híbrido sp3 (abaixo). Isso provavelmente reduz um pouco a “penalidade” anti-aromática, mas a molécula ainda é incrivelmente instável. Anti-aromaticidade é a maneira mais simples de explicar isso.
Nota de rodapé 5. A geometria retangular é devido a um efeito conhecido como o efeito Jahn-Teller. Lembras-te do princípio de exclusão de Pauli, onde os electrões não podem ter o mesmo número quântico? Bem, como veremos quando olharmos para o diagrama orbital molecular do ciclobutadieno, o ciclobutadieno ” quadrado “tem dois elétrons” degenerados”, ou seja, eles têm as mesmas energias e números quânticos. Isto leva a um fenômeno conhecido como “repulsão Pauli”, onde o alongamento das ligações ocorrem até que os níveis de energia dos dois elétrons sejam diferenciados. Definitivamente um tópico avançado.
(Advanced) References and Further Reading
- Transition-State Spectroscopy of Cyclooctatetraene
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
Science, 1996, 272, 1456-1459.
DOI: 10.1126 / science.272.5267.1456
this study is the basis for the statement that the non-aromatic ground state of cyclooctatetraene is 12 kcal/mol below the “antiaromatic” conformation.Donald J. Cram, Martin E. Tanner, Robert Thomas Chem. T. Disfuncao. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
Este artigo do Prêmio Nobel Prof. Donald J. Cram (UCLA) descreve a primeira caracterização espectroscópica do ciclobutadieno. Isto é realizado cercando o precursor em um hemicarcerand (complexo da gaiola), e então irradiando-o com luz UV, criando assim ciclobutadieno, que é incapaz de fazer qualquer coisa desde que está preso. - Cyclobutadiene
Thomas Bally, Satoru Masamune
Tetraedro de 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
Este papel, a partir de 1980, comentários de trabalho feito cyclobutadiene até aquele momento. Isto é dividido em duas partes – esforços sintéticos experimentais e cálculos teóricos.Tetrahedrana e Ciclobutadieno Günther Maier Chem. T. Disfuncao. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
This paper reviews synthetic efforts towards tetrahedrane and cyclobutadiene-both molecules have a formula of C4H4. Até à data, apenas os tetraedranes substituídos (tetra t-butil e tetra trimetilsilil) tetraedranes foram sintetizados com êxito e isolados. - Cyclobutadiene – e Benzocyclobutadiene-Ferro Tricarbonyl Complexos
F. Emerson, L. Watts, e R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Cyclobutadieneiron Tricarbonyl. A New Aromatic System
D. Fitzpatrick, L. Watts, G. F. Emerson, e R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
Um bônus tópico: cyclobutadiene pode ser estabilizado com metais – o organometálicos complexos cyclobutadiene ferro tricarbonyl é estável, sólido cristalino. Como os autores mencionam, é improvável que ciclobutadieno livre seja gerado na síntese.a olanzapina antipsicótica adopta uma forma borboleta para evitar efeitos antiaromáticos, semelhante ao cicloctatetraeno. Isto é aparentemente crítico para a sua função. - Antiaromaticity
Ronald Breslow
Contas de Investigação Química de 1973, 6 (12), 393-398
DOI: 1021/ar50072a001
Curiosamente, Prof. Breslow (Columbia) estados de conta que ele foi a pessoa que primeiro a sugerir o termo “antiaromatic” especialmente para desestabilizar compostos cíclicos com 4n p elétrons. Ele também cita outros trabalhos do Prof. M. J. S. Dewar e outros onde a desestabilização antiaromática do ciclobutadieno é calculada entre 18-33 kcal / mol em relação ao butadieno linear. - Experimental Determination of the Antiaromaticity of Cyclobutadiene
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Science 1999, 286 (5442), 1119-1122
DOI: 1126/science.286.5442.1119
This is a very rigorous paper that uses novel spectroscopic techniques to determine antiaromatic desestabilization of cyclobutadiene. Em relação a uma hipotética estirpe sem dieno conjugado, o ciclobutadieno é desestabilizado por um total de 87 kcal/mol, 32 kcal/mol dos quais podem ser atribuídos à estirpe do anel e 55 kcal/mol à antiaromaticidade (em comparação com 21 kcal/mol para a estabilização aromática do benzeno). - Insubstituíveis cyclopentadienyl cação, num rés-do-estado tripleto
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O’Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
DOI: 10.1021 / ja00790a049
o catião ciclopentadienil só pode ser preparado com dificuldade, como este artigo descreve. Uma vez formado, tem um estado terrestre eletrônico tripleto (com 2 elétrons não emparelhados), e pode ser caracterizado por espectroscopia EPR (ressonância paramagnética eletrônica). - Oxirenes
Errol G. Lewars
Chemical Reviews 1983, 83 (5), 519-534
DOI: 10.1021/cr00057a002