tendências periódicas e efeitos dos solventes na nucleofilicidade
Há tendências periódicas previsíveis na nucleofilicidade. Movendo-se horizontalmente ao longo da segunda linha da tabela, a tendência em nucleophilicity paralelos a tendência de basicidade:
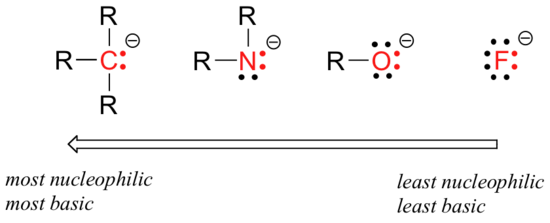
o raciocínio por trás da tendência horizontal da nucleofilicidade é o mesmo que o raciocínio por trás da tendência da basicidade: mais elementos eletronegativos mantêm seus elétrons mais apertados, e são menos capazes de doá-los para formar uma nova ligação.
Este horizontal tendências também nos diz que as aminas são mais nucleophilic de álcoois, apesar de ambos os grupos comumente agem como nucleophiles em laboratório e as reações bioquímicas.
recordar que a basicidade dos átomos diminui à medida que descemos verticalmente uma coluna na tabela periódica: iões tiolatos são menos básicos do que iões alcóxido, por exemplo, e íon brometo é menos básico do que íon cloreto, que por sua vez é menos básico do que íon fluoreto. Lembre-se também que esta tendência pode ser explicada considerando o tamanho crescente da “nuvem de elétrons” em torno dos íons maiores: a densidade de elétrons inerente à carga negativa é espalhada em torno de uma área maior, que tende a aumentar a estabilidade (e, portanto, reduzir a basicidade).
a tendência periódica vertical para a nucleofilicidade é um pouco mais complicada que a tendência para a basicidade: dependendo do solvente em que a reação está ocorrendo, a tendência da nucleofilicidade pode ir em qualquer direção. Vamos tomar o exemplo simples da reação SN2 abaixo:
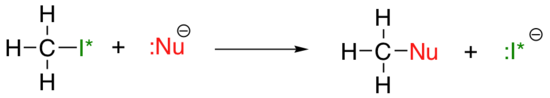
. . .onde Nu-é um dos iões haleto: fluoreto, cloreto, brometo, ou iodeto, e o Grupo I* é um isótopo radioativo de iodo (que nos permite distinguir o grupo de saída do nucleófilo, nesse caso onde ambos são iodeto). Se esta reação está ocorrendo em um protic solvente (isto é, um solvente que tem um hidrogênio ligado a um oxigênio ou nitrogênio, água, metanol e o etanol são os mais importantes exemplos) e, em seguida, a reação vai passar mais rápido quando iodeto é o nucleophile, e mais lentamente quando o flúor é o nucleophile, refletindo a força relativa das nucleophile.

nucleofilicidade relativa num solvente prótico
Este curso é oposto ao da tendência periódica vertical para a basicidade, onde o iodeto é o menos básico. O que se passa aqui? Não deveria a base mais forte, com seus elétrons de Valência, mais reativos, ser também o nucleófilo mais forte? tal como mencionado acima, tudo tem a ver com o solvente. Lembrem-se, estamos a falar da reacção a correr num solvente protético como o etanol. Moléculas de solvente Protic formam interações íon-dipolo muito fortes com o nucleófilo carregado negativamente, essencialmente criando uma ‘gaiola solvente’ em torno do nucleófilo:

para que o nucleófilo ataque o electrófilo, deve libertar-se, pelo menos em parte, da sua gaiola com solventes. O solitário par de elétrons no maior, menos básicos iões iodeto interagir menos firmemente com os prótons no protic moléculas de solvente – assim, o iodeto de nucleophile melhor é capaz de libertar-se da sua gaiola solvente comparado a menor, a mais básica de iões de fluoreto, em seu único par de elétrons estão ligados mais fortemente para os prótons da gaiola.
A imagem muda se mudarmos para um solvente aprótico polar, como a acetona, no qual há um dipolo molecular, mas sem hidrogénios ligados ao oxigénio ou ao azoto. O fluoreto é o melhor nucleófilo, e o iodeto o mais fraco.
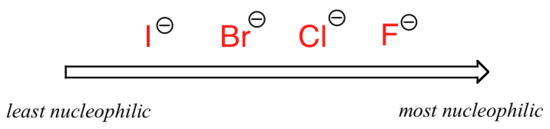
Relativo nucleophilicity de um polar aprotic solvente
A razão para a reversão é que, com um aprotic solvente, o íon-dipolo interações entre o solvente e a nucleophile são muito mais fracos: o efeito positivo do solvente do dipolo está escondido no interior da molécula, e assim ele é blindado da carga negativa do nucleophile.
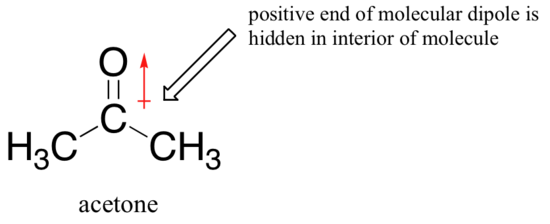
uma interação solvente-nucleófilo mais fraca significa uma gaiola solvente mais fraca para o nucleófilo romper, de modo que o efeito solvente é muito menos importante, e o ião fluoreto mais básico é também o melhor nucleófilo.
Por que não utilizar um solvente completamente não-Solar, como o hexano, para esta reacção, de modo a eliminar completamente a gaiola com solvente? A resposta a isso é simples – o nucleófilo precisa estar em solução, a fim de reagir a uma taxa apreciável com o eletrófilo, e um solvente como o hexano não solucionará um nucleófilo carregado (ou altamente polar) em tudo. É por isso que os químicos usam solventes apróticos polares para reações de substituição nucleofílica no laboratório: eles são polares o suficiente para solvar o nucleófilo, mas não tão polares a ponto de fechá-lo em uma gaiola de solvente impenetrável. Além da acetona, três outros solventes apróticos comumente usados são acetonitrilo, dimetilformamida (DMF) e sulfóxido de dimetilo (DMSO).
Em química biológica, onde o solvente é protic (água), a mais importante implicação do periódico tendências em nucleophilicity é que thiols são mais poderosos nucleophiles de álcoois. O grupo tiol em um aminoácido cisteína, por exemplo, é um poderoso nucleófilo e muitas vezes atua como um nucleófilo em reações enzimáticas, e, claro, tiolatos carregados negativamente (RS -) são ainda mais nucleofílicos. Isto não quer dizer que os grupos hidroxila em serina, treonina, e tirosina também não agem como nucleófilos – eles agem.