Objetivos
- Conhecido e desconhecido soluções dos íons metálicos \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) e \(\ce{Hg^{2+}}\) será analisada usando papel de cromatografia.
- uma solução desconhecida contendo alguns destes catiões será identificada por comparação com os valores de Rf e cores dos pontos manchados de soluções conhecidas.
a maioria dos químicos e muitos outros cientistas devem rotineiramente separar misturas e identificar seus componentes. A capacidade de identificar qualitativamente as substâncias encontradas numa amostra pode ser crítica. Por exemplo, um químico ambiental que investiga amostras de águas subterrâneas poluídas quererá saber quais íons tóxicos podem estar presentes numa amostra.a cromatografia é uma das primeiras ferramentas utilizadas nestas situações. Nesta técnica, muitos tipos de misturas podem ser separados nas substâncias puras componentes; em comparação com uma amostra padrão, cada substância componente também pode ser tentativamente identificada.existem muitas variedades de cromatografia, cada uma concebida para separar tipos específicos de misturas. A característica comum de cada tipo de cromatografia é que uma fase móvel (um líquido ou gás) é empurrada através de uma fase estacionária (um sólido). A tabela 1 lista várias variedades de cromatografia e identidades típicas das fases. A cromatografia em papel será utilizada nesta experiência.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
o exemplo de cromatografia em coluna (Figura 1) demonstra as características típicas encontradas nesta técnica analítica. O diagrama mostra um ensaio em que uma mistura de dois componentes é submetida a cromatografia em coluna. A coluna é embalada com um material sólido chamado fase estacionária. Verte-se um solvente líquido ou uma solução de eluição para a coluna e molha completamente o material de embalagem sólido. Em seguida, a mistura é carregada no topo da coluna molhada e mais eluente é adicionado. A gravidade puxa a fase móvel para baixo através da fase estacionária e os Componentes da mistura começam a mover-se através da coluna a taxas diferentes. No diagrama, o componente a move-se mais rápido que o componente B; assim, o componente B é retido na coluna por um tempo mais longo do que o componente A. normalmente isto é devido a uma diferença na solubilidade dos dois compostos no solvente e/ou a uma diferença na atração pelo material de embalagem sólida. Como mais eluente é adicionado ao topo da coluna, os componentes eventualmente sairão da coluna separadamente. O tempo necessário para sair da coluna, chamado tempo de retenção, será reprodutível para cada componente nas condições definidas—identidades de fase móveis e estacionárias, temperatura e largura da coluna. Uma vez que os componentes saem da coluna, o solvente pode ser removido por evaporação e os componentes puros podem ser mais analisados ou identificados.
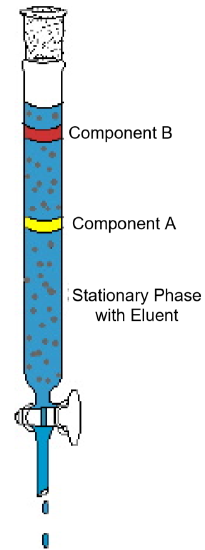
Figura 1: um ensaio típico de cromatografia em coluna demonstra a separação de uma mistura de dois componentes.se um componente conhecido tiver o mesmo tempo de retenção que um componente desconhecido nas mesmas condições, é provável—mas não conclusivo—que os dois componentes sejam os mesmos. Pode ser necessária uma análise mais aprofundada para confirmar esta hipótese. Se o conhecido e o desconhecido têm tempos de retenção diferentes, então não é provável que os dois componentes são idênticos.outras variações da cromatografia utilizam a acção capilar-a atracção de um líquido a uma superfície sólida—para puxar um solvente através de material sólido. Uma versão informal da cromatografia de papel pode ser observada quando uma página escrita a tinta entra em contato com água ou outros líquidos. A tinta corre e várias cores são separadas na sequência de tinta.o diagrama seguinte (figura 2) mostra o resultado de uma experiência cromatográfica de camada fina. Duas manchas pretas de tinta na superfície sólida tiveram um solvente passado através delas. O solvente é água ou outro líquido que é puxado através da fase estacionária por ação capilar. Neste exemplo, um pedaço de plástico revestido com um sólido em pó é usado como a fase estacionária. Alternativamente, um pedaço de papel de filtro pode ser usado como a fase estacionária. O experimento mostra que a tinta preta é uma mistura contendo várias substâncias coloridas diferentes. Cada componente tem uma solubilidade ligeiramente diferente na fase móvel, de modo que quando o líquido é puxado através da fase estacionária, cada componente se move a uma taxa diferente, separando a tinta em pontos de cores diferentes.

Figura 2: cromatografia de camada fina de tinta preta após desenvolvimento. Esta imagem demonstra um problema comum onde os pontos se alargam à medida que se movem para cima da placa, eventualmente fundindo-se no topo da placa.
neste experimento, princípios similares são usados para separar várias catiões metálicas por um procedimento de cromatografia em papel. Os metais^{+}}\), \(\ce{Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\o papel tem uma solubilidade diferente na fase móvel—aquoso \(\ce{HCl}\) com álcool etílico e butílico—e irá subir a taxas diferentes. As diferentes solubilidades de íons metálicos são provavelmente devido à formação de vários compostos com o íon cloreto e sua capacidade variável de dissolver no solvente orgânico.
um diagrama mostrando como preparar o papel é mostrado abaixo. As soluções-padrão contendo cada um destes íons serão coladas no papel utilizando um tubo capilar, juntamente com uma solução-padrão contendo todos os cinco íons. Um desconhecido também será visto no jornal. Uma vez preparado, o papel será desenvolvido colocando-o no eluente. Após 75-90 minutos, o papel é visualizado molhando-o com uma solução aquosa contendo iodeto de potássio, \(\ce{KI}\), e ferrocianeto de potássio, \(\ce{K4}\). A cor única observada para cada íon é produzida por uma reação química com a solução de visualização. Esta é uma maneira útil de identificar quais íons estão presentes em uma mistura desconhecida.
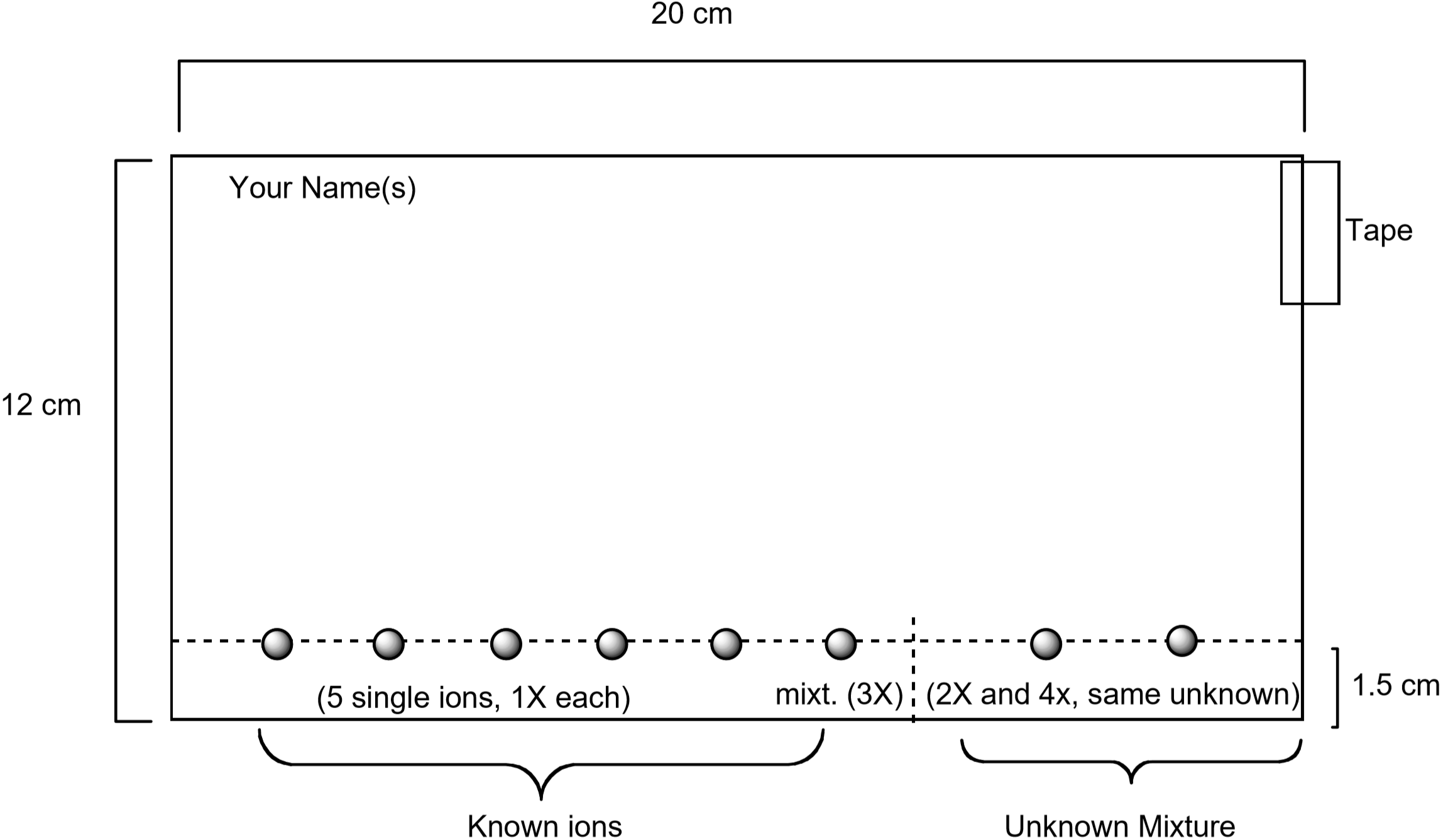
Figura 3: Diagrama mostrando como preparar o papel para o experimento cromatográfico
a distância que o íon sobe o papel também pode ser usada para identificar o íon. No entanto, uma vez que os alunos irão desenvolver as suas experiências cromatográficas para diferentes quantidades de tempo e em condições ligeiramente diferentes, cada aluno terá uma distância medida um pouco diferente para um dado íon. A relação entre a distância movida por um íon (\(D\)) e a distância movida pelo solvente (\(F\), frente do solvente) é característica e deve ser quase a mesma para todos os alunos. Esta proporção é chamada Rf, ou “fator de retenção”.”
\
Procedimento
Materiais e Equipamentos
produtos Químicos: 0.1 M soluções aquosas de \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) e \(\ce{Cu(NO3)2}\), cada um com o dedicado tubos capilares; solução de eluição (aquosa \(\ce{HCl}\) com álcool etílico e butil álcool); a visualização de solução (solução aquosa de \(\ce{KI}\) e \(\ce{4}\)).equipamento: papel para cromatografia limpo; luvas de látex descartáveis (as luvas nitrilo têm acesso na sala de stock para pessoas com alergias ao látex); copo de 600 mL; película de plástico; pinças de fórceps ou pinças; Ruler*
* artigos Obtidos da sala de stock
segurança
evitar o contacto com as soluções de iões metálicos, o solvente de eluição e a solução de visualização. Use luvas descartáveis para tocar no cromatograma após a eluição ocorrer e para o resto da experiência. Não respirar os vapores do solvente de eluição ou da solução visualizadora. Colocar o cromatograma em fase húmida numa toalha de papel, não directamente no banco de ensaios. Use a solução de visualização apenas no espaço fornecido pelo seu instrutor. Eliminar as luvas e o cromatograma no recipiente de resíduos especificado após o ensaio ter terminado. Lave cuidadosamente as mãos após o contacto com todas as soluções deste laboratório.cada par de alunos deve obter um papel de filtro com as dimensões indicadas na Figura 3. Certifique-se de que o papel está limpo e sem lágrimas ou dobras. Use um lápis—Não uma caneta-e uma régua para desenhar uma linha através do papel a um cm da borda longa do papel. Você vai ver as soluções de íon metálico nesta linha. Escreva o seu nome a lápis no canto superior esquerdo do papel.
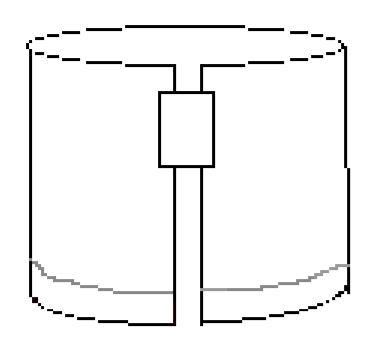
Figura 4: o papel dobrado deve ser assim antes de desenvolver a experiência.obter 15 mL da solução de eluição. Verter cuidadosamente algum deste solvente para um copo de 600 mL e rodar cuidadosamente durante um ou dois segundos. Atenção: não respirem os vapores desta solução! Certifique-se de que o nível do líquido estará abaixo da linha do ponto no papel, uma vez que o papel é colocado na câmara em desenvolvimento.colocar o cilindro de papel no copo com a aresta marcada para baixo. As manchas devem estar acima do nível do solvente. O papel não deve tocar nos lados do copo. Cuidadosamente cobrir o copo com plástico wrap e colocá-lo no capô por 75-90 minutos. O solvente deve começar a subir o papel. Uma vez que o copo está coberto, certifique-se de que é nível e não perturbá-lo durante o período de desenvolvimento. O teu instrutor pode ter uma missão para trabalhares enquanto esperas.visualização e análise do papel uma vez terminado o período de desenvolvimento, usar luvas descartáveis e remover o papel do copo. Luvas de látex estão disponíveis no laboratório e luvas de nitrilo estão disponíveis no armazém para pessoas com alergias de látex. Deixar pingar qualquer solvente de volta para o copo, em seguida, remover a fita. Colocar o papel cromatográfico numa toalha de papel e marcar imediatamente a frente do solvente com um lápis. Despeje o solvente de eluição usado no recipiente de resíduos fornecido. Secar o papel sob uma lâmpada de calor no capô. Cuidado: Não respires os vapores! Cuidado para não queimar o papel debaixo da lâmpada.uma vez que o papel esteja seco, leve-o para a estação de visualização na toalha de papel. Mergulhar brevemente o papel na solução visualizadora localizada em um prato raso no exaustor. Retire o papel da solução imediatamente e deixe cair qualquer excesso na estação. Coloque o papel molhado em uma toalha de papel seco e secá-lo sob uma lâmpada de calor imediatamente, em seguida, levá-lo para o seu banco para análise.
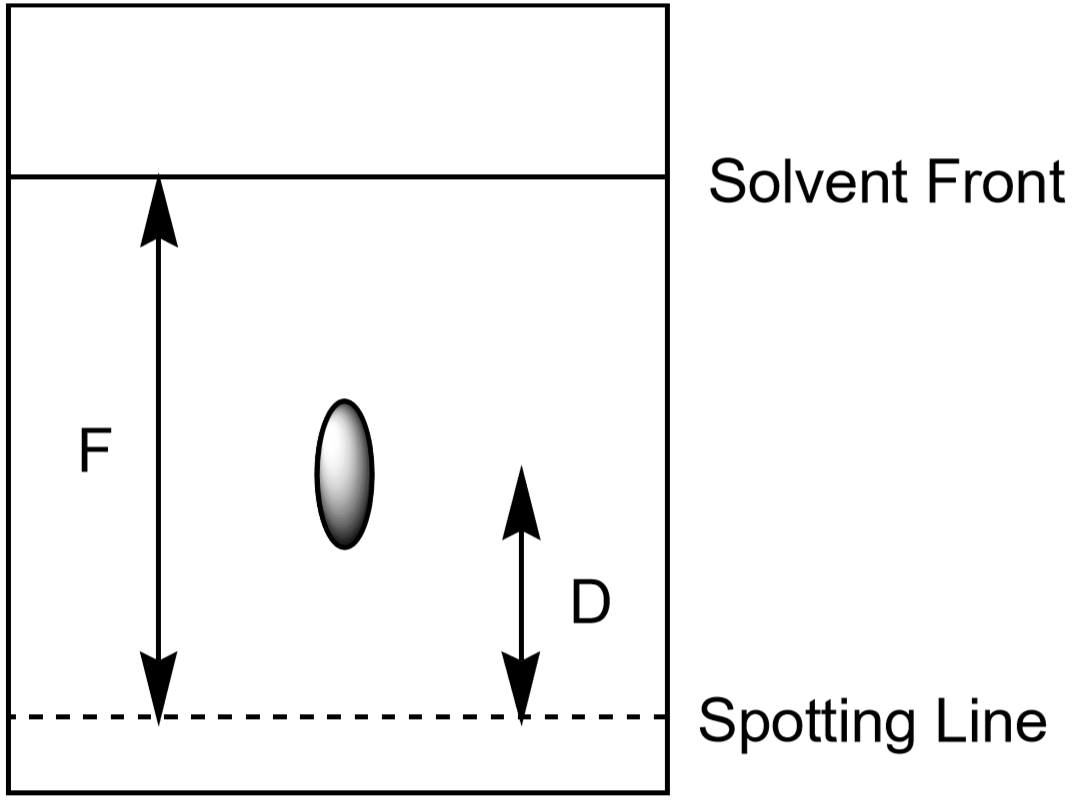
Figura 5: Medição das distâncias utilizadas no cálculo de Rf para um ponto.
- na faixa que contém a mistura, encontrar cada íon e registar a distância movida por cada íon. Calcule o Rf para cada íon nesta faixa. Os valores devem coincidir estreitamente com os observados nos conhecimentos de iões únicos.
- na faixa que contém as incógnitas, localizar o centro de cada ponto observado e registar a sua distância e calcular os valores Rf. Use a faixa que tem os pontos mais claros. Os valores de cor e Rf para os pontos desconhecidos devem corresponder de perto a alguns dos iões conhecidos. Você deve agora ser capaz de identificar quais íons são encontrados em seu desconhecido. Registe os seus dados na tabela correspondente.faça um esboço do seu cromatograma no espaço fornecido no formulário do seu relatório de laboratório, tendo a certeza de indicar a posição, tamanho e forma aproximados de cada ponto no papel. Elimine o papel no recipiente de resíduos designado.colocar o papel cromatográfico e as luvas usadas no recipiente de resíduos fornecido. A solução de eluição utilizada já deveria ter sido colocada noutro Contentor de resíduos. Note que dois contentores de resíduos diferentes são fornecidos para este experimento, por isso certifique-se de ler os rótulos para que você vai usar o correto! Não se esqueça de lavar cuidadosamente as mãos antes de sair do laboratório.
atribuição pré-laboratorial: Cromatografia em papel
- uma mistura de dois componentes é analisada por cromatografia em papel. O componente A é mais solúvel na fase móvel do que o componente B. obtém-se o seguinte resultado: Calcular o Rf para cada componente e rotular a identidade de cada ponto.
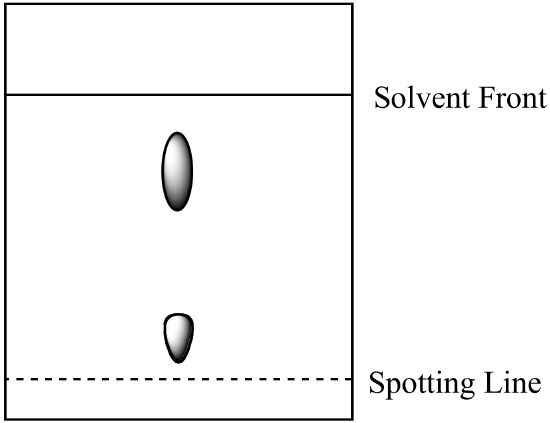
- a mistura da Pergunta 1 (acima) é analisada por cromatografia em coluna utilizando a mesma fase móvel e uma fase estacionária de sílica-gel. Qual componente tem o menor tempo de retenção? Explique a sua resposta. (Assumir o mesmo tipo de forças de ligação entre os componentes e a fase estacionária estão presentes tanto na cromatografia em papel como na cromatografia em coluna.)
- an unknown liquid sample is analyzed using paper chromatography using solvent X as the mobile phase. Observa-se um ponto após o desenvolvimento e visualização da placa. A mesma substância desconhecida é reanalisada utilizando o solvente Y como a fase móvel. Desta vez, três pontos são observados após o desenvolvimento e visualização da placa.a amostra desconhecida é uma substância pura ou uma mistura? Explique a sua resposta, incluindo uma possível razão para as diferentes observações nas duas experiências.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Desconhecido ID do Código | Íons Identificadas |
|---|---|
Perguntas e Conclusões
- o Que critérios foram usados para identificar o íon(s) encontrada no desconhecido? Explique a sua resposta em pelo menos três frases. Incluir quaisquer dificuldades na identificação de iões.se deixar a experiência correr apenas 30 minutos, Qual seria o resultado provável? Surgiriam problemas na identificação do desconhecido?
- Se \(\ce{Co^{2+}}\) e \(\CE{Cu^{2+}}\) os pontos fossem da mesma cor, a identificação de um desconhecido seria mais difícil? Explique a sua resposta.