Video \(\PageIndex{1}\): a brief introduction to the genius of Mendeleev.
início químicos trabalhou para purificar minérios e descobriu mais elementos, eles perceberam que vários elementos que podem ser agrupados por suas químicas semelhantes comportamentos. Um desses grupos inclui lítio (Li), sódio (Na) e potássio (K): Todos estes elementos são brilhantes, conduzir bem o calor e a eletricidade, e têm propriedades químicas semelhantes. Um segundo grupo inclui cálcio (Ca), estrôncio (Sr), e bário (Ba), que também são brilhantes, bons condutores de calor e eletricidade, e têm propriedades químicas em comum. No entanto, as propriedades específicas destes dois grupos são notavelmente diferentes um do outro. Por exemplo: Li, Na, E K são muito mais reativos do que Ca, Sr, e Ba; Li, Na, And K form compounds with oxygen in a ratio of two of their atoms to one oxygen atom, whereas Ca, Sr, and Ba form compounds with one of their atoms to one oxygen atom. Flúor (F), cloro (Cl), bromo (Br) e iodo (I) também exibem propriedades semelhantes umas às outras, mas essas propriedades são drasticamente diferentes das de qualquer um dos elementos acima.
Dimitri Mendeleev na Rússia (1869) e Lothar Meyer, na Alemanha (1870), independentemente reconheceu que havia um periódico relação entre as propriedades dos elementos conhecidos na época. Ambas as tabelas publicadas com os elementos dispostos de acordo com o aumento da massa atômica. Mas Mendeleev foi um passo mais longe do que Meyer: ele usou sua mesa para prever a existência de elementos que teriam propriedades semelhantes ao alumínio e silício, mas ainda eram desconhecidos. As descobertas de gálio (1875) e germânio (1886) forneceram grande apoio para o trabalho de Mendeleev. Embora Mendeleev e Meyer tenham tido uma longa disputa sobre a prioridade, as contribuições de Mendeleev para o desenvolvimento da tabela periódica são agora mais amplamente reconhecidas (figura \(\PageIndex{1}\)).
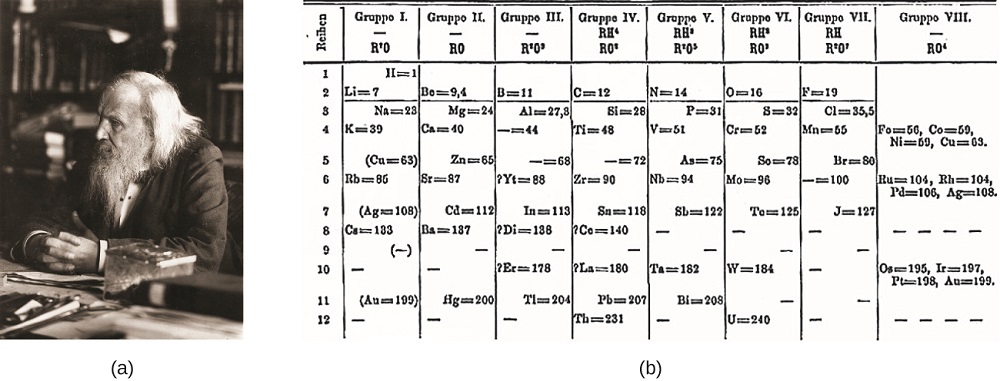
figura \(\PageIndex{1}\): (a) Dimitri Mendeleev é amplamente creditado por criar (b) a primeira tabela periódica dos elementos. (crédito: modificação de trabalho por Serge Lachinov; crédito b: modificação de trabalho por “Den fjättrade ankan”/Wikimedia Commons)
o Vídeo de \(\PageIndex{2}\): Uma introdução à organização da tabela periódica em períodos e grupos. Esta organização será importante à medida que continuarmos a construir sobre os princípios da química.
no século XX, tornou-se evidente que a relação periódica envolvia números atômicos ao invés de massas atômicas. A afirmação moderna desta relação, a lei periódica, é a seguinte: as propriedades dos elementos são funções periódicas de seus números atômicos. Uma tabela periódica moderna organiza os elementos em ordem crescente dos seus números atómicos e agrupa átomos com propriedades semelhantes na mesma coluna vertical (figura \(\PageIndex{2}\)). Cada caixa representa um elemento e contém seu número atômico, símbolo, massa atômica média e (às vezes) nome. Os elementos são dispostos em sete linhas horizontais, chamadas períodos ou séries, e 18 colunas verticais, chamadas grupos. Os grupos são rotulados no topo de cada coluna. Nos Estados Unidos, as etiquetas eram tradicionalmente Numerais com letras maiúsculas. No entanto, a IUPAC recomenda que os números 1 a 18 sejam usados, e estes rótulos são mais comuns. Para que a tabela se encaixe em uma única página, partes de duas das linhas, um total de 14 colunas, são geralmente escritas abaixo do corpo principal da tabela.

figura \(\PageIndex{2}\): Os elementos da tabela periódica estão organizados de acordo com as suas propriedades.
muitos elementos diferem dramaticamente em suas propriedades químicas e físicas, mas alguns elementos são semelhantes em seus comportamentos. Por exemplo, muitos elementos parecem brilhantes, são maleáveis (capazes de ser deformados sem quebrar) e dúctil (podem ser puxados em fios), e conduzem bem o calor e a eletricidade. Outros elementos não são brilhantes, maleáveis ou dúcteis, e são condutores pobres de calor e eletricidade. Podemos classificar os elementos em grandes classes com propriedades comuns: metais (elementos que são brilhantes, maleáveis, bons condutores de calor e de electricidade—amarelo sombreado); não metálicos (elementos que parecem maçantes, condutores pobres de calor e electricidade—verde sombreado); e metalóides (elementos que conduzem o calor e a eletricidade moderadamente bem, e possuem algumas propriedades de metais e algumas propriedades de roxo não—metálicos).
Os elementos também podem ser classificados em principal os elementos do grupo (ou de elementos representativos) nas colunas 1, 2, 13-18; os metais de transição nas colunas 3-12; interna e metais de transição em duas linhas na parte inferior da mesa (da fileira de cima elementos são chamados de lantanídeos e o inferior-linha são os elementos actinídeos; Figura \(\PageIndex{3}\)). Os elementos podem ser subdivididos por propriedades mais específicas, como a composição dos compostos que formam. Por exemplo, os elementos do grupo 1 (a primeira coluna) formam compostos que consistem de um átomo do elemento e um átomo de hidrogênio. Estes elementos (exceto hidrogênio) são conhecidos como metais alcalinos, e todos eles têm propriedades químicas similares. Os elementos do grupo 2 (a segunda coluna) formam compostos consistindo de um átomo do elemento e dois átomos de hidrogênio: estes são chamados metais alcalinos da terra, com propriedades semelhantes entre os membros desse grupo. Outros grupos com nomes específicos são os pnictogens (grupo 15), chalcogens (grupo 16), halogênios (grupo 17), e os gases nobres (grupo 18, também conhecidos como gases inertes). Os grupos também podem ser referidos pelo primeiro elemento do grupo: por exemplo, os calcógenos podem ser chamados de grupo oxigênio ou família de oxigênio. O hidrogênio é um elemento não-metálico único com propriedades similares aos elementos do grupo 1 e do grupo 17. Por essa razão, o hidrogênio pode ser mostrado no topo de ambos os grupos, ou por si mesmo.
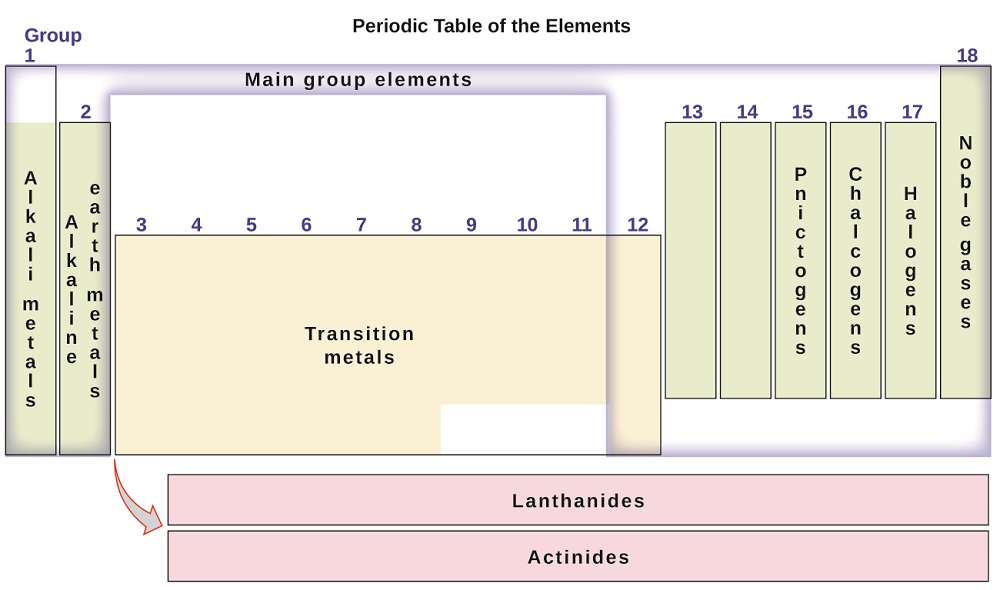
figura \(\PageIndex{3}\): a tabela periódica organiza elementos com propriedades semelhantes em grupos.
exemplo \(\PageIndex{1}\): nomear grupos de elementos
átomos de cada um dos seguintes elementos são essenciais para a vida. Indicar o nome do grupo para os seguintes elementos:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- sol
- selênio
- bário
- lítio
Resposta
o gás nobre
a Resposta b
chalcogen
a Resposta c
alcalina de metais de terras
a Resposta d
metais alcalinos
No estudo da tabela periódica, você pode ter notado algo sobre as massas atómicas de alguns elementos. O elemento 43( tecnécio), o elemento 61 (promécio), e a maioria dos elementos com número atômico 84 (polônio) e superior têm sua massa atômica dada entre parênteses rectos. Isto é feito para elementos que consistem inteiramente de isótopos radioativos instáveis (você vai aprender mais sobre a radioatividade no capítulo de Química nuclear). Um peso atômico médio não pode ser determinado para estes elementos porque seus radioisótopos podem variar significativamente em abundância relativa, dependendo da fonte, ou pode nem mesmo existir na natureza. O número entre parênteses quadrados é o número de massa atômica (e massa atômica aproximada) do isótopo mais estável desse elemento.
Summary
Video \(\PageIndex{3}\): a summary of the discovery and properties of the periodic table.
A descoberta da recorrência periódica de propriedades semelhantes entre os elementos que levaram à formulação da tabela periódica, na qual os elementos são dispostos em ordem crescente de número atômico em linhas conhecido como períodos e colunas conhecidos como grupos. Elementos do mesmo grupo da tabela periódica têm propriedades químicas similares. Elementos podem ser classificados como metais, metalóides e não metálicos, ou como elementos do grupo principal, metais de transição e metais de transição interna. Os grupos estão numerados de 1-18 da esquerda para a direita. Os elementos do grupo 1 são conhecidos como os metais alcalinos; os do grupo 2 são os alcalinos terrosos; aqueles em 15 são as pnictogens; em 16 são os chalcogens; em 17 são os halogênios; e aqueles em 18 são os gases nobres.