os Objectivos de Aprendizagem
Ao final desta seção, você será capaz de:
- Explicar as relações entre o microscópico e o macroscópico quantidades de um gás
- Resolver problemas envolvendo misturas de gases
- Resolver os problemas que envolvem a distância e o tempo entre uma molécula de gás é colisões
temos examinado a pressão e a temperatura com base no seu macroscópica definições. A pressão é a força dividida pela área sobre a qual a força é exercida, e a temperatura é medida com um termômetro. Podemos obter uma melhor compreensão da pressão e da temperatura a partir da teoria cinética dos gases, a teoria que relaciona as propriedades macroscópicas dos gases com o movimento das moléculas em que consistem. Primeiro, fazemos duas suposições sobre moléculas num gás ideal.
- existe um número muito grande de moléculas, todas idênticas e cada uma com massa M.
- as moléculas obedecem às leis de Newton e estão em movimento contínuo, que é Aleatório e isotrópico, ou seja, o mesmo em todas as direções.
Para derivar a lei dos gases ideais e a ligação entre pequenas quantidades, tais como a energia de uma molécula típica e quantidades macroscópicas, como temperatura, analisamos uma amostra de um gás ideal em um recipiente rígido, sobre o que fazemos, por mais dois pressupostos:
- as moléculas são muito menores do que a distância média entre elas, de modo que seu volume total é muito menor do que o de seu recipiente (que tem volume V). Em outras palavras, tomamos a constante b De Van der Waals, o volume de um mole de moléculas de gás, para ser negligenciável em comparação com o volume de um mole de gás no recipiente.as moléculas fazem colisões perfeitamente elásticas com as paredes do recipiente e entre si. Outras forças sobre eles, incluindo a gravidade e as atrações representadas pela constante a de Van der Waals, são negligenciáveis (como é necessário para a assunção de isotropia).
as colisões entre moléculas não aparecem na derivação da lei dos gases ideais. Eles também não perturbam a derivação, uma vez que colisões entre moléculas que se movem com velocidades aleatórias dão novas velocidades aleatórias. Além disso, se as velocidades das moléculas de gás em um recipiente não são inicialmente aleatórias e isotrópicas, colisões moleculares são o que as torna aleatórias e isotrópicas.
fazemos ainda mais suposições que simplificam os cálculos, mas não afetam o resultado. Primeiro, deixamos o contentor ser uma caixa rectangular. Em segundo lugar, começamos por considerar os gases monatômicos, aqueles cujas moléculas consistem em átomos únicos, como o hélio. Então, podemos assumir que os átomos não têm energia exceto sua energia cinética translacional; por exemplo, eles não têm energia rotacional nem vibracional. (Mais tarde, discutimos a validade desta suposição para gases monatômicos reais e dispensamos-a de considerar gases diatômicos e poliatômicos.)
figura \(\PageIndex{1}\) mostra uma colisão de uma molécula de gás com a parede de um recipiente, de modo que ele exerce uma força na parede (pela terceira lei de Newton). Estas colisões são a fonte de pressão num gás. À medida que o número de moléculas aumenta, o número de colisões, e assim a pressão, aumenta. Da mesma forma, se a velocidade média das moléculas for maior, a pressão do gás é maior.
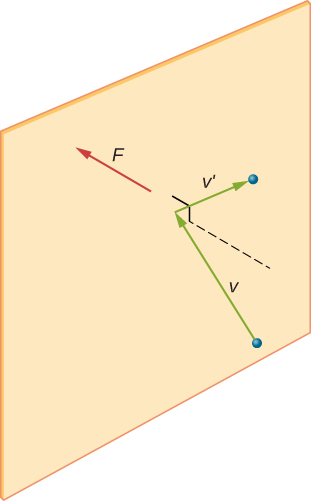
Em uma amostra de gás em um recipiente, a aleatoriedade do movimento molecular faz com que o número de colisões das moléculas com qualquer parte da parede em um determinado tempo para flutuar. No entanto, como um grande número de moléculas colidem com a parede em um curto espaço de tempo, o número de colisões nas escalas de tempo e espaço que medimos flutua por apenas uma pequena fração, geralmente não observável da média. Podemos comparar esta situação com a de um casino, onde os resultados das apostas são aleatórios e as receitas do casino flutuam ao minuto e à hora. No entanto, em longos períodos, como um ano, as receitas do casino estão muito próximas das médias esperadas das probabilidades. Um tanque de gás tem muito mais moléculas do que um cassino tem apostadores em um ano, e as moléculas fazem muito mais colisões em um segundo do que um cassino tem apostas.um cálculo da força média exercida pelas moléculas nas paredes da caixa leva-nos à Lei dos gases ideais e à ligação entre a temperatura e a energia cinética molecular. (De fato, levaremos duas médias: uma ao longo do tempo para obter a força média exercida por uma molécula com uma determinada velocidade, e outra média sobre moléculas com velocidades diferentes. Esta abordagem foi desenvolvida por Daniel Bernoulli (1700-1782), que é mais conhecido em física por seu trabalho em fluído fluído (hidrodinâmica). Notavelmente, Bernoulli fez este trabalho antes de Dalton estabelecer a visão da matéria como consistindo de átomos.
Figura \(\PageIndex{2}\) mostra um recipiente cheio de gás e uma visão expandida de uma colisão elástica de uma molécula de gás com a parede do recipiente, decompostos em componentes. Nós assumimos que uma molécula é pequena comparada com a separação de moléculas no gás, e que sua interação com outras moléculas pode ser ignorada. Nestas condições, a lei do gás ideal é experimentalmente válida. Porque nós também assumimos que a parede é rígida e as partículas são pontos, a colisão é elástica (por conservação de energia—não há nenhum lugar para a energia cinética de uma partícula ir). Portanto, a energia cinética da molécula permanece constante e, portanto, a sua velocidade e a magnitude do seu momento também permanecem constantes. Esta suposição nem sempre é válida, mas os resultados no resto deste módulo também são obtidos em modelos que permitem que as moléculas troquem energia e momento com a parede.
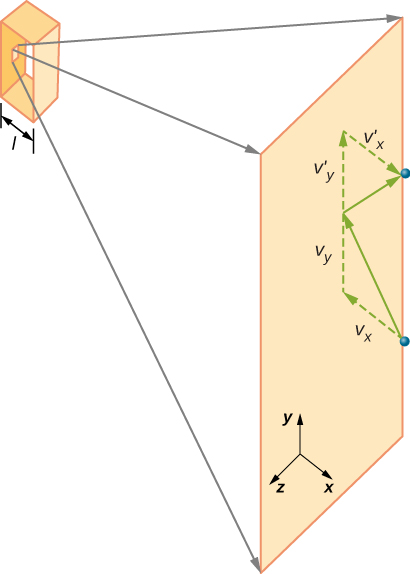
Se a velocidade da molécula muda na direcção x, o seu momento muda de \(- m_x\) para \(+mv_x\). Assim, sua mudança no momento é \(\Delta mv = + mv_x – (- mv_x) = 2mv_x\). De acordo com o teorema do impulso-momento dado no capítulo sobre momento linear e colisões, a força exercida sobre a i-ésima molécula, onde i rotula as moléculas de 1 A N, é dada por \
(só nesta equação, p representa momento, não pressão.) Não há força entre a parede e a molécula, exceto quando a molécula está tocando a parede. Durante o curto período de colisão, a força entre a molécula e a parede é relativamente grande, mas essa não é a força que procuramos. Estamos à procura da força média, então tomamos \(\Delta t\) para ser o tempo médio entre colisões da molécula dada com esta parede, que é o tempo em que esperamos encontrar uma colisão. Deixe l representar o comprimento da caixa na direção X. Então \(\Delta t\) é o tempo que a molécula levaria para atravessar a caixa e voltar, uma distância 2l, a uma velocidade de \(v_x\). Assim \(\delta t = 2l/v_x\), e a expressão para a força torna-se
\
Esta força é devida a uma molécula. Para encontrar a força total na parede, F, precisamos adicionar as contribuições de todas as moléculas N:
\
agora usamos a definição da média, que denotamos com um bar, para encontrar a força:
\
Nós queremos a força em termos de velocidade v, ao invés de incluir a componente x da velocidade. Observe que o total de velocidade ao quadrado é a soma dos quadrados de seus componentes, de modo que
\
Com a hipótese de isotropia, as três médias no lado direito são iguais, então
\
Substituindo na expressão para F dá
\
A pressão é de F/A, obtemos assim
\ onde usamos \(V = Al\) para o volume. Isto dá o importante resultado
\
Combinando esta equação com \(pV = Nk_BT\) dá
\
podemos obter a média de energia cinética de uma molécula, \(\frac{1}{2}m\overline{v}^2\), do lado esquerdo da equação, dividindo-se as N e multiplicando por 3/2.
Média de Energia Cinética por Molécula
A média de energia cinética de uma molécula é diretamente proporcional à sua temperatura absoluta:
\
A equação \(\overline{K} = \frac{3}{2} k_BT\) é a média de energia cinética por molécula. Note, em particular, que nada nesta equação depende da massa molecular (ou qualquer outra propriedade) do gás, da pressão, ou de qualquer outra coisa além da temperatura. Se amostras de gás de hélio e xénon, com massas moleculares muito diferentes, estão na mesma temperatura, as moléculas têm a mesma energia cinética média.a energia interna de um sistema termodinâmico é a soma das energias mecânicas de todas as moléculas nele contidas. Agora podemos dar uma equação para a energia interna de um gás ideal monatômico. Em tal gás, a única energia das moléculas é a sua energia cinética translacional. Portanto, denotando a energia interna por \(E_{int}\), nós simplesmente temos \(E_{int} = N\overline{K}\), ou
\
muitas Vezes nós gostaríamos de usar esta equação em termos de moles:
\
Nós podemos resolver \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) para uma velocidade típica de uma molécula de um gás ideal, em termos de temperatura para determinar o que é conhecido como a root-mean-square (rms) a velocidade de uma molécula.
RMS Velocidade de uma Molécula
A root-mean-square (rms) a velocidade de uma molécula, ou a raiz quadrada da média do quadrado da velocidade de \(\overline{v}^2\), é
\
O rms velocidade não é o médio ou o mais provável a velocidade das moléculas, como veremos na Distribuição de Velocidades Moleculares, mas fornece uma facilmente calculada a estimativa de moléculas ” de velocidade que está relacionado com a sua energia cinética. Mais uma vez podemos escrever esta equação em termos da constante de gás R e da massa molar M em kg / mol:
\
nós digerimos por um momento para responder a uma pergunta que pode ter ocorrido a você: quando aplicamos o modelo para átomos em vez de partículas pontuais teóricas, a energia cinética rotacional muda nossos resultados? Para responder a esta pergunta, temos de apelar à mecânica quântica. Na mecânica quântica, a energia cinética rotacional não pode assumir qualquer valor; ela está limitada a um conjunto discreto de valores, e o menor valor é inversamente proporcional à inércia rotacional. A inércia rotacional de um átomo é pequena porque quase toda a sua massa está no núcleo, que normalmente tem um raio inferior a \(10^{-14} m\). Assim, a energia mínima de rotação de um átomo é muito mais do que \(\frac{1}{2}k_ BT\) para qualquer temperatura atingível, e a energia disponível não é suficiente para fazer um átomo rodar. Voltaremos a este ponto quando discutirmos os gases diatómicos e poliatómicos na próxima secção.
exemplo \(\PageIndex{1}\): Calculando a energia cinética e a velocidade de uma molécula de gás
- Qual é a energia cinética média de uma molécula de gás a \(20.0^oC\) (temperatura ambiente)?
- Encontre a velocidade rms de uma molécula de azoto (\(N_2\)) a esta temperatura.
a Estratégia
(a) conhecidos na equação para a média de energia cinética é a temperatura:
\
Antes de substituir os valores na equação, temos de converter os dados de temperatura em kelvin: \(T = (20.0 + 273) \, K = 293 \, K\). Podemos encontrar a velocidade rms de uma molécula de nitrogênio usando a equação
\
mas devemos primeiro encontrar a massa de uma molécula de nitrogênio. A obtenção da massa molar de nitrogênio \(N_2\) da tabela periódica, encontramos
\
Solução
- A temperatura por si só é suficiente para nós, para encontrar a média de translação em energia cinética. Substituindo a temperatura para o de translação em energia cinética equação fornece \
- Substituindo a massa e o valor para \(k_B\) para a equação \(v_{rms}\) rendimentos \
Significância
Note-se que a média da energia cinética da molécula é independente do tipo de molécula. A energia cinética translacional média depende apenas da temperatura absoluta. A energia cinética é muito pequena em comparação com as energias macroscópicas, de modo que não sentimos quando uma molécula de ar está atingindo nossa pele. Por outro lado, é muito maior do que a diferença típica na energia potencial gravitacional quando uma molécula se move, digamos, do alto para o fundo de uma sala, pelo que a nossa negligência da gravitação se justifica em situações típicas do mundo real. A velocidade rms da molécula de nitrogênio é surpreendentemente grande. Estas grandes velocidades moleculares não produzem movimento macroscópico do ar, uma vez que as moléculas se movem em todas as direções com igual probabilidade. O caminho livre médio (a distância que uma molécula se move em média entre colisões, discutido um pouco mais tarde nesta seção) de moléculas no ar é muito pequeno, então as moléculas se movem rapidamente, mas não chegam muito longe em um segundo. O alto valor para a velocidade rms reflete-se na velocidade do som, que é de cerca de 340 m/s à temperatura ambiente. Quanto maior a velocidade rms das moléculas de ar, mais rápidas as vibrações sonoras podem ser transferidas através do ar. A velocidade do som aumenta com a temperatura e é maior nos gases com pequenas massas moleculares ,como o hélio (ver Figura \(\PageIndex{3}\)).
Exemplo de \(\PageIndex{2}\): Cálculo da Temperatura: Velocidade de Escape de Átomos de Hélio
Para escapar da gravidade da Terra, um objeto perto do topo da atmosfera a uma altitude de 100 km), devem viajar para longe de Terra 11.1 km/s. Esta velocidade é chamada velocidade de escape. A que temperatura os átomos de hélio teriam uma velocidade rms igual à velocidade de escape?
estratégia
identificar os conhecimentos e incógnitas e determinar quais equações usar para resolver o problema.
Solução
- Identificar o conhecimento: v é a velocidade de escape, 11.1 km/s.
- Identificar as incógnitas: precisamos resolver para temperatura, T. Nós também precisamos resolver para a massa m do átomo de hélio.
- determina quais as equações que são necessárias. para obter a massa m do átomo de hélio, podemos usar informações da tabela periódica: \
- Para resolver para a temperatura T, podemos reorganizar \ rendimento \
- Substituir os valores conhecidos para as equações e resolver as incógnitas, \ e \
Significância
Esta temperatura é muito mais alta do que a temperatura atmosférica, que é de aproximadamente 250 K (\(-25^oC\) ou \(-10^o\)) em alta de elevação. Muito poucos átomos de hélio são deixados na atmosfera, mas muitos estavam presentes quando a atmosfera foi formada, e mais estão sempre sendo criados pelo decaimento radioativo (veja o capítulo sobre física nuclear). A razão para a perda de átomos de hélio é que um pequeno número de átomos de hélio tem velocidades mais altas do que a velocidade de escape da terra, mesmo em temperaturas normais. A velocidade de um átomo de hélio muda de uma colisão para a seguinte, de modo que a qualquer instante, há uma pequena mas não zero chance de que a velocidade do átomo é maior do que a velocidade de escape. A chance é alta o suficiente que ao longo da vida da Terra, quase todos os átomos de hélio que estiveram na atmosfera atingiram velocidade de escape em altas altitudes e escaparam da atração gravitacional da Terra. Moléculas mais pesadas, como oxigênio, nitrogênio e água, têm velocidades rms menores, e por isso é muito menos provável que qualquer uma delas tenha velocidades maiores que a velocidade de escape. De fato, a probabilidade é tão pequena que bilhões de anos são necessários para perder quantidades significativas de moléculas mais pesadas da atmosfera. A figura \(\PageIndex{4}\) mostra o efeito da falta de uma atmosfera na Lua. Como a força gravitacional da Lua é muito mais fraca, perdeu quase toda a sua atmosfera. As atmosferas da terra e de outros corpos são comparadas nos Exercícios Deste capítulo.

Exercício de \(\PageIndex{2}\)
Se você considerar um objeto muito pequeno, como um grão de pólen, em um gás, em seguida, o número de moléculas de surpreendente a sua superfície também seria relativamente pequeno. Seria de esperar que o grão de pólen experimentasse flutuações de pressão devido a flutuações estatísticas no número de moléculas de gás que o atingem numa dada quantidade de tempo?resposta sim. Tais flutuações realmente ocorrem para um corpo de qualquer tamanho em um gás, mas como o número de moléculas é imenso para corpos macroscópicos, as flutuações são uma pequena porcentagem do número de colisões, e as médias faladas nesta seção variam imperceptivelmente. Grosso modo, as flutuações são inversamente proporcionais à raiz quadrada do número de colisões, de modo que para os pequenos corpos, eles podem se tornar significativos. Isto foi realmente observado no século XIX para grãos de pólen na água e é conhecido como movimento browniano.
pressão de Vapor, pressão parcial, e Lei de Dalton
a pressão que um gás criaria se ocupasse o volume total disponível é chamada de pressão parcial do gás. Se dois ou mais gases forem misturados, eles chegarão ao equilíbrio térmico como resultado de colisões entre moléculas.; o processo é análogo à condução de calor como descrito no capítulo sobre temperatura e calor. Como vimos na teoria cinética, quando os gases têm a mesma temperatura, as suas moléculas têm a mesma energia cinética média. Assim, cada gás obedece à Lei do gás ideal separadamente e exerce a mesma pressão sobre as paredes de um recipiente que faria se estivesse sozinho. Portanto, em uma mistura de gases, a pressão total é a soma das pressões parciais dos gases componentes, assumindo o comportamento ideal dos gases e sem reações químicas entre os componentes. Esta lei é conhecida como Lei de Dalton de pressões parciais, depois do cientista inglês John Dalton (1766-1844) que a propôs. A lei de Dalton é consistente com o facto de as pressões aumentarem De acordo com o princípio de Pascal.numa mistura de gases ideais em equilíbrio térmico, o número de moléculas de cada gás é proporcional à sua pressão parcial. Este resultado resulta da aplicação da lei do gás ideal a cada um na forma \(p/n = RT / V\). Porque o lado direito é o mesmo para qualquer gás a uma dada temperatura em um recipiente de um determinado volume, o lado esquerdo é o mesmo também.
- pressão parcial é a pressão que um gás criaria se existisse sozinho.a lei de Dalton afirma que a pressão total é a soma das pressões parciais de todos os gases presentes.
- Para qualquer dois gases (marcado como 1 e 2) em equilíbrio em um recipiente, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
uma aplicação importante de pressão parcial é que, em química, ele funciona como a concentração de um gás na determinação da taxa de uma reação. Aqui, mencionamos apenas que a pressão parcial do oxigênio nos pulmões de uma pessoa é crucial para a vida e saúde. Ar respiratório que tem uma pressão parcial de oxigênio abaixo de 0.16 atm pode prejudicar a coordenação e julgamento, particularmente em pessoas não aclimatados a uma alta elevação. Pressões parciais menores de \(O_2\) têm efeitos mais graves; pressões parciais abaixo de 0,06 atm podem ser rapidamente fatais, e danos permanentes é provável, mesmo se a pessoa é resgatada. No entanto, a sensação de necessidade de respirar, como quando se sustém a respiração, é causada muito mais por altas concentrações de dióxido de carbono no sangue do que por baixas concentrações de oxigénio. Assim, se uma pequena sala ou armário é preenchido com ar tendo uma baixa concentração de oxigênio, talvez porque um cilindro vazando de algum gás comprimido é armazenado lá, uma pessoa não vai sentir qualquer sensação de “asfixia” e pode entrar em convulsões ou perder a consciência sem notar nada de errado. Os engenheiros de segurança dão grande atenção a este perigo.outra importante aplicação da pressão parcial é a pressão de vapor, que é a pressão parcial de um vapor em que ele está em equilíbrio com a fase líquida (ou sólida, no caso de sublimação) da mesma substância. Em qualquer temperatura, a pressão parcial da água no ar, não pode exceder a pressão de vapor da água a essa temperatura, porque sempre que a pressão parcial atinge a pressão de vapor, a água condensa-se fora do ar. O orvalho é um exemplo desta condensação. A temperatura a que a condensação ocorre para uma amostra de ar é chamada de ponto de orvalho. O ponto de orvalho é a temperatura a que a condensação aparece pela primeira vez na bola.
As pressões de vapor da água a algumas temperaturas de interesse para a meteorologia são indicadas no quadro\(\PageIndex{1}\).
| T(\(^oC\)) | Pressão de Vapor (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) a uma temperatura T é definida por
\
Uma umidade relativa de \(100\%\) significa que a pressão parcial da água é igual à pressão de vapor; em outras palavras, o ar está saturado com água.
exemplo \(\PageIndex{3}\): calcular a humidade relativa
Qual é a humidade relativa quando a temperatura do ar é \(25^oC\) e o ponto de orvalho é \(15^oC\)?
estratégia
simplesmente olhamos para cima a pressão de vapor na temperatura dada e que no ponto de orvalho e encontrar a razão.
Solução
\
Significância
R. H. é importante para o nosso conforto. O valor de \(53,8\%\) está dentro do intervalo de \(40\%\) a \(60\%\) recomendado para conforto no interior.como observado no capítulo sobre temperatura e calor, a temperatura raramente cai abaixo do ponto de orvalho, porque quando atinge o ponto de orvalho ou ponto de geada, a água condensa e libera uma quantidade relativamente grande de calor latente de vaporização.
caminho livre Médio e tempo livre Médio
agora consideramos as colisões explicitamente. O primeiro passo usual (que é tudo que vamos tomar) é calcular o caminho livre médio, \(\lambda\), a distância média de uma molécula de viagens entre colisões com outras moléculas, e a média de tempo livre \(\tau\), o tempo médio entre as colisões de uma molécula. Se assumirmos que todas as moléculas são esferas com um raio \(r\), então uma molécula colidirá com outra se seus centros estiverem a uma distância 2r um do outro. Para uma dada partícula, dizemos que a área de um círculo com esse raio, \(4\pi r^2\), é a “secção transversal” para Colisões. À medida que a partícula se move, ela traça um cilindro com essa área transversal. O caminho livre médio é o comprimento \(\lambda\) de tal forma que o número esperado de outras moléculas num cilindro de comprimento \(\lambda\) e a secção transversal \(4\pi r^2\) é 1. Se nós ignorar temporariamente o movimento das moléculas diferente do que estamos observando, o número esperado é o número de densidade de moléculas, N/V, vezes o volume, e o volume é \(4\pi r^2 \lambda\), então temos que \((N/V)4\pi r^2 \lambda = 1\), ou
\
, Tendo o movimento de todas as moléculas em conta faz o cálculo muito mais difícil, mas a única mudança é um fator de \(\sqrt{2}\). O resultado é
\
Em um gás ideal, podemos substituir \(V/N = k_BT/p\) para obter
\
A média do tempo livre \(\tau\) é simplesmente o caminho livre médio dividido por uma velocidade normal, e a escolha usual é o rms velocidade. Então
\
calculando o tempo livre médio
encontre o tempo livre médio para átomos de árgon (\(M = 39.9 \, g / mol\)) a uma temperatura de \(0^oC\) e uma pressão de 1,00 atm. Tome o raio de um átomo de árgon como \(1, 70 \vezes 10^{-10}\espaço m\).
solução
- Identificar os conhecimentos e converter em unidades SI. Sabemos que a massa molar é 0.0399 kg/mol, a temperatura de 273 K, a pressão é \(1.01 \times 10^5 \, Pa\), e o raio é \(1.70 \times 10^{-10} \ m\).
- Encontre a velocidade rms: \(v_{rms} = \sqrt{\frac{3RT}{m}} = 413 \, m / S\).
- Substituir na equação para a média de tempo livre: \
Significância
dificilmente podemos comparar este resultado com a nossa intuição sobre as moléculas do gás, mas que nos dá uma imagem de moléculas que colidem com elevada frequência.
exercício \(\PageIndex{4}\)
que tem um caminho livre médio mais longo, água líquida ou vapor de água no ar?
Resposta
num líquido, as moléculas estão muito próximas umas das outras, colidindo constantemente umas com as outras. Para que um gás seja quase ideal, como o ar está em condições normais, as moléculas devem estar muito distantes. Portanto, o caminho livre médio é muito mais longo no ar.
Colaboradores e Atribuições
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), e Bill Moebs com muitos autores. Este trabalho é licenciado pela Universidade de Física da OpenStax sob uma licença Creative Commons Attribution (por 4.0).