Orbitais Moleculares de um Allylic Carbocation
A estabilidade do carbocation de propeno é devido a um conjugado de elétrons π do sistema. Um “laço duplo” não existe. Em vez disso, é um grupo de 3 orbitais p adjacentes, sobrepostos, não hibridizados que chamamos de Sistema de elétrons π conjugados. Você pode ver claramente as interações entre os três orbitais p dos três carbonos resultando em um cátion realmente estável. Tudo se resume a onde está a localização do carbono deficiente em electrões.
Descrições orbitais moleculares podem explicar a estabilidade alílica de outra forma usando 2-propenilo. Figo.6
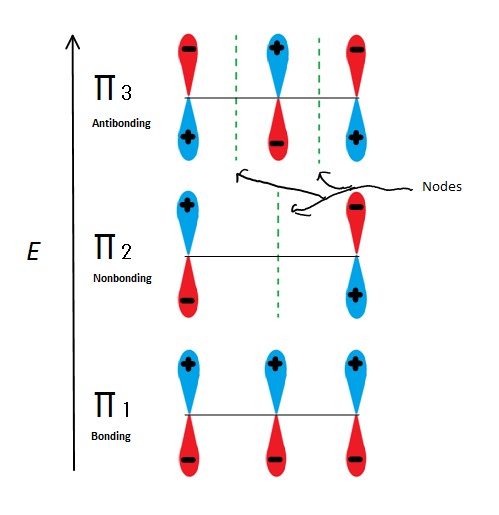
Fig.6 mostra os 3 orbitais moleculares possíveis de 2-propenil
se tomarmos apenas o orbital molecular π e não qualquer um dos s, teremos três deles. π1 is bonding with no no nodes, π2 is nonbonding (In other words, the same energy as a regular p-orbital) with a node, and π3 is antibonding with 2 nodes (none of the orbitals are interacting). Os dois primeiros elétrons irão para o orbital molecular π1, independentemente de ser um catião, radical ou anião. Se é um radical ou anião, o próximo elétron vai para o orbital molecular π2. O último elétron de anião vai para o orbital não ligante também. Então, não importa que tipo de centro de carbono exista, nenhum elétron jamais entrará no orbital antibonding.
os orbitais de ligação são os orbitais de menor energia e são favoráveis, razão pela qual são preenchidos primeiro. Mesmo que os orbitais não-ligantes podem ser preenchidos, a energia global do sistema ainda é menor e mais estável devido aos orbitais moleculares cheios de ligação.
esta figura também mostra que π2 é o único orbital molecular onde o eletrião difere, e é também onde um único nó passa pelo meio. Por causa disso, as cargas da molécula são principalmente sobre os dois carbonos terminais e não o carbono Médio.Esta descrição orbital molecular pode também ilustrar a estabilidade dos centros de carbono alílicos na Figura 7.
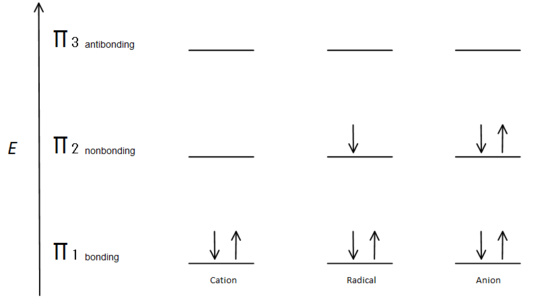
Fig.7 diagram showing how the electrons fill based on the Aufbau principle.
The π bonding orbital is lower in energy than the nonbonding p orbital. Uma vez que cada centro de carbono mostrado tem dois elétrons na energia inferior, ligando orbitais π, a energia de cada sistema é baixada em geral (e, portanto, mais estável), independentemente de catião, radical, ou anião.