Ziprasidone versus Olanzapine in de gewichtstoename geassocieerd met de behandeling van schizofrenie: een zes maanden durende dubbelblinde gerandomiseerde parallelgroepstudie
Enric Álvarez*; Miguel Bernardo**; José Ramón Gutiérrez Casares***; Ángel L. Montejo****
* Departement van psychiatrie. Hospital De La Santa Creu i Sant Pau. CIBERSAM, Universitat Autónoma de Barcelona, IBSantpau Barcelona. Spanje * * Departement Psychiatrie, Hospital Clinic de Barcelona, CIBERSAM, Universiteit van Barcelona, IDIBAPS, Barcelona. Spanje * * * Universitair ziekenhuiscomplex van Badajoz. Extremadura Health Service, Badajoz. Spanje * * * * Universitair Ziekenhuis van Salamanca. School voor Geneeskunde, Universiteit van Salamanca, Salamanca. Spanje
deze studie werd gefinancierd door Pfizer.
correspondentie
ABSTRACT
achtergrond en doelstellingen: Eerdere gegevens uit veiligheidsanalyses geven aan dat olanzapine kan resulteren in substantiële gewichtstoename, terwijl er geen verandering is waargenomen met ziprasidon. Obesitas kan een bedreiging zijn voor de gezondheid en ervoor zorgen dat proefpersonen stoppen met hun antipsychotische medicatie. Om de differentiële effecten van ziprasidon en olanzapine op de gewichtstoename verder te evalueren, werd een studie uitgevoerd met het lichaamsgewicht als primaire eindpunt voor de werkzaamheid.
methoden: Een gerandomiseerd, dubbelblind, parallel onderzoek van zes maanden werd uitgevoerd bij mannelijke en vrouwelijke proefpersonen in de leeftijd van 18-70 jaar met een primaire diagnose schizofrenie (DSM-IV-TR) en een klinische aandoening waarbij de behandeling met een nieuw antipsychoticum, ziprasidon of olanzapine 1:1 moest worden gestart om behandelingsgerelateerde gewichtsveranderingen te beoordelen. Er waren vijftig patiënten bij betrokken. De werkzaamheidsresultaten werden beoordeeld bij baseline en in week 1, 4, 12, 18 en 24. Het primaire werkzaamheidseindpunt was de procentuele verandering ten opzichte van baseline in lichaamsgewicht in week 24. De veiligheid werd ook beoordeeld.
resultaten: In week 24 was er een significant grotere gewichtstoename (7,5%, p <0,0001) bij patiënten behandeld met olanzapine dan bij patiënten behandeld met ziprasidon en het aantal patiënten dat een gewichtstoename had > 7% was significant hoger in de olanzapine groep in vergelijking met de ziprasidon groep (n = 11 ) vs n = 3 ; OR = 6.246, p-waarde = 0,0150). PANNS-N nam significant af in beide groepen. De meeste bijwerkingen waren matig of mild in beide groepen. conclusies: Olanzapine verhoogt het lichaamsgewicht significant ten opzichte van ziprasidon in week 24. Behandeling met ziprasidon of olanzapine verbeterde echter de PANSS-positieve, negatieve en algemene psychopathologische scores en werd goed verdragen.
sleutelwoorden: antipsychotica; gewichtstoename; Ziprasidone; Olanzapine; obesitas.
Inleiding
schizofrene patiënten vertonen een hogere prevalentie van obesitas, glucose-intolerantie en type 2 diabetes mellitus, met een genetische link naar enzymen die betrokken zijn bij glycolysis1,2, en een hoger aantal cardiovasculaire gebeurtenissen3. Bovendien worden veel antipsychotica van de tweede generatie geassocieerd met een hoger risico op gewichtstoename2,4, insulineresistentie, hyperglycemie en dyslipidemie5. De combinatie van deze verschillende factoren, genetische gevoeligheid, een sedentaire levensstijl en een slecht dieet en de bijwerkingen van de behandeling met antipsychotica vormen een belangrijke risicofactor voor hart-en vaatziekten bij patiënten die met atypische antipsychotica worden behandeld6. Obesitas is niet alleen een bedreiging voor de gezondheid en de levensduur, maar het kan er ook toe leiden dat proefpersonen stoppen met hun antipsychoticum.7zowel ziprasidon als olanzapine zijn efficiënte atypische antipsychotica, vaak gebruikt bij de behandeling van schizofrenie en schizoïde stoornissen. Atypische antipsychotica vertonen een betere werkzaamheid en minder bijwerkingen dan typische antipsychotica 8, 9. Ze zijn echter nog steeds vatbaar voor het veroorzaken van ongewenste effecten, waaronder hypostatische hypotensie10, somnolentie11, gewichtstoename1, 2,dyslipidemie12, hyperglycemie en diabetes mellitus5 en hyperprolactinemie, die vruchtbaarheidsproblemen, seksuele disfunctie en verminderde botmineraaldichtheid kunnen veroorzaken 13,14.
eerdere studies hebben geen veranderingen in gewicht of metabolisme aangetoond bij proefpersonen die werden behandeld met ziprasidon1, 2, 15, ziprasidon vertoont een lage neiging om extrapiramidale bijwerkingen (EPS) of laboratoriumafwijkingen te veroorzaken 8,16 en 17,en heeft geen negatieve invloed op de seksuele functie van schizofrene patiënten18. Van Ziprasidone is gemeld dat het gewichtsverlies en afname van serumlipiden19,20 veroorzaakt.
Olanzapine is een van de meest voorgeschreven antipsychotica met bewezen werkzaamheid tegen schizofreniesymptomen21-23. Olanzapine behoort echter tot de atypische antipsychotica die gewichtstoename induceren24,25, en wordt ook geassocieerd met substantiële toenamen van totaal cholesterol, triglyceriden, LDL en nuchtere insulin20,26,27. In eerdere onderzoeken waarin ziprasidon Versus olanzapine werd vergeleken, uitsluitend of in combinatie met andere behandelingen, vertoonde olanzapine significant grotere gewichtstoename en BMI en een grotere kans op snelle gewichtstoename dan bij andere behandelingen7,20,26 en 27. Al deze onderzoeken hadden echter een werkzaamheidsvariabele als primaire variabele, namelijk de gewichtsbeoordeling slechts een deel van het veiligheidsonderzoek.
antipsychotische behandelingen zijn vaak langdurig en het is noodzakelijk om het verhoogde risico op metabole veranderingen in de patiëntenzorg in overweging te nemen. Daarom werd deze gerandomiseerde, dubbelblinde studie ontworpen om specifiek het probleem van gewichtstoename op de lange termijn (6 maanden) aan te pakken, omdat dit de primaire variabele is. Ook, gezien het feit dat andere factoren gerelateerd zijn aan de dispositie van patiënten en de naleving van de behandeling, beoordeelde deze studie de kwaliteit van leven, algemeen functioneren, voorkeuren en houding ten opzichte van de behandeling, om meer informatie te verschaffen over kwesties die bij deze langdurige behandelingen moeten worden aangepakt en om hun relatie met het hoofddoel te bespreken.
methoden
een zes maanden durend gerandomiseerd, multicenter, parallel, dubbelblind onderzoek werd uitgevoerd van April 2003 tot februari 2007 om de effecten van ziprasidone versus olanzapine op het lichaamsgewicht te schatten en te vergelijken bij de behandeling van patiënten met schizofrenie.
het onderzoek werd uitgevoerd in 11 centra in Spanje. Mannelijke of vrouwelijke proefpersonen in de leeftijd van 18-70 jaar met een primaire diagnose van schizofrenie, volgens de DSM-IV-TR28, en een klinische aandoening waarbij de behandeling met een nieuw antipsychoticum moest worden gestart, werden opgenomen. Patiënten, of hun wettelijke vertegenwoordiger, gaven hun geïnformeerde toestemming. Uitsluitingscriteria: de geschiedenis van klinisch significante lichamelijke ziekte of ECG-afwijkingen (bijv. QTc > 500 ms) klinisch significante abnormale laboratoriumwaarden, epilepsie, toevallen, neurochirurgie, geen reactie of vorige intolerantie voor olanzapine of ziprasidone; zwangerschap of lactatie; serologisch bewijs van HIV of hepatitis; behandeling met drugs binnen de 6 maanden voorafgaand aan de screening; de patiënt niet in staat is of met moeilijkheden om te voldoen aan de studie protocol; onmiddellijk risico op het plegen van schade aan zichzelf of anderen; gelijktijdige behandeling met antipsychotica na randomisatie; depot antipsychotica medicatie binnen een maand na binnenkomst; behandeling met antidepressiva of stemmingsstabilisatoren binnen twee weken na randomisatie; middelenmisbruik binnen de voorafgaande 3 maanden; organische mentale ziekte; behandeling met een onderzoek klinische geneesmiddelen binnen 30 dagen voor randomisatie.de studie werd ontwikkeld in overeenstemming met de Verklaring van Helsinki29 en het studieprotocol werd goedgekeurd door de ethische commissies die overeenkomen met de betrokken centra en door de afdeling geneesmiddelen voor menselijk gebruik van het Spaanse Agentschap voor Geneeskunde en gezondheidsproducten (AEMPS).
patiënten werden in de studie opgenomen 12 uur na de vorige dosis antipsychotica, behalve patiënten die behandeld werden met een depot antipsychoticum (zie hierboven), en werden willekeurig ingedeeld in een verhouding van 1:1.
Behandelingsdosering en bezoekschema
dosering was flexibel binnen 3 niveaus: Laag (ziprasidone 40 mg BID of olanzapine 5 mg BID), Medium (ziprasidone 60 mg BID of olanzapine 15 mg QD) en hoog (ziprasidone 80 mg BID of olanzapine 10 mg BID). De behandeling werd gestart met een lage dosis gedurende dag 1-7 en vanaf DAG 3 kon de dosis worden aangepast.
de behandelingsfase (6 maanden) omvatte 6 bezoeken: dag 1 (Week 0), Week 1, Week 4, Week 12, Week 18 en Week 24. Follow-up bezoek (Week 48) uitgevoerd zes maanden na voltooiing van de behandeling. Studiemedicatie werd gemeld van bezoek 1 tot en met 6. Patiënten die op enig moment tijdens het onderzoek onvoldoende respons vertoonden, zoals blijkt uit een CGI-I-score (Clinical Global Impression of Improvement) van ≥ 6, werden gestopt.
werkzaamheids-en veiligheidsbeoordelingen
De gemeten werkzaamheidsresultaten waren gewicht, BMI en tailleomtrek (WC); bloeddruk en pols; De positive and negative syndrome scale (PANSS)30; de Clinical Global Impression (CGI) scale31 en een andere for improvement (CGI-I); de fysieke activiteit van de patiënt; de patiënt preference scale (PPS), om de tevredenheid van de patiënt met medicatie te meten; de Spaanse versie van de Health Utilities Index-Mark 3 (HUI-3)32,22. De eetlust werd gemeten met een visuele analoge schaal (VAS), een subjectieve kwantificeringsmethode. De patiënt markeert zijn / haar eetlust niveau sinds het laatste bezoek op een horizontale lijn gemarkeerd 0 (geen eetlust) links en 10 (zeer hongerig) rechts. De afstand tot 0 wordt dan gemeten in cm en het eetlustniveau gekwantificeerd.
alle werkzaamheidsresultaten werden beoordeeld bij bezoek 1 (uitgangswaarden) en daarnaast: CGI-S, CGI-I en PANSS van Bezoek 2 tot 7, eetlust en lichamelijke activiteit van de patiënt van Bezoek 3 tot 6, PPS en HUI-3 bij bezoek 4 en 6
Veiligheidsevaluaties omvatten klinische monitoring, elektrocardiogrammen, vitale functies, bijwerkingen en laboratoriumtesten voor de veiligheid. Veiligheidsbeoordelingen werden gerapporteerd volgens de Worldwide Safety Standards (WSS) versie 3 vereisten.
statistische analyse
alle analyses werden uitgevoerd op de intent-to-treat (ITT) populatie, met behulp van de SAS® versie 8.2 of hoger. Statistische tests waren 2 tailed en p-waarden van 0.05 of kleiner werden statistisch significant geacht. De behandeling werd als categorisch ingericht. 95% betrouwbaarheidsintervallen (BI) werden geconstrueerd rond Alle geschatte behandelingsverschillen. Alle veranderingen werden geanalyseerd door analyse van covariantie (ANCOVA), inclusief effecten voor de behandelingsgroep en uitgangswaarde (indien van toepassing). Beschrijvende statistieken werden gebruikt om alle veiligheidsbeoordelingen samen te vatten. Bijwerkingen werden gecodeerd volgens het Medical Dictionary for Regulatory Activities (MedDRA). Er werden geen formele statistische tests uitgevoerd op veiligheidsparameters.
resultaten
dispositie van proefpersonen en geneesmiddeldosis
hoewel de studie aanvankelijk bedoeld was voor 112 patiënten, werden in de onderzoeksperiode slechts 58 proefpersonen gescreend. Tot slot werden 50 ITT-patiënten opgenomen: 27 voor ziprasidon en 23 voor olanzapine. Tijdens de studieperiode staakten in totaal 29 patiënten hun behandeling (19 in de ziprasidongroep en 10 in de olanzapine). Hoewel de meeste stopzettingen niet gerelateerd waren aan het onderzoeksgeneesmiddel, waren 2 (één in elke groep) het gevolg van een gebrek aan werkzaamheid en 7 (5 in de ziprasidon en 2 in de olanzapine) het gevolg van geneesmiddelgerelateerde bijwerkingen. De mediane duur van de behandeling was lager voor de ziprasidon (52,5 dagen ) dan voor de olanzapinegroep (164 dagen ; 32% van de patiënten in de ziprasidongroep en 58% in de olanzapine voltooide het onderzoek.
tijdens de behandelingsfase kregen patiënten die ziprasidon kregen een gemiddelde dosis van 107,4 ± 27,3 mg/dag en patiënten die olanzapine kregen een gemiddelde dosis van 15 ± 3,3 mg / dag.
Basislijnkenmerken
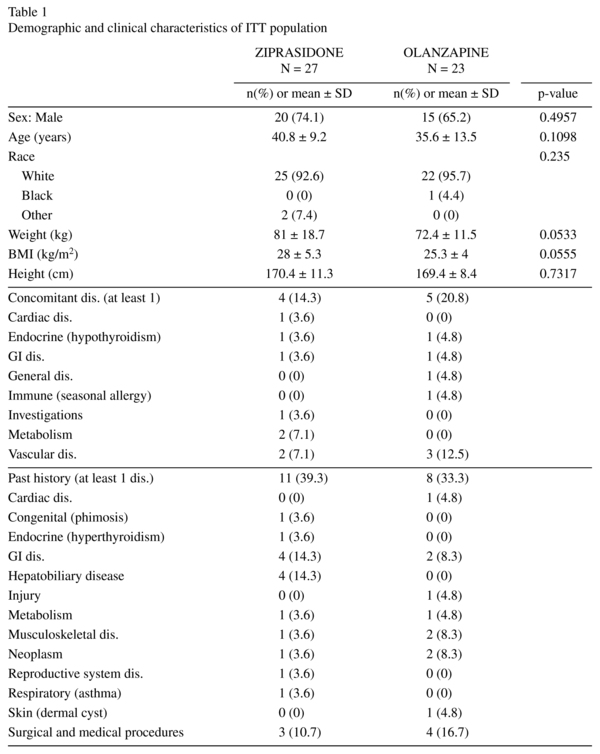
demografische kenmerken waren homogeen tussen beide groepen en vertoonden geen significante verschillen. ITT-patiënten waren 19-63 jaar oud, de meerderheid tussen 18-44 jaar. Tabel 1 bevat gedetailleerde demografische gegevens. Vergelijkbare aantallen patiënten in beide behandelingsgroepen kregen gelijktijdige geneesmiddelenbehandelingen tijdens het onderzoek (26 in de ziprasidon en 21 in de olanzapinegroep). De meest frequent gebruikte (door ≥ 5 personen in beide behandelingsgroepen) in beide behandelingsgroepen waren lorazepam, lormeta-zepam en risperidon.
effecten op gewichtstoename
lichaamsgewicht was stabiel in week 24 in de ziprasidongroep, zonder significant verschil met basaal gewicht (-0,1% procent afname; n.s.) hoewel er een statistisch significante toename was ten opzichte van de uitgangswaarde in de olanzapinegroep (7,4% procent toename in lichaamsgewicht ten opzichte van de uitgangswaarde, p < 0,0001) (Tabel 2). Het verschil in verandering in lichaamsgewicht tussen de behandelingsgroepen ten opzichte van de uitgangswaarde was op alle tijdstippen statistisch significant en de patiënten behandeld met olanzapine lieten tijdens alle bezoeken een significante gewichtstoename zien ten opzichte van de uitgangswaarde (Tabel 2). Het aantal personen dat in week 24 een gewichtstoename van ≥ 7% had was significant lager in de ziprasidon (n = 3 ) dan in de olanzapinegroep (N = 11 ) (OR = 6.246; p = 0.0150). Het verschil tussen de behandelingsgroepen was ook duidelijk na week 12 (p = 0,0266) en 18 (p = 0,0261) (gegevens niet getoond).

de secundaire eindpunten in week 24 zijn samengevat in Tabel 3. Patiënten behandeld met Ziprasidone ervaarden na 24 weken geen significante verandering in WC en BMI, terwijl patiënten behandeld met olanzapine een significante toename van beide parameters vertoonden, resulterend in een significant verschil in de 24-weekse LSM (kleinste-kwadraatgemiddelden) van beide waarden tussen de groepen.

werkzaamheidsresultaten
Ziprasidonbehandeling resulteerde in een significante afname (d.w.z. verbetering) van PANNS-N en olanzapine in een significante afname van alle PANNS-subschalen. Alle dalingen waren significant groter in de olanzapine groep dan in de ziprasidon groep. Er was echter geen significant verschil tussen de groepen in het aantal patiënten dat verbetering van schizofreniesymptomen ervaarde, zoals beoordeeld met PANNS (7 ) ziprasidone vs.11 olanzapine; p = 0,1385). Op de CGI-S schaal waren 19 patiënten in de ziprasidongroep en 16 in de olanzapine matig tot duidelijk ziek bij aanvang; na 24 weken waren er respectievelijk 19 en 12 patiënten (gegevens niet aangetoond). Op de CGI-I-schaal waren 5 patiënten in de ziprasidongroep en 4 in de olanzapine groep “sterk verbeterd” en 1 in de ziprasidon en 4 in de olanzapine groep “zeer sterk verbeterd” na 24 weken (gegevens niet getoond). Patiënten behandeld met olanzapine hadden betere scores voor symptoom-exacerbatie (CGI-S) (OR: 3.321, p = 0,0286) en verbetering (CGI-I) (OR: 3,512, p = 0.0307) in week 24 dan degenen behandeld met ziprasidon. Echter, en vergelijkbaar met PANNS-resultaten, waren er geen significante verschillen in het aantal patiënten dat verbetering liet zien in CGI-S (4 op ziprasidon vs.7 op olanzapine; p = 0,2379) en CGI-I (6 op ziprasidon VS. 8 op olanzapine; p = 0,2823) tussen de groepen. Een betere tevredenheid met medicatie, gemeten in PPS, werd waargenomen in de ziprasidongroep dan in de olanzapinegroep (p = 0,0161). Zoals blijkt uit Tabel 4, nam de eetlust ook significant af bij patiënten behandeld met ziprasidon, terwijl deze in de olanzapinegroep licht toenam. Hoewel de toename van de eetlust bij deze laatste geen statistische significantie bereikte, was de verandering statistisch verschillend tussen de behandelingsgroepen. Er waren geen significante verschillen tussen de bloeddruk en de hartslag van de behandelingsgroepen.

veiligheidsresultaten
tijdens dit onderzoek werden geen sterfgevallen gemeld. Bijwerkingen tijdens deze studie en laboratoriumtesten zijn samengevat in Tabel 5. De helft van de bijwerkingen in elke groep waren behandelingsgerelateerd (ziprasidon: sedatie, angst, rusteloosheid, schizofrenie en hypersomnie; olanzapine: schizofrenie, rusteloosheid). Eenentwintig behandelingsgerelateerde bijwerkingen werden ervaren door 15 patiënten (53,6%) in de ziprasidongroep en 11 door 8 patiënten (33,3%) in de olanzapinegroep.

discussie
volgens het onderzoeksprotocol zouden 78 patiënten (39 in elke groep) geëvalueerd moeten zijn op een statistisch vermogen van 80% om een verschil van 5 kg te detecteren, waarbij een SD = 7,7 wordt geschat. De uiteindelijke ITT-populatie was echter 50 patiënten. Hoewel dit een beperking kon zijn, was het verschil in lichaamsgewicht tussen de groepen na 24 weken 7,5% (SD = 4,5). Het vermogen was 99% en het resultaat was beter dan oorspronkelijk gepland.
in overeenstemming met eerdere onderzoeken was het lichaamsgewicht stabiel in de ziprasidongroep terwijl er op elk punt6, 7 een statistisch significante toename ten opzichte van de uitgangswaarde was in de olanzapinegroep. Dienovereenkomstig ondervonden de patiënten behandeld met ziprasidon geen significante verandering in WC en BMI, terwijl de patiënten behandeld met olanzapine een significante toename vertoonden van zowel parameters als gewicht. In een vorig onderzoek34 was het percentage met olanzapine behandelde patiënten met ≥ 7% gewichtstoename nog hoger: 60% van de patiënten na 3 maanden, hetgeen steeg tot 80% na 1 jaar behandeling met olanzapine. De olanzapine dosering van de genoemde studie was vergelijkbaar of lager dan die van onze studie. Dit feit is niet verwonderlijk, aangezien de dosis niet gerelateerd is aan de gewichtstoename van olanzapine, maar gerelateerd is aan de therapeutische respons25. Patiënten met een maximaal voordeel van olanzapine op de symptomen hebben ook het hoogste risico op significante gewichtstoename.
variaties in voedselinname zijn voorgesteld als een mogelijke oorzaak voor deze effecten op het gewicht. In dit onderzoek nam de eetlust significant af bij patiënten behandeld met ziprasidon terwijl er geen significante verandering werd gemeld bij patiënten behandeld met olanzapine. De stimulering van de eetlust is sterk gecorreleerd met de affiniteit van antipsychotica voor H1 en alfa1-adrenerge receptoren 35 en de afname van de eetlust bij met ziprasidon behandelde patiënten is waarschijnlijk geassocieerd met de lage affiniteit van het geneesmiddel voor H1-receptor. De met olanzapine behandelde patiënten vertoonden geen significante toename van de eetlust, maar vertoonden toch een significante toename van het lichaamsgewicht, wat suggereert dat andere mechanismen betrokken kunnen zijn bij olanzapine-geïnduceerde gewichtstoename. Tschoner et al. er werd een hogere nuchtere glucose bereikt en een verhoogde score in een insulineresistentiemodel bij patiënten behandeld met olanzapine, terwijl dit effect niet kon worden waargenomen bij patiënten behandeld met ziprasidon, wat aangeeft dat dit effect betrokken is bij door olanzapine geïnduceerde gewichtstoename 6. Uit dieronderzoek is gebleken dat olanzapine, maar niet ziprasidon, de consumptie van fat36 stimuleert en dat chronische behandeling met olanzapine de lipolyse door adipocytes belemmert37. Ook hebben eerdere onderzoeken een toename van cholesterol, triglyceriden en LDL-cholesterol aangetoond bij patiënten behandeld met olanzapine en niet bij personen behandeld met ziprasidon6, 38. Fysieke activiteit is significant verminderd bij patiënten behandeld met olanzapine 39,40,maar de of van fysieke inspanning in dit onderzoek bevoordeelt patiënten behandeld met olanzapine significant boven patiënten behandeld met ziprasidone en verklaart daarom het verschil in gewichtstoename niet.
met Olanzapine behandelde patiënten vertoonden significant betere resultaten in PANNS subschalen dan die welke behandeld werden met ziprasidon, wat de resultaten van een vorig onderzoek bevestigt.20 Deelnemers aan die studie hadden een eerdere behandeling vanwege intolerantie stopgezet, waardoor de vergelijking met onze huidige studie moeilijk was. De dosis ziprasidon was vergelijkbaar, maar de dosis olanzapine was hoger. Olanzapine vertoont toenemende dosis-respons curven voor schizofrenies21,41, wat de grotere verbetering in PANNS in vergelijking met ziprasidon in de studie met een hogere dosis olanzapine zou kunnen verklaren. Er is echter beschreven dat olanzapinedoses hoger dan 20 mg/dag een groter risico op belangrijke neveneffecten42,43 inhouden.
daarentegen vonden twee andere onderzoeken geen verschil in werkzaamheid tussen de behandelingen. De studie uitgevoerd door Lieberman et al.Er werden geen significante verschillen gezien in de verandering in de totale PANNS-score ten opzichte van de uitgangswaarde, noch tussen olanzapine en ziprasidon. Ook de studie van Simpson et al. toonde geen verschillen in PANNS score verbetering tussen groepen 26, 27. Deze onderzoeken gebruikten vergelijkbare flexibele doses als die welke we gebruikten, vonden dezelfde werkzaamheid bij behandeling met olanzapine of ziprasidon. Een plausibele verklaring zou kunnen zijn dat hoewel ziprasidone geïndiceerd is voor de behandeling van schizofrenie bij een dosisbereik van 40-160 mg/dag, de optimale dosis dichter bij 120 mg/dag44 ligt en de gemiddelde dosis van onze studie, iets lager dan de gemiddelde doses van de andere twee studies, misschien niet optimaal was. Bovendien zou de biologisch beschikbare dosis zelfs nog lager kunnen zijn geweest. Hoewel het ziprasidonplasmaniveau een significante positieve correlatie vertoont met de receptorbezetting, voorspelt de dosis het plasmaniveau niet44, aangezien voedsel de absorptie van ziprasidon kan interfereren45, kunnen de effecten afhangen van de timing van de medicatie.
Er waren 1,6 keer meer stopzettingen van de behandeling in de ziprasidon-groep dan in de olanzapinegroep, wat een groter verschil liet zien tussen beide behandelingen dan in andere studies7,20. De meeste bijwerkingen waren licht of matig van aard in beide groepen en omvatten bijwerkingen die gewoonlijk worden waargenomen met deze geneesmiddelen20,34. PPS-schaal geeft aan dat patiënten ziprasidon prefereerden boven olanzapine.
dit onderzoek toont een significant grotere toename in lichaamsgewicht in week 24 bij patiënten behandeld met olanzapine in vergelijking met patiënten behandeld met ziprasidon. De gemelde progressieve vermindering van de eetlust kan hebben bijgedragen aan de lichte afname van het lichaamsgewicht waargenomen bij patiënten behandeld met ziprasidon. Patiënten die olanzapine gebruikten vertoonden daarentegen een zekere toename van hun eetlust, maar veranderingen in deze groep waren niet significant en lieten niet de progressieve toename in variatie zien die patiënten met ziprasidon hadden gemeld. De visueel analoge schaal is een subjectieve methode voor het meten van de eetlust, en hoewel de verschillen in eetlust significant waren en de resultaten tijdens het onderzoek leken te bestaan, lijkt een licht toegenomen eetlust of gebrek aan lichaamsbeweging niet verantwoordelijk voor de gewichtstoename bij de met olanzapine behandelde patiënten, hetgeen wijst op andere mechanismen. Vet voedsel voorkeur en metabole dysregulation kan een rol spelen in de onderliggende oorzaak. Zowel de ziprasidon-als de olanzapinegroep werden goed verdragen en lieten een daling in de PANSS-scores zien in week 24. Hoewel de daling significant groter was voor alle scores in de olanzapinegroep, kan de mogelijkheid van een verminderde biologische beschikbaarheid van ziprasidon niet worden uitgesloten.
bij patiënten voor wie gewichtstoename tijdens de behandeling van schizofrenie een probleem kan zijn, moet een behandeling met ziprasidone worden geprobeerd vanwege het goede veiligheidsprofiel op dit gebied.
erkenningen
Ondersteuning voor medisch schrijven werd verstrekt door Medical Statistics Consulting en werd gefinancierd door Pfizer.
1. Allison DB, Fontaine KR, Heo M, Mentore JL, Cappelleri JC, Chandler LP, et al. De verdeling van de body mass index onder personen met en zonder schizofrenie. J Clin Psychiatrie 1999; 60 (4): 215-220.
2. Baptista T, de Mendoza S, Beaulieu S, Bermudez A, Martinez M. the metabolic syndrome during atypical antipsychotic drug treatment: mechanisms and management. Metab Syndr Relat Disord 2004; 2 (4): 290-307.
3. Enger C, Weatherby L, Reynolds RF, Glasser DB, Walker AM. Ernstige cardiovasculaire voorvallen en mortaliteit bij patiënten met schizofrenie. J Nerv Ment Dis 2004; 192 (1): 19-27.
4. Allison DB, Mentore JL, Heo M, Chandler LP, Cappelleri JC, Infante MC, et al. Antipsychotica-geïnduceerde gewichtstoename: een uitgebreide onderzoekssynthese. Am J Psychiatrie 1999; 156 (11): 1686-1696.
5. Kane JM, Barrett EJ, Casey de, Correll CU, Gelenberg AJ, Klein S, et al. Metabole effecten van behandeling met atypische antipsychotica. J Clin Psychiatrie 2004; 65 (11): 1447-1455.
6. Tschoner a, Engl J, Rettenbacher M, Edlinger M, Kaser S, Tatarczyk T, et al. Effecten van zes antipsychotica van de tweede generatie op het lichaamsgewicht en het metabolisme – risicobeoordeling en resultaten van een prospectieve studie. Pharmacopsychiatry 2009; 42 (1): 29-34.
7. Lieberman JA, Stroup TS, McEvoy JP, Swartz MS, Rosenheck RA, Perkins DO, et al. Effectiviteit van antipsychotica bij patiënten met chronische schizofrenie. N Engl J Med 2005; 353( 12): 1209-1223.
8. King DJ. Medicamenteuze behandeling van de negatieve symptomen van schizofrenie. EUR Neuropsychopharmacol 1998; 8 (1): 33-42.
9. Weiden P, Aquila R, Standard J. atypische antipsychotica en long-term outcome in schizofrenie. J Clin Psychiatrie 1996; 57 (Suppl 11): 53-60.
10. Drici MD, Priori S. cardiovasculaire risico ‘ s van atypische antipsychotica behandeling. Pharmacoepidemiol Drug Saf 2007; 16 (8): 882-890.
11. Gao K, Ganocy SJ, Gajwani P, Muzina DJ, Kemp de, Calabrese JR. a review of sensitivity and tolerability of antipsychotica in patients with bipolar disorder or schizophrenia: focus on slaperigheid. J Clin Psychiatrie 2008; 69 (2): 302-309.
12. Nasrallah HA. Atypische antipsychotica-geïnduceerde metabole bijwerkingen: inzichten uit receptorbindingsprofielen. Mol Psychiatry 2008; 13 (1): 27-35.
13. Baldwin D, Mayers A. seksuele bijwerkingen van antidepressiva en antipsychotica. Adv Psychiatr Treat 2003; 9 (3): 202-210.
14. Montejo AL. Prolactine bewustzijn: een essentiële overweging voor fysieke gezondheid bij schizofrenie. Eur Neuropsychopharmacol 2008; 18( Suppl 2): S108-114.
15. Keck PE, Jr., McElroy SL, Arnold LM. Ziprasidone: een nieuw atypisch antipsychoticum. Expert Opin Pharmacother 2001; 2 (6): 1033-1042.
16. Kane JM, Khanna S, Rajadhyaksha S, Giller E. werkzaamheid en verdraagbaarheid van ziprasidone bij patiënten met behandelingsresistente schizofrenie. Int Clin Psychopharmacol 2006; 21 (1): 21-28.
17. Keck P, Jr., Buffenstein A, Ferguson J, Feighner J, Jaffe W, Harrigan EP, et al. Ziprasidone 40 en 120 mg / dag in de acute exacerbatie van schizofrenie en schizoaffectieve stoornis: een 4 weken durende placebogecontroleerde studie. Psychofarmacologie (Berl) 1998; 140(2): 173-184.
18. Montejo AL, Rico-Villademoros F. Veranderingen in de seksuele functie van poliklinische patiënten met schizofrenie of andere psychotische stoornissen behandeld met ziprasidone in klinische praktijk: een prospectieve, observationele studie van 3 maanden. J Clin Psychopharmacol 2008; 28 (5): 568-570.
19. Kingsbury SJ, Fayek M, Trufasiu D, Zada J, Simpson GM. De schijnbare effecten van ziprasidon op plasmalipiden en glucose. J Clin Psychiatrie 2001; 62 (5): 347-349.
20. Stroup TS, Lieberman JA, McEvoy JP, Swartz MS, Davis SM, Rosenheck RA, et al. Werkzaamheid van olanzapine, quetiapine, risperidon en ziprasidon bij patiënten met chronische schizofrenie na beëindiging van een eerder atypisch antipsychoticum. Am J Psychiatry 2006; 163 (4): 611-622.
21. Beasley CM, Jr., Tollefson G, Tran P, Satterlee W, sanger T, Hamilton S. Olanzapine versus placebo en haloperidol: acute phase results of the North American double-blind olanzapine trial. Neuropsychopharmacology 1996; 14 (2): 111-123.
22. Conley RR, Mahmoud R. Een gerandomiseerde dubbelblinde studie van risperidon en olanzapine bij de behandeling van schizofrenie of schizoaffectieve stoornis. Am J Psychiatrie 2001; 158 (5): 765-774.
23. Gomez JC, Crawford AM. Superieure werkzaamheid van olanzapine ten opzichte van haloperidol: analyse van patiënten met schizofrenie uit een internationale multicenterstudie. J Clin Psychiatrie 2001; 62 (Suppl 2): 6-11.
24. Bobes J, Rejas J, Garcia-Garcia M, Rico-Villademoros F, Garcia-Portilla MP, Fernandez I, et al. Gewichtstoename bij patiënten met schizofrenie die worden behandeld met risperidon, olanzapine, quetiapine of haloperidol: resultaten van het EIRE-onderzoek. Schizophr Res 2003; 62 (1-2): 77-88.
25. Kinon BJ, Kaiser CJ, Ahmed S, Rotelli MD, Kollack-Walker S. Association between early and rapid weight gain and change in weight over een periode van één jaar behandeling met olanzapine bij patiënten met schizofrenie en aanverwante stoornissen. J Clin Psychopharmacol 2005; 25 (3): 255-258.
26. Simpson GM, Glick ID, Weiden PJ, Romano SJ, Siu CO. Gerandomiseerde, gecontroleerde, dubbelblinde multicenter vergelijking van de werkzaamheid en verdraagbaarheid van ziprasidon en olanzapine bij acuut zieke patiënten met schizofrenie of schizoaffectieve stoornis. Am J Psychiatrie 2004; 161 (10): 1837-1847.
27. Simpson GM, Weiden P, Pigott T, Murray s, Siu CO, Romano SJ. Zes maanden durende, geblindeerde, multicenter vervolgstudie van ziprasidon versus olanzapine bij schizofrenie. Am J Psychiatrie 2005; 162 (8): 1535-1538.
28. American Psychiatric Association. American Psychiatric Association. Task Force on DSM-IV. Diagnostic and statistical manual of mental disorders: DSM-IV-TR. 4e ed. Washington, DC: American Psychiatric Association; 2000.
29. WMA. Verklaring van de World Medical Association van Helsinki: ethische beginselen voor medisch onderzoek met menselijke proefpersonen. J Postgrad Med. 2002; 48(3): 206-208.
30. Kay SR, Fiszbein A, Opler LA. De positive and negative syndrome scale (PANSS) voor schizofrenie. Schizophr Bull 1987; 13 (2): 261-276.
31. Guy W, National Institute of Mental Health (VS). Afdeling Psychofarmacologie., Vroeg Klinisch Geneesmiddel Evaluatie Programma. ECDEU assessment manual for psychopharmacology. Rev.ed. Rockville, Md.: U. S. Dept. van Gezondheid, Onderwijs, en welzijn, openbare gezondheidszorg, Alcohol, drugsmisbruik, en geestelijke gezondheidszorg administratie, Nationaal Instituut voor geestelijke gezondheid, Psychofarmacologie onderzoek tak, afdeling van extramurale onderzoeksprogramma ‘ s; 1976.
32. Feeny D, Furlong W, Boyle M, Torrance GW. Classificatiesystemen voor gezondheidsstatus met meerdere attributen. Health Utilities Index. Pharmacoeconomics 1995; 7 (6): 490-502.
33. Ruiz M, Rejas J, Soto J, Pardo a, Rebollo I. aanpassing en validatie van de Health Utilities Index Mark 3 in het Spaans en correctie normen voor de Spaanse bevolking. Med Clin (Barc)) 2003; 120(3): 89-96.
34. McEvoy JP, Lieberman JA, Perkins DO, Hamer RM, Gu H, Lazarus A, et al. Werkzaamheid en verdraagbaarheid van olanzapine, quetiapine en risperidon bij de behandeling van vroege psychose: een gerandomiseerde, dubbelblinde 52-weekse vergelijking. Am J Psychiatrie 2007; 164 (7): 1050-1060.
35. Baptista T, Zarate J, Joober R, Colasante C, Beaulieu s, Paez X, et al. Drug geïnduceerde gewichtstoename, een belemmering voor succesvolle farmacotherapie: focus op antipsychotica. Curr Drug Targets 2004; 5 (3): 279-299.
36. Hartfield AW, Moore NA, Clifton PG. Effecten van atypische antipsychotica op intralipide inname en cocaïne-geïnduceerde hyperactiviteit bij ratten. Neuropsychopharmacology 2006; 31 (9): 1938-1945.
37. Minet-Ringuet J, Even PC, Valet P, Carpene C, Visentin V, Prevot D, et al. Veranderingen van het lipidenmetabolisme en de genexpressie in ratadipocyten tijdens chronische behandeling met olanzapine. Mol Psychiatrie 2007; 12 (6): 562-571.
38. Rettenbacher MA, Ebenbichler C, Hofer A, Kemmler G, Baumgartner S, Edlinger M, et al. Vroege veranderingen van plasmalipiden tijdens behandeling met atypische antipsychotica. Int Clin Psychopharmacol 2006; 21 (6): 369-372.
39. Fell MJ, Anjum N, Dickinson K, Marshall KM, Peltola LM, Vickers S, et al. De verschillende effecten van behandeling met subchronische antipsychotica op de selectie van macronutriënten, het lichaamsgewicht, de adipositeit en het metabolisme bij vrouwelijke ratten. Psychofarmacologie (Berl) 2007; 194(2): 221-231.
40. Fleischhaker C, Heiser P, Hennighausen K, Herpertz-Dahlmann B, Holtkamp K, Mehler-Wex C, et al. Klinische drug monitoring in kinder en adolescente psychiatrie: bijwerkingen van atypische neuroleptica. J Child Pessc Psychopharmacol 2006; 16 (3): 308-316.
41. Fanous A, Lindenmayer JP. Schizofrenie en schizoaffectieve stoornis behandeld met hoge doses olanzapine. J Clin Psychopharmacol 1999; 19 (3): 275-276.
42. Farah A. Atypiciteit van atypische antipsychotica. Prim Care Companion J Clin Psychiatrie 2005; 7 (6): 268-274.
43. Reich J. Gebruik van hoge dosis olanzapine bij refractaire psychose. Am J Psychiatrie 1999; 156 (4): 661.
44. Mamo D, Kapur S, Shammi CM, Papatheodorou G, Mann S, Therrien F, et al. Een PET studie van dopamine D2 en serotonine 5-HT2 receptor bezetting bij patiënten met schizofrenie behandeld met therapeutische doses ziprasidon. Am J Psychiatrie 2004; 161 (5): 818-825.
45. Hamelin BA, Allard S, Laplante L, Miceli J, Wilner KD, Tremblay J, et al. Het effect van het tijdstip van een standaardmaaltijd op de farmacokinetiek en farmacodynamiek van het nieuwe atypische antipsychoticum ziprasidon. Farmacotherapie 1998; 18 (1): 9-15.