Het Lewis-diagram van veel moleculen is echter niet consistent met de waargenomen eigenschappen van het molecuul.
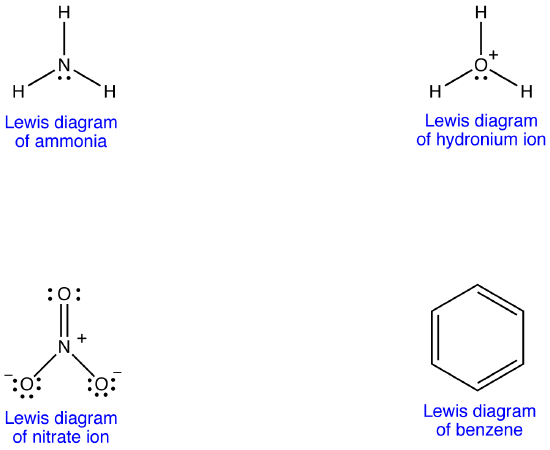
Voorbeeld 1: Nitraation
het nitraation heeft volgens het Lewis-diagram twee soorten stikstof-zuurstofbindingen, één dubbele binding en twee enkelvoudige bindingen, wat suggereert dat één stikstof-zuurstofbinding in het nitraation korter en sterker is dan elk van de andere twee. Ook impliceert de Lewis-structuur, met betrekking tot formele lading, dat er twee soorten zuurstofatomen in het nitraat-ion zijn, één formeel neutraal en elk van de andere twee met een formele lading van -1. Experimenteel, echter, de drie stikstof-zuurstof bindingen in het nitraat ion hebben dezelfde bindingslengte en dezelfde bindingsenergie, en de drie zuurstofatomen zijn niet te onderscheiden. Het Lewis-diagram kan de structuur en binding van het nitraat-ion niet op bevredigende wijze verklaren.
Voor het nitraat-ion kunnen twee extra Lewis-diagrammen worden getekend.
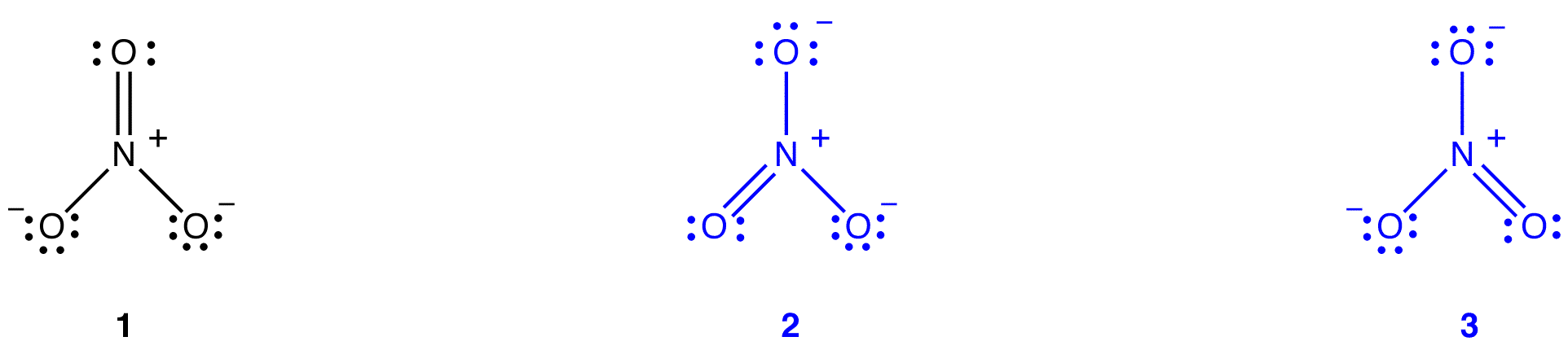
echter, geen van hen is consistent met de waargenomen eigenschappen van het nitraation en geeft daarom het nitraation niet correct weer.
Voorbeeld 2: Benzeen
benzeen heeft volgens het Lewis-diagram twee soorten koolstof-koolstofbindingen, drie dubbele bindingen en drie enkelvoudige bindingen, wat suggereert dat elk van de drie koolstof-koolstofbindingen in benzeen korter en sterker is dan elk van de andere drie. Experimenteel gezien hebben de zes koolstof-koolstofbindingen in benzeen echter dezelfde bindingslengte en dezelfde bindingsenergie. Het Lewis-diagram geeft geen bevredigende verklaring voor de structuur en binding van benzeen.
een attribuut van moleculen waarvan het klassieke Lewis-diagram niet consistent is met de waargenomen eigenschappen is dat andere geldige Lewis-diagrammen voor hen kunnen worden gegenereerd. Voor benzeen kan een extra Lewis-diagram worden getekend.

echter, geen van hen is consistent met de waargenomen eigenschappen van benzeen en geeft benzeen daarom niet correct weer.
Resonantietheorie is een poging om de structuur van een soort, zoals het nitraation of benzeen, te verklaren, waarvan geen Lewis-diagram consistent is met de waargenomen eigenschappen van de soort. Het grote voordeel van de resonantietheorie is dat, hoewel gebaseerd op rigoureuze wiskundige analyse, de resonantietheorie met succes kan worden toegepast met een beroep op weinig of geen wiskunde. De resonantietheorie wordt hieronder uitgelegd aan de hand van het nitraation als voorbeeld.
volgens de resonantietheorie is de structuur van het nitraation niet 1 noch 2 noch 3, maar het gemiddelde van alle drie, gewogen met stabiliteit. Lewis diagrammen 1, 2 en 3 worden resonantievormen, resonantiestructuren of resonantie-bijdragers van het nitraat-ion genoemd. De structuur van het nitraat-ion wordt gezegd dat het een resonantiehybride is of simpelweg een hybride van resonantievormen 1, 2 en 3. Wanneer het nodig is om de structuur van het nitraat-ion te tonen, worden resonantievormen 1, 2 en 3 getekend, verbonden door een tweekoppige pijlen.
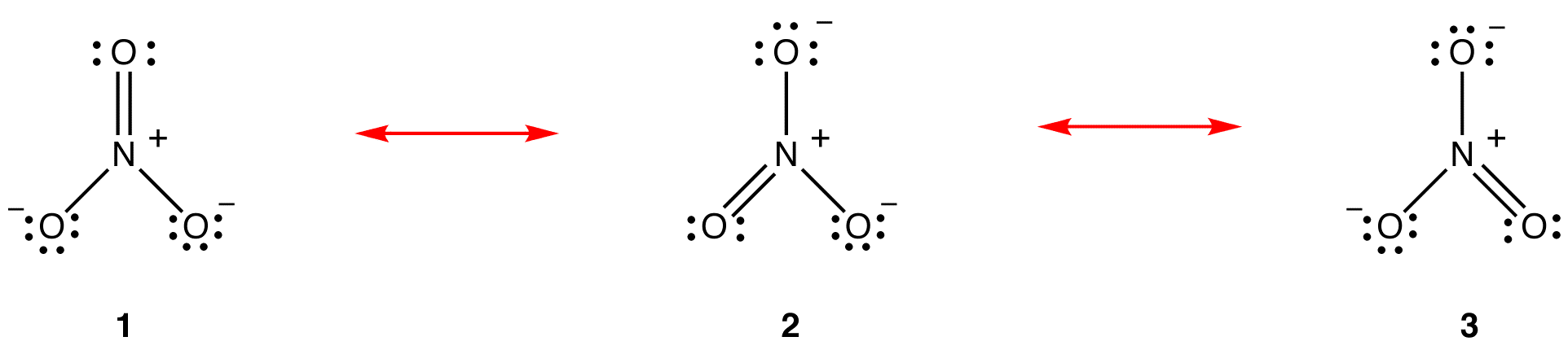
De drie resonantievormen van het nitraat-ion, 1, 2 en 3, zijn identiek, dus ze hebben dezelfde stabiliteit en dragen daarom gelijkelijk bij aan de hybride. Aangezien de exacte mate waarin elke resonantievorm van het nitraat-ion bijdraagt aan de hybride bekend is, kunnen de bindingsvolgorde van elke stikstof-zuurstofbinding evenals de formele lading op elk zuurstofatoom in de hybride gemakkelijk worden bepaald. :
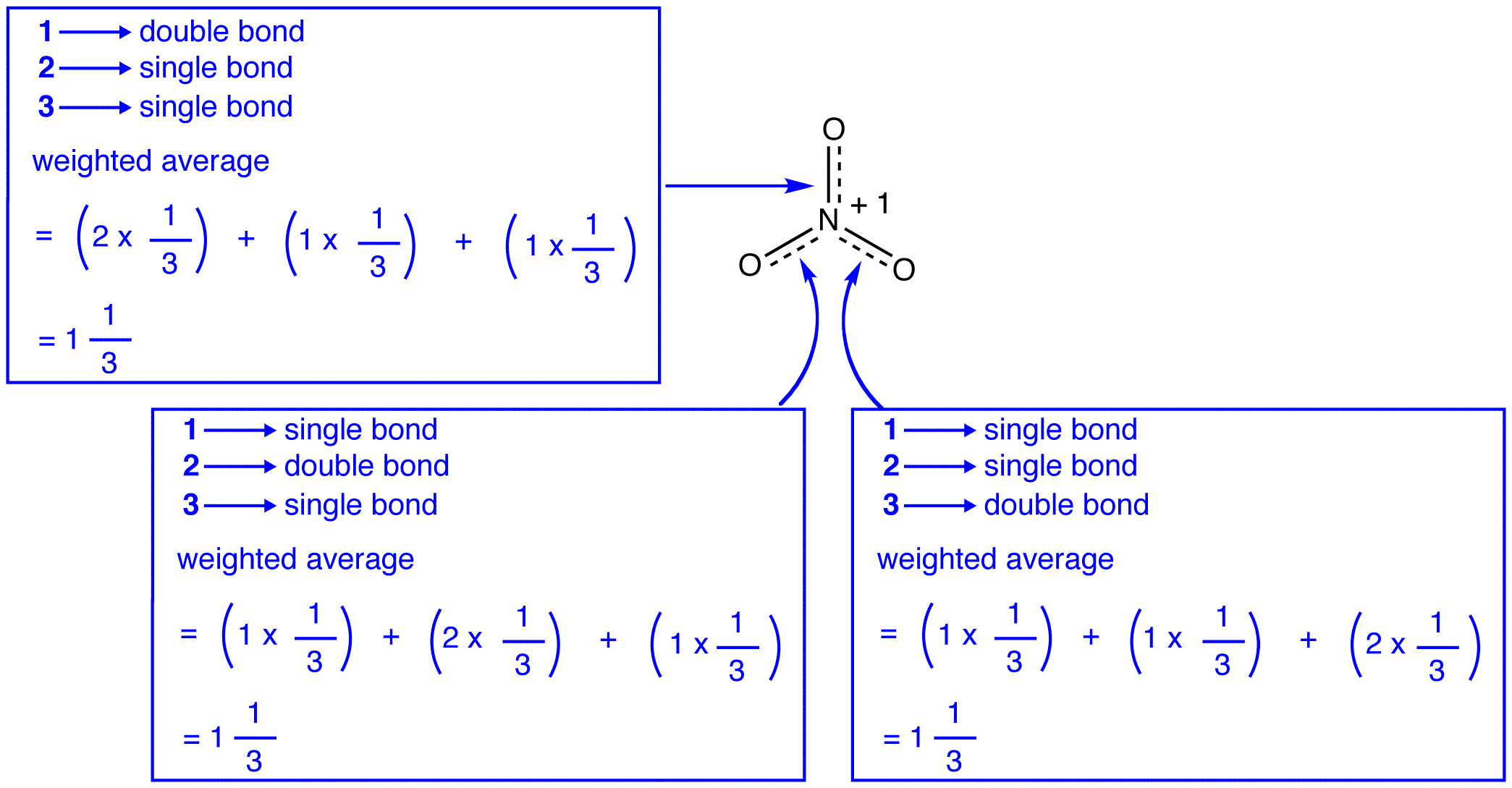
volgens de resonantietheorie is elke binding in het nitraation één en een derde van een binding, wat overeenkomt met de waarneming dat de drie bindingen in het nitraation dezelfde bindingslengte en dezelfde bindingsenergie hebben.
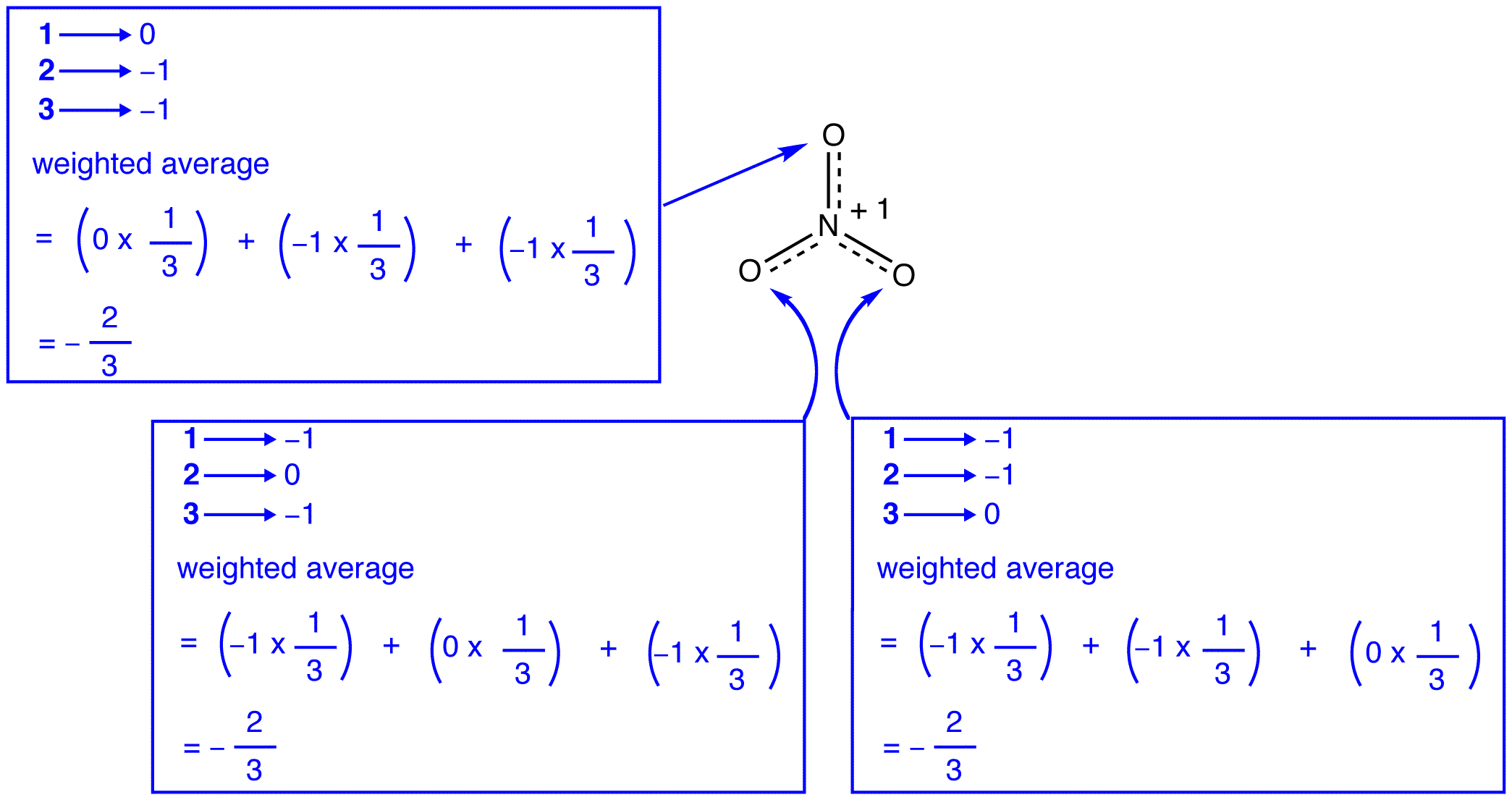
volgens de resonantietheorie heeft elk zuurstofatoom in het nitraation een formele lading van -2/3, wat, in combinatie met het feit dat de drie stikstof-zuurstofbindingen identiek zijn, consistent is met de waarneming dat de drie zuurstofatomen in het nitraation niet van elkaar te onderscheiden zijn.
in elke resonantievorm van het nitraation zijn er twee pi-elektronen, die slechts door twee atomen worden gedeeld. Een elektron dat slechts door twee atomen wordt gedeeld zou gelokaliseerd zijn. Zo zijn de twee pi-elektronen in elke resonantievorm van het nitraation gelokaliseerd. Het nitraation, vertegenwoordigd door de hybride, heeft twee pi-elektronen:
# elektronen in één pi-binding = 2
# elektronen in een derde van een pi-binding = 2/3
# elektronen in drie daarvan = 3 x (2/3) = 2
de twee pi-elektronen in het nitraation worden gedeeld door in totaal vier atomen, één stikstofatoom en drie zuurstofatomen. Een elektron gedeeld door meer dan twee atomen wordt gezegd te worden gedelokaliseerd. Zo worden de twee pi-elektronen in het nitraation gedelokaliseerd. Delokalisatie van pi-elektronen in het nitraation vereist dat de vier atomen zich op hetzelfde vlak bevinden, waardoor laterale overlapping van de p-orbitalen op hen mogelijk is.

indien de energie van het nitraation het gewogen gemiddelde was van de energieën van zijn drie resonantievormen, moet de structuur van het nitraation het gewogen gemiddelde zijn van de structuren van zijn drie resonantievormen, moet deze gelijk zijn aan de energie van een van de drie identieke resonantievormen:

indien de energie van de hybride gelijk is aan die van een resonantievorm, aangezien alle chemische entiteiten (elementaire deeltjes, atomen, moleculen, enz.) natuurlijk de neiging om in de laagst mogelijke energietoestand, zou er geen voordeel voor het nitraat ion te bestaan als de hybride; het zou gewoon kunnen bestaan als een resonantie vorm. Aangezien het nitraation bestaat als hybride, niet als resonantievorm, kan worden afgeleid dat de energie van de hybride lager is dan die van een van de resonantievormen.

volgens de resonantietheorie is de energie van een molecuul dan lager dan die van de laagste-energetische resonantievorm. Aangezien het nitraation een lagere energie heeft en daardoor stabieler is dan een van zijn resonantievormen, wordt gezegd dat het nitraation resonantiestabiliserend is.
Er zijn twee misvattingen over resonantietheorie onder beginnende studenten, waarschijnlijk als gevolg van de letterlijke interpretatie van het woord resonantie. Ze worden hieronder beschreven, met als voorbeeld het nitraation.
misvatting 1: Het nitraat-ion bestaat even als resonantievorm 1 en verandert dan ofwel in resonantievorm 2 ofwel in resonantievorm 3, die interconverteren of terugkeren naar 1.

de structuur van het nitraation is niet 1 noch 2 noch 3, maar de hybride en verandert niet met de tijd, tenzij het een reactie ondergaat.misvatting 2: In een monster van nitraationen bestaat op een gegeven moment een derde van de ionen als resonantievorm 1, een derde als resonantievorm 2 en de resterende derde als resonantievorm 3.

In een monster van nitraationen hebben op een gegeven moment alle ionen dezelfde structuur, namelijk de hybride.de klassieke analogie die gebruikt wordt om deze twee misvattingen te verduidelijken is de mule (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biologisch gezien is een muilezel een hybride van een paard en een ezel. Dit betekent niet dat een muilezel een moment op een paard lijkt en dan verandert om op een ezel te lijken. Het uiterlijk van een muilezel is een combinatie van die van een paard en die van een ezel en verandert niet met de tijd. Het betekent ook niet dat in een kudde sommige muilezels op een paard lijken en de anderen op een ezel. In een kudde hebben alle muilezels hetzelfde uiterlijk, wat een combinatie is van een paard en een ezel. De zwakte van deze analogie is dat paarden en ezels bestaan, terwijl resonantievormen strikt hypothetisch zijn. Een betere analogie, Geciteerd in Morrison en Boyd, is de neushoorn. Bij het zien van een neushoorn, zou men het kunnen beschrijven als de hybride van een draak en een eenhoorn, twee wezens die niet bestaan.
regels voor het tekenen van Resonantievormen
1. Resonantievormen zijn Lewis-diagrammen, die gebaseerd zijn op de valentiebindingstheorie.Daarom moeten zij zich houden aan de basisregels van de valentiebondtheorie. Waterstof kan dus niet meer dan twee valentie-elektronen hebben; periode-twee elementen kunnen niet meer dan acht valentie-elektronen hebben; elementen in periode drie en hieronder kunnen meer dan acht valentie-elektronen hebben. BV: in elke resonantie vorm van het nitraat-ion, zijn er twee elementen, stikstof en zuurstof, die periode-twee elementen. In geen van de resonantievormen van het nitraat-ion zijn er meer dan acht valentie-elektronen op een van de atomen.
2. Alle resonantievormen moeten hetzelfde Sigma-bindingskader hebben, alleen verschillend in de locaties van pi-elektronen en niet-gebonden valentie-elektronen. bijvoorbeeld: alle drie de resonantievormen van het nitraation hebben hetzelfde Sigma-bindingsraamwerk:
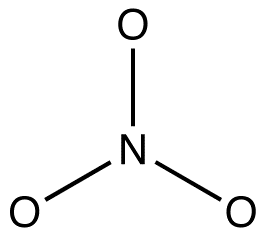
zij verschillen alleen van elkaar op de locaties van pi-elektronen en eenzame paren.
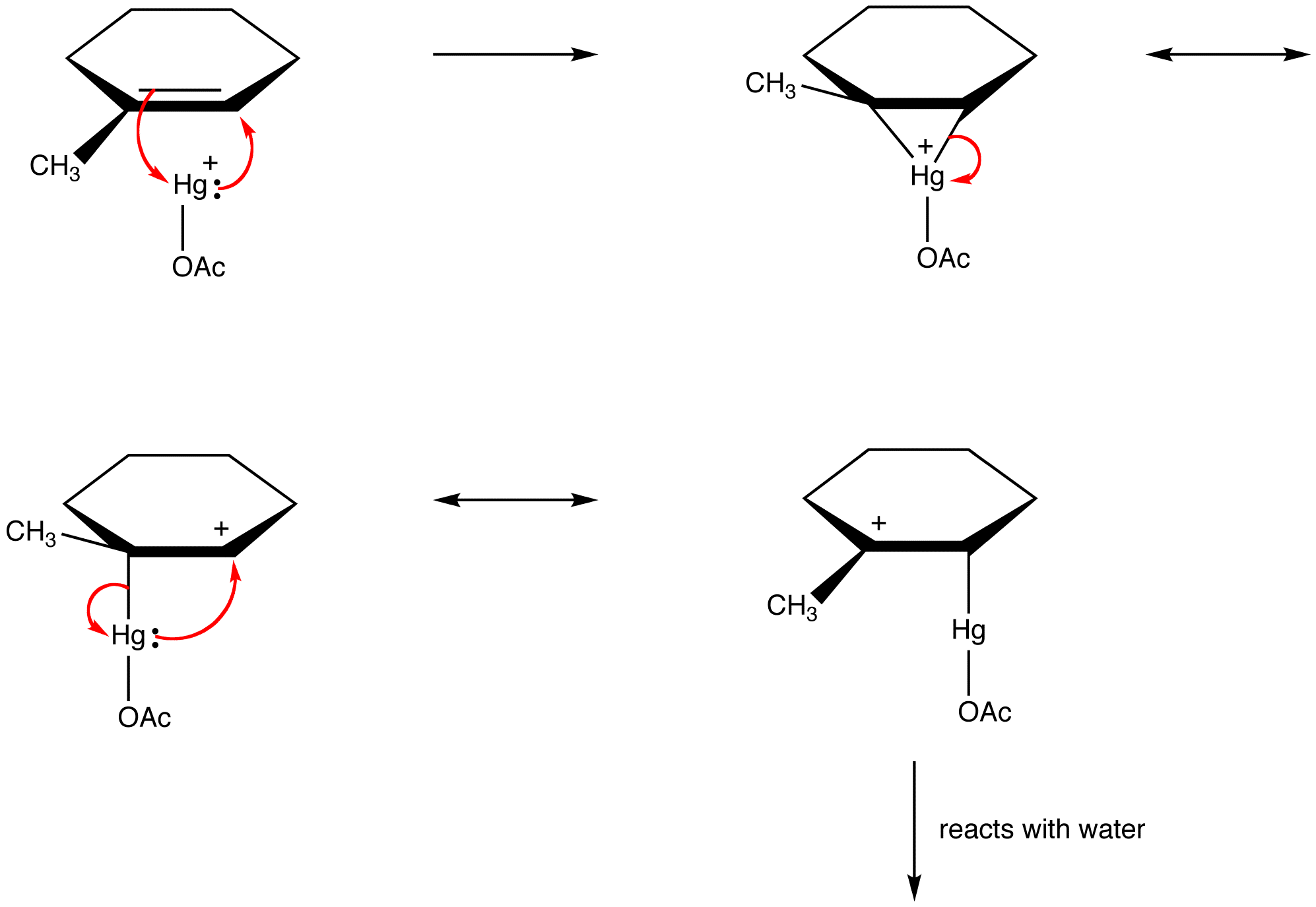
organische chemici overtreden deze regel in toenemende mate om de structuren van reactieve tussenproducten als resonantie-gestabiliseerde soorten te verklaren. bijvoorbeeld: oxymercuration
bepaling van de relatieve bijdrage van Resonantievormen aan de hybride
De drie vormen van het nitraation zijn identiek en hebben daarom dezelfde stabiliteit. Bijgevolg dragen zij gelijkelijk bij aan de hybride. De resonantievormen van de meeste resonantie-gestabiliseerde moleculen zijn verschillend van elkaar, dus dragen ze niet even bij aan de hybride. Hoe stabieler de resonantievorm, hoe meer het bijdraagt aan de hybride. Zo vereist de bepaling van relatieve bijdrage of resonantievormen aan de hybride de bepaling van hun relatieve stabiliteit. Gebruik de volgende regels om de relatieve stabiliteit van resonantievormen te bepalen.
Regel 1:
een resonantievorm waarin alle atomen een octet valentie-elektronen hebben is stabieler dan één waarin ten minste één atoom dat niet heeft. bijvoorbeeld:
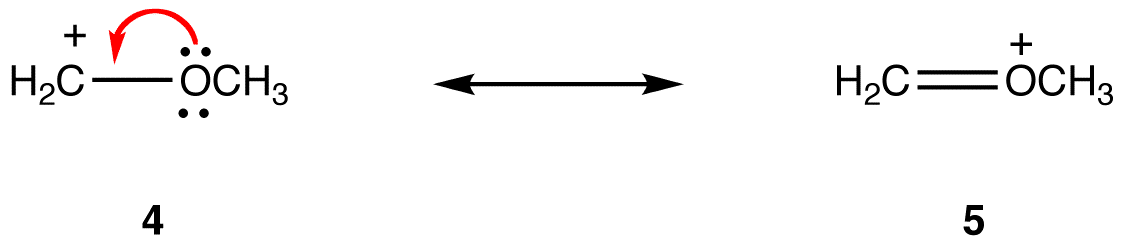
In resonantievorm 5 hebben alle atomen een octet valentie-elektronen; in 4 is één atoom, het koolstofatoom met de formele lading van +1, niet aanwezig. Resonantievorm 5 is dus stabieler dan resonantievorm 4.
regel 2:
al het andere is gelijk, een resonantievorm die een formele negatieve lading heeft op een meer elektronegatief atoom is stabieler dan een die een formele negatieve lading heeft op een minder elektronegatief atoom. bijvoorbeeld:
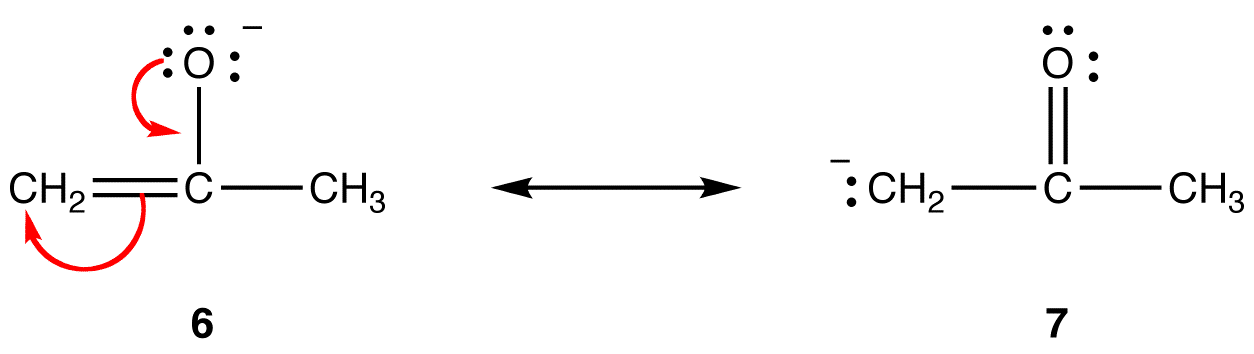
in resonantievorm 6 bevindt de formele negatieve lading zich op een zuurstofatoom; in 7 bevindt het zich op een koolstofatoom. Zuurstof is meer elektronegatief dan koolstof. Resonantievorm 6 is dus stabieler dan resonantievorm 7.
de trend is omgekeerd met betrekking tot formele positieve lasten. Al het andere is gelijk, een resonantievorm die een formele positieve lading heeft op een minder elektronegatief atoom is stabieler dan een die een formele positieve lading heeft op een meer elektronegatief atoom. bijvoorbeeld:
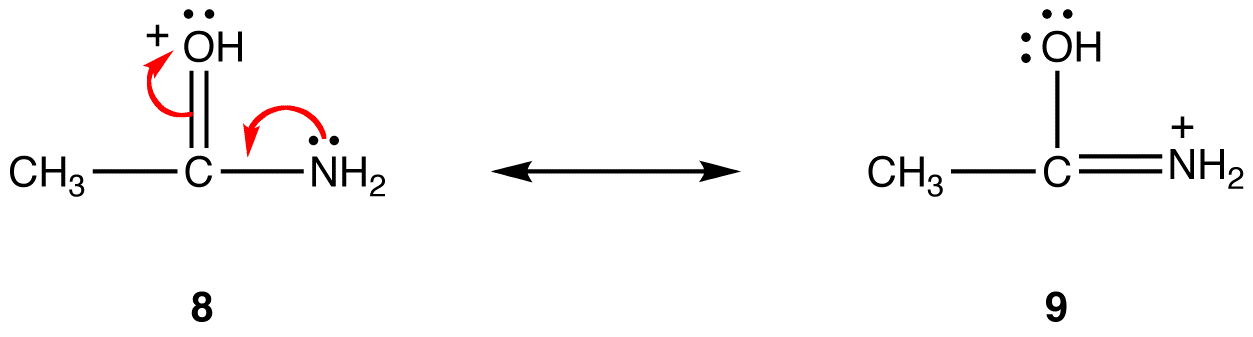
in resonantievorm 8 bevindt de formele positieve lading zich op een zuurstofatoom; in 9 op een stikstofatoom. Stikstof is minder elektronegatief dan zuurstof, dus resonantievorm 9 is stabieler dan resonantievorm 8.
regel 3:
al het andere is gelijk, een resonantievorm die geen ladingsscheiding heeft, een zogenaamde dipolaire resonantievorm, is stabieler dan een die dat wel doet. bijvoorbeeld:
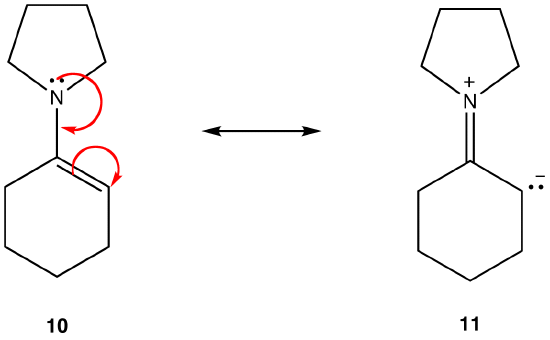
Resonantievorm 11 is een dipolaire resonantievorm; 10 niet. 10 is dus stabieler dan 11. Deze regel is een gevolg van de vectorvorm van de wet van Coloumb, volgens welke tegengestelde ladingen aantrekken. Het gevolg is dat, om tegengestelde ladingen gescheiden te houden, energie nodig is, wat betekent dat 11 een hogere energie heeft dan 10, dus 10 is stabieler dan 11.
regel 4:
in dipolaire resonantievormen, waarbij al het andere gelijk is, hoe groter de afstand tussen gescheiden ladingen, hoe stabieler de resonantievorm. bijvoorbeeld:
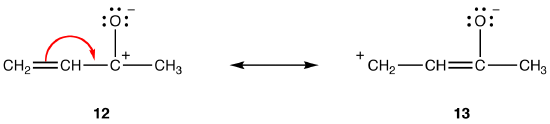
beide resonantievormen 12 en 13 zijn dipolaire resonantievormen. De afstand tussen de gescheiden lasten is groter in 13 (drie bindingen) dan in 12 (één bindingen), dus 13 is stabieler dan 12. Deze regel is een gevolg van de scalaire vorm van de wet van Coloumb, die stelt dat de aantrekkingskracht tussen tegengestelde ladingen omgekeerd evenredig is met het kwadraat van de afstand tussen hen. De energie die nodig is om de tegengestelde ladingen gescheiden te houden in 12 is dus hoger dan die in 13, wat betekent dat 12 een hogere energie heeft dan 13, dus 13 is stabieler dan 12.
bovenstaande regels zijn mogelijk niet van toepassing op resonantie waarbij elementen uit periode drie of lager betrokken zijn, vanwege hun vermogen om meer dan acht elektronen in de valentieschil op te nemen. bijvoorbeeld:
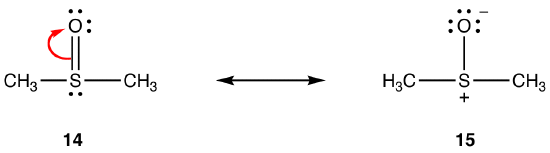
De dubbele binding in 14 bestaat uit een sigma-binding en een binding die gevormd wordt door de overlapping van een 2p-orbitaal met twee elektronen in het zuurstofatoom en een lege 3d-orbitaal in het zwavelatoom. Deze twee orbitalen hebben zeer verschillende energieën, afmetingen en vormen, dus de overlap tussen hen, bekend als een pn–dn interactie, is zwak. Bijgevolg is er weinig dubbele binding karakter in de zwavel-zuurstof binding in de hybride, dat wil zeggen, 15 is de belangrijkste resonantie vorm.
bijdragers en Attributies
- Gamini Gunawardena from the OChemPal site (Utah Valley University)