toevoeging van waterstof aan een koolstof-koolstof dubbele binding wordt hydrogenering genoemd. Het totale effect van een dergelijke toevoeging is de reductieve verwijdering van de functionele groep met dubbele binding. Regioselectiviteit is geen probleem, aangezien dezelfde groep (een waterstofatoom) is gebonden aan elk van de dubbele bindingen koolstof. De eenvoudigste bron van twee waterstofatomen is moleculaire waterstof (H2), maar het mengen van alkenen met waterstof resulteert niet in een waarneembare reactie. Hoewel de totale hydrogeneringsreactie exotherm is, voorkomt een hoge activeringsenergie dat deze onder normale omstandigheden plaatsvindt. Deze beperking kan worden omzeild door het gebruik van een katalysator, zoals in het volgende diagram is aangegeven.
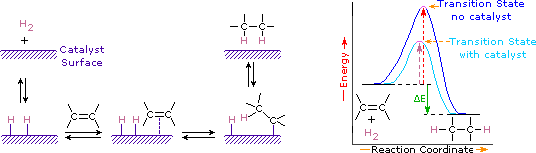
katalysatoren zijn stoffen die de snelheid (snelheid) van een chemische reactie veranderen zonder te worden geconsumeerd of als onderdeel van het product te verschijnen. Katalysatoren werken door de activeringsenergie van reacties te verlagen, maar ze veranderen de relatieve potentiële energie van de reactanten en producten niet. Fijn verdeelde metalen, zoals platina, palladium en nikkel, behoren tot de meest gebruikte hydrogeneringskatalysatoren. Katalytische hydrogenering vindt plaats in ten minste twee fasen, zoals weergegeven in het diagram. Eerst moet het alkeen worden geadsorbeerd aan het oppervlak van de katalysator samen met een deel van de waterstof. Vervolgens verschuiven twee waterstofverbindingen van het metaaloppervlak naar de koolstoffen van de dubbele binding, en de resulterende verzadigde koolwaterstof, die zwakker wordt geadsorbeerd, verlaat het katalysatoroppervlak. De exacte aard en timing van de laatste gebeurtenissen is niet goed begrepen.
zoals aangegeven in het energiediagram, is de hydrogenering van alkenen exotherm en komt de warmte vrij die overeenkomt met de ΔE (gekleurd groen) in het diagram. Deze reactiewarmte kan worden gebruikt om de thermodynamische stabiliteit van alkenen met verschillende aantallen alkylsubstituenten op de dubbele binding te evalueren. De volgende tabel geeft bijvoorbeeld de hydrogeneringswarmte weer voor drie C5H10-alkenen die hetzelfde alkaanproduct (2-methylbutaan) opleveren. Aangezien een grote reactiewarmte wijst op een hoge energiereactant, zijn deze warmtehaarden omgekeerd evenredig met de stabiliteit van de alkeenisomeren. Bij benadering zien we dat elke alkylsubstituent op een dubbele binding deze functionele groep met iets meer dan 1 kcal/mol stabiliseert.
| Alkeen Isomeer | (CH3)2CHCH=CH2 3-methyl-1-buteen |
CH2=C(CH3)CH2CH3 2-methyl-1-buteen |
(CH3)2C=CHCH3 2-methyl-2-buteen |
|---|---|---|---|
| Warmte van de Reactie ( ΔHº ) |
-30.3 kcal/mol | -28.5 kcal/mol | -26.9 kcal/mol |
Van het mechanisme weergegeven, hier zouden we verwachten dat de toevoeging van waterstof optreden met syn-stereoselectivity. Dit is vaak waar, maar de hydrogeneringskatalysatoren kunnen ook isomerisatie van de dubbele binding veroorzaken voorafgaand aan waterstoftoevoeging, in welk geval de stereoselectiviteit onzeker kan zijn.de vorming van transitiemetaalcomplexen met alkenen is overtuigend aangetoond door de isolatie van stabiele platinumcomplexen zoals zeise ‘ s zout, K. H2O en ethyleenbis(trifenylphosphine)platina, 2Pt(H2C=CH2). In de laatste is platina drie-coördinaat en nul-valent, terwijl zeise ‘ s zout een afgeleide is van platina (II). Een model van zeise ‘ s zout en een bespreking van de ongebruikelijke binding in dergelijke complexen kunt u bekijken door hier te klikken. Soortgelijke complexen zijn gemeld voor nikkel en palladium, metalen die ook fungeren als katalysatoren voor alkeenhydrogenering.
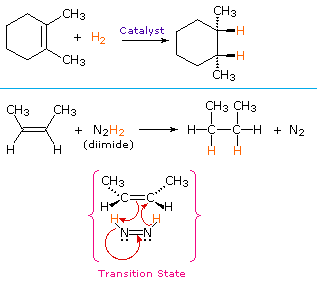
Een niet-katalytische procedure voor de syn-toevoeging van waterstof maakt gebruik van de onstabiele verbinding diimide, N2H2. Dit reagens moet vers worden gegenereerd in het reactiesysteem, meestal door oxidatie van hydrazine, en de sterk exotherme reactie wordt bevorderd door de eliminatie van stikstofgas (een zeer stabiele verbinding). Diimide kan bestaan als cis-transisomeren; alleen het cis-isomeer dient als reductiemiddel. Voorbeelden van alkeenreducties volgens beide procedures worden hieronder weergegeven.
bijdragers
- William Reussch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry