leerdoelen
aan het einde van deze sectie kunt u:
- warmteoverdracht onderzoeken.
- Bereken de uiteindelijke temperatuur op basis van warmteoverdracht.
tot nu toe hebben we de temperatuurverandering als gevolg van warmteoverdracht besproken. Er treedt geen temperatuurverandering op door warmteoverdracht als ijs smelt en vloeibaar water wordt (d.w.z. tijdens een faseverandering). Het is bijvoorbeeld, beschouwen water druipend van de ijspegels smeltend op het dak verwarmd door de zon. Omgekeerd bevriest water in een ijsschaal die wordt gekoeld door een lagere temperatuur omgeving.

figuur 1. Warmte van de lucht gaat over naar het ijs waardoor het smelt. (credit: Mike Brand)
energie is nodig om een vaste stof te smelten omdat de cohesieve bindingen tussen de moleculen in de vaste stof zodanig moeten worden verbroken dat in de vloeistof de moleculen kunnen bewegen met vergelijkbare kinetische energieën; er is dus geen temperatuurstijging. Ook is energie nodig om een vloeistof te verdampen, omdat moleculen in een vloeistof via aantrekkelijke krachten met elkaar interageren. Er is geen temperatuurverandering totdat een faseverandering is voltooid. De temperatuur van een kopje frisdrank in eerste instantie op 0ºC blijft op 0ºC totdat al het ijs is gesmolten. Omgekeerd komt energie vrij bij bevriezing en condensatie, meestal in de vorm van thermische energie. Het werk wordt gedaan door samenhangende krachten wanneer molecules worden samengebracht. De bijbehorende energie moet worden afgevoerd (afgevoerd) om ze samen te laten blijven Figuur 2.
de energie die betrokken is bij een faseverandering hangt af van twee belangrijke factoren: het aantal en de sterkte van bindingen of krachtparen. Het aantal bindingen is evenredig aan het aantal moleculen en dus aan de massa van de steekproef. De kracht van krachten hangt af van het type moleculen. De warmte Q die nodig is om de fase van een monster van massa m te veranderen, wordt gegeven door
Q = mLf (smelten/invriezen,
Q = mLv (verdamping/condensatie),
wanneer de latente warmte van fusie, Lf, en latente warmte van verdamping, Lv, materiaalconstanten zijn die experimenteel worden bepaald. Zie Tabel 1.

Figuur 2. (A) Energie is nodig om de aantrekkelijke krachten tussen moleculen in een vaste stof gedeeltelijk te overwinnen om een vloeistof te vormen. Diezelfde energie moet verwijderd worden om te bevriezen. (b) moleculen worden gescheiden door grote afstanden wanneer het gaan van vloeistof naar damp, die aanzienlijke energie om moleculaire aantrekking te overwinnen. Dezelfde energie moet worden verwijderd om condensatie te laten plaatsvinden. Er is geen temperatuurverandering totdat een faseverandering is voltooid.
latente warmte wordt gemeten in eenheden van J / kg. Zowel Lf als Lv zijn afhankelijk van de stof, in het bijzonder van de sterkte van de moleculaire krachten zoals eerder opgemerkt. Lf en Lv worden gezamenlijk latente warmtecoëfficiënten genoemd. Ze zijn latent, of verborgen, omdat in faseveranderingen, energie een systeem binnenkomt of verlaat zonder een temperatuurverandering in het systeem te veroorzaken; dus, in feite, is de energie verborgen. Tabel 1 bevat representatieve waarden voor Lf en Lv, samen met smelt – en kookpunten.
de tabel laat zien dat aanzienlijke hoeveelheden energie betrokken zijn bij faseveranderingen. Laten we bijvoorbeeld kijken hoeveel energie er nodig is om een kilogram ijs te smelten bij 0ºC om een kilogram water te produceren bij 0 ° C. Met behulp van de vergelijking voor een verandering in temperatuur en de waarde voor water uit Tabel 1, vinden we dat Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ is de energie om een kilogram ijs te smelten. Dit is veel energie omdat het dezelfde hoeveelheid energie vertegenwoordigt die nodig is om de temperatuur van 1 kg vloeibaar water van 0ºC naar 79,8 ºC te verhogen. Er is nog meer energie nodig om water te verdampen; er is 2256 kJ nodig om 1 kg vloeibaar water bij het normale kookpunt (100ºC bij atmosferische druk) te veranderen in stoom (waterdamp). Dit voorbeeld laat zien dat de energie voor een faseverandering enorm is in vergelijking met energie geassocieerd met temperatuurveranderingen zonder faseverandering.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Neem bijvoorbeeld het feit dat de luchttemperatuur in vochtige klimaten zelden boven 35,0 ºC komt, omdat de meeste warmteoverdracht naar verdampend water in de lucht gaat. Ook temperaturen in vochtig weer vallen zelden onder het dauwpunt omdat er enorme warmte vrijkomt wanneer waterdamp condenseert.
we onderzoeken de effecten van faseverandering nauwkeuriger door te overwegen warmte toe te voegen aan een monster ijs bij −20ºC (Figuur 3). De temperatuur van het ijs stijgt lineair en absorbeert warmte met een constante snelheid van 0,50 cal / g º ºC tot het 0ºC bereikt. Eenmaal op deze temperatuur, begint het ijs te smelten totdat al het ijs is gesmolten, absorberen 79,8 cal/g warmte. De temperatuur blijft constant op 0ºC tijdens deze faseverandering. Zodra al het ijs is gesmolten, stijgt de temperatuur van het vloeibare water, absorberen warmte met een nieuwe constante snelheid van 1,00 cal/g º ºC. Bij 100ºC begint het water te koken en blijft de temperatuur weer constant terwijl het water tijdens deze faseverandering 539 cal/g warmte absorbeert. Wanneer alle vloeistof stoomdamp is geworden, stijgt de temperatuur weer en neemt de warmte op met een snelheid van 0,482 cal/g º ºC.
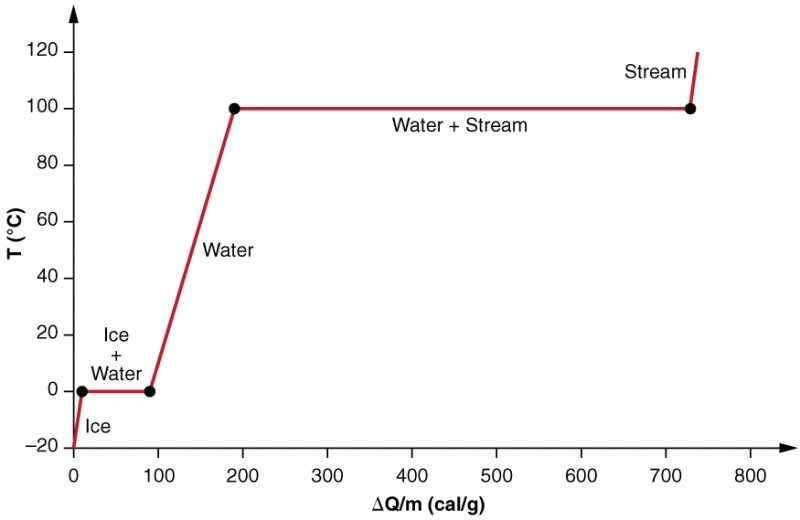
Figuur 3. Een grafiek van temperatuur versus toegevoegde energie. Het systeem is zo geconstrueerd dat er geen damp verdampt terwijl ijs verwarmt om vloeibaar water te worden, en zodat, wanneer verdamping optreedt, de damp in het systeem blijft. De lange reeksen constante temperatuurwaarden bij 0ºC en 100ºC weerspiegelen de grote latente hitte van respectievelijk smelten en verdampen.
Water kan verdampen bij temperaturen onder het kookpunt. Er is meer energie nodig dan op het kookpunt, omdat de kinetische energie van watermoleculen bij temperaturen onder 100ºC lager is dan die bij 100ºC, waardoor er minder energie beschikbaar is uit willekeurige thermische bewegingen. Neem bijvoorbeeld het feit dat transpiratie van de huid bij lichaamstemperatuur een warmte-input van 2428 kJ/kg vereist, wat ongeveer 10 procent hoger is dan de latente warmte van verdamping bij 100ºC. Deze warmte komt van de huid en zorgt zo voor een effectief koelmechanisme bij warm weer. Een hoge luchtvochtigheid remt de verdamping, zodat de lichaamstemperatuur kan stijgen, waardoor het zweet op uw voorhoofd blijft.
Voorbeeld 1. Bereken de eindtemperatuur op basis van faseverandering: koeling van Soda met ijsblokjes
drie ijsblokjes worden gebruikt om een soda bij 20ºC te koelen met een massa msoda = 0,25 kg. Het ijs staat op 0ºC en elk ijsblokje heeft een massa van 6,0 g. neem aan dat de frisdrank in een schuimcontainer wordt bewaard zodat warmteverlies kan worden genegeerd. Neem aan dat de soda dezelfde warmtecapaciteit heeft als water. Zoek de uiteindelijke temperatuur als al het ijs is gesmolten.
strategie
de ijsblokjes hebben een smelttemperatuur van 0ºC. Warmte wordt overgebracht van de soda naar het ijs om te smelten. Smelten van ijs gebeurt in twee stappen: eerst treedt de faseverandering op en vast (ijs) verandert in vloeibaar water bij de smelttemperatuur, dan stijgt de temperatuur van dit water. Smelten levert water op bij 0ºC, dus meer warmte wordt overgebracht van de soda naar dit water totdat het water plus soda systeem thermisch evenwicht bereikt, Qice = – Qsoda.
de warmte die naar het ijs wordt overgebracht is
Qice = muizen Lf + micecW(Tf−0ºC).
de warmte die door de soda wordt afgegeven is Qsoda = msodacW (TF-20ºC). Aangezien er geen warmte verloren gaat, Qice = – Qsoda, zodat
muizen Lf + micecW(Tf−0ºC) = –msodacW(TF−20ºC).
Breng alle termen met betrekking tot Tf aan de linkerkant en alle andere termen aan de rechterkant. Los voor de onbekende hoeveelheid Tf op:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
oplossing
- Identificeer de bekende hoeveelheden. De massa van ijs is muizen = 3 × 6,0 g = 0,018 kg en de massa van soda is msoda = 0,25 kg.
- Bereken de termen in de teller: m sodacW(20ºC)=(0,25 kg)(4186 J/kg º ºC) (20ºC) = 20.930 J en miceLf = (0,018 kg) (334.000 J/kg) = 6012 J.
- Bereken de noemer: (msoda + muizen) cW = (0,25 kg + 0.018 kg) (4186 K/(kg º ºC) = 1122 J/ºC.
- Bereken de uiteindelijke temperatuur: \displaystyle{T}_{\text{f}}=\frac{20.930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\ \
discussie
dit voorbeeld illustreert de enorme energieën die betrokken zijn tijdens een faseverandering. De massa van ijs is ongeveer 7 procent van de massa van water, maar leidt tot een merkbare verandering in de temperatuur van soda. Hoewel we veronderstelden dat het ijs op de vriestemperatuur was, is dit onjuist: de typische temperatuur is −6ºC. Deze correctie geeft echter een eindtemperatuur die in wezen identiek is aan het resultaat dat we vonden. Kun je uitleggen waarom?

Figuur 4. Condensatie op een glas ijsthee. (credit: Jenny Downing)
we hebben gezien dat verdamping warmteoverdracht naar een vloeistof vanuit de omgeving vereist, zodat energie vrijkomt door de omgeving. Condensatie is het omgekeerde proces, waardoor de temperatuur van de omgeving toeneemt. Deze toename kan verrassend lijken, omdat we condensatie associëren met koude objecten—het glas in de figuur, bijvoorbeeld. Er moet echter energie uit de condenserende moleculen worden verwijderd om een damp te laten condenseren. De energie is precies dezelfde als die nodig is om de fase te veranderen in de andere richting, van vloeistof naar damp, en dus kan worden berekend uit Q = mLv.
condensatie ontstaat in Figuur 4 omdat de temperatuur van de nabijgelegen lucht tot onder het dauwpunt wordt gereduceerd. De lucht kan niet zoveel water vasthouden als bij kamertemperatuur, en zo condenseert het water. Energie wordt vrijgegeven wanneer het water condenseert, waardoor het smelten van het ijs in het glas wordt versneld.
Real-World Application
energie komt ook vrij wanneer een vloeistof bevriest. Dit fenomeen wordt gebruikt door fruittelers in Florida om sinaasappels te beschermen wanneer de temperatuur dicht bij het vriespunt (0ºC) ligt. Kwekers sproeien water op de planten in boomgaarden zodat het water bevriest en warmte wordt afgegeven aan de groeiende sinaasappels aan de bomen. Dit voorkomt dat de temperatuur in de sinaasappel Onder het vriespunt daalt, wat de vrucht zou beschadigen.

figuur 14.11. Het ijs op deze bomen gaf grote hoeveelheden energie vrij toen het bevroor, wat hielp om te voorkomen dat de temperatuur van de bomen onder 0ºC zakte. Water wordt opzettelijk op boomgaarden gespoten om harde vorst te voorkomen. (credit: Hermann Hammer)
sublimatie is de overgang van vaste naar dampfase. Je hebt misschien gemerkt dat sneeuw in de lucht kan verdwijnen zonder een spoor van vloeibaar water, of het verdwijnen van ijsblokjes in een vriezer. Het omgekeerde geldt ook: vorst kan zich op zeer koude ramen vormen zonder door de vloeibare fase te gaan. Een populair effect is het maken van “rook” uit droogijs, dat vaste kooldioxide is. Sublimatie vindt plaats omdat de evenwichtsdampdruk van vaste stoffen niet nul is. Sommige Luchtverfrissers gebruiken de Sublimatie van een vaste stof om een parfum in de kamer te injecteren. Motballen zijn een licht giftig voorbeeld van een fenol (een organische verbinding) die sublimeert, terwijl sommige vaste stoffen, zoals osmium tetroxide, zo giftig zijn dat ze in gesloten containers moeten worden bewaard om blootstelling van de mens aan hun sublimatie-geproduceerde dampen te voorkomen.

Figuur 5. Directe overgangen tussen vaste stof en damp zijn gebruikelijk, soms nuttig, en zelfs mooi. a) droogijs sublimeert rechtstreeks in kooldioxidegas. De zichtbare damp is gemaakt van waterdruppels. (credit: Windell Oskay) (b) vorst vormt patronen op een zeer koud venster, een voorbeeld van een vaste stof gevormd direct uit een damp. (credit: Liz West)
alle faseovergangen hebben warmte. In het geval van directe overgangen van vaste damp wordt de benodigde energie gegeven door de vergelijking Q = mLs, waarbij Ls de sublimatiewarmte is, de energie die nodig is om te veranderen 1.00 kg van een stof van de vaste fase tot de dampfase. Ls is analoog aan Lf en Lv, en de waarde ervan hangt af van de stof. Sublimatie vereist energie-input, zodat droogijs een effectief koelmiddel is, terwijl het omgekeerde proces (d.w.z. glazuur) energie vrijmaakt. De hoeveelheid energie die nodig is voor sublimatie is van dezelfde orde van grootte als die voor andere faseovergangen.
het materiaal dat in deze sectie en de vorige sectie wordt gepresenteerd, stelt ons in staat om een willekeurig aantal effecten te berekenen die verband houden met temperatuur-en faseverandering. In elk geval is het noodzakelijk om te bepalen welke temperatuur-en faseveranderingen plaatsvinden en vervolgens de juiste vergelijking toe te passen. Houd er rekening mee dat warmteoverdracht en werk zowel temperatuur-als faseveranderingen kunnen veroorzaken.
Probleemoplossingsstrategieën voor de effecten van warmteoverdracht
- onderzoeken de situatie om vast te stellen dat er een verandering in de temperatuur of fase is. Is er warmteoverdracht in of uit het systeem? Wanneer de aanwezigheid of afwezigheid van een faseverandering niet duidelijk is, Wilt u misschien eerst het probleem oplossen alsof er geen faseveranderingen zijn en de temperatuurverandering onderzoeken die is verkregen. Als het voldoende is om je voorbij een kook—of smeltpunt te brengen, moet je dan teruggaan en het probleem in stappen doen-temperatuurverandering, faseverandering, daaropvolgende temperatuurverandering, enzovoort.
- Identificeer en toon alle objecten die temperatuur en fase veranderen.
- Identificeer precies wat in het probleem moet worden bepaald (identificeer de onbekenden). Een geschreven lijst is nuttig.
- Maak een lijst van wat wordt gegeven of wat kan worden afgeleid uit het probleem zoals vermeld (identificeer de knowns).
- los de juiste vergelijking op voor de te bepalen hoeveelheid (de onbekende). Bij een temperatuurverandering is de overgebrachte warmte afhankelijk van de specifieke warmte (zie Tabel 1 Voor temperatuurverandering en warmtecapaciteit), terwijl voor een faseverandering de overgebrachte warmte afhankelijk is van de latente warmte. Zie Tabel 1.
- Vervang de knowns samen met hun eenheden in de juiste vergelijking en verkrijg numerieke oplossingen compleet met eenheden. U zult dit in stappen moeten doen als er meer dan één fase in het proces zit (zoals een temperatuurverandering gevolgd door een faseverandering).
- controleer het antwoord om te zien of het redelijk is: heeft het zin? Wees er bijvoorbeeld zeker van dat de temperatuurverandering ook geen faseverandering veroorzaakt waar je geen rekening mee hebt gehouden.
Controleer uw begrip
waarom blijft er sneeuw op berghellingen, zelfs als de temperaturen overdag hoger zijn dan de vriestemperatuur?
oplossing
sneeuw wordt gevormd uit ijskristallen en is dus de vaste fase van water. Omdat er enorme warmte nodig is voor faseveranderingen, duurt het een bepaalde tijd voordat deze warmte uit de lucht wordt opgehoopt, zelfs als de lucht boven 0ºC is. Hoe warmer de lucht is, hoe sneller deze warmte-uitwisseling plaatsvindt en hoe sneller de sneeuw smelt.
samenvatting van de sectie
- De meeste stoffen kunnen bestaan in vaste, vloeibare en gasvorm, die “fasen” worden genoemd.”
- faseveranderingen treden op bij vaste temperaturen voor een bepaalde stof bij een bepaalde druk, en deze temperaturen worden kook-en vriespunten (of smeltpunten) genoemd.
- Tijdens faseveranderingen wordt de geabsorbeerde of vrijgekomen warmte gegeven door: Q = mL waarbij L de latente warmtecoëfficiënt is.
conceptuele vragen
- warmteoverdracht kan temperatuur-en faseveranderingen veroorzaken. Wat anders kan deze veranderingen veroorzaken?
- Hoe helpt de latente warmte van de fusie van water de daling van de luchttemperaturen te vertragen, waardoor mogelijk wordt voorkomen dat de temperatuur aanzienlijk onder ºC daalt in de nabijheid van grote waterlichamen?
- Wat is de temperatuur van ijs direct nadat het is gevormd door het bevriezen van water?
- Als u ºC ijs in ºC water in een geïsoleerde container plaatst, wat gebeurt er dan? Zal wat ijs smelten, zal meer water bevriezen, of zal geen van beide plaatsvinden?
- welk effect heeft condensatie op een glas ijswater op de snelheid waarmee het ijs smelt? Zal de condensatie het smeltproces versnellen of vertragen?
- in zeer vochtige klimaten met talrijke waterlichamen, zoals in Florida, is het ongebruikelijk dat de temperatuur boven de 35 ° C (95 ° F) stijgt. In woestijnen kan de temperatuur echter ver boven dit niveau stijgen. Leg uit hoe de verdamping van water helpt om hoge temperaturen in vochtige klimaten te beperken.in de winter is het vaak warmer in San Francisco dan in het nabijgelegen Sacramento, 150 km landinwaarts. In de zomers is het bijna altijd warmer in Sacramento. Leg uit hoe de watermassa ‘ s rond San Francisco de extreme temperaturen matigen.
- een deksel op een kookpot plaatsen vermindert de warmteoverdracht die nodig is om deze te laten koken sterk. Leg uit waarom.
- gevriesdroogde levensmiddelen zijn in vacuüm gedehydreerd. Tijdens het proces bevriest het voedsel en moet worden verwarmd om uitdroging te vergemakkelijken. Leg uit hoe het vacuüm de uitdroging versnelt en waarom het voedsel daardoor bevriest.
- wanneer nog steeds lucht afkoelt door ‘ s nachts uit te stralen, is het ongebruikelijk dat de temperatuur onder het dauwpunt daalt. Leg uit waarom.
- in een natuurkundelokaaldemonstratie blaast een instructeur een ballon via de mond op en koelt deze vervolgens af in vloeibare stikstof. Als het koud is, heeft de gekrompen ballon een kleine hoeveelheid lichtblauwe vloeistof in zich, evenals enkele sneeuwachtige kristallen. Als het opwarmt, kookt de vloeistof, en een deel van de kristallen sublimeren, met sommige kristallen blijven hangen voor een tijdje en dan produceren een vloeistof. Identificeer de blauwe vloeistof en de twee vaste stoffen in de koude ballon. Onderschrijf uw identificaties aan de hand van gegevens uit Tabel 1.
problemen & oefeningen
- hoeveel warmteoverdracht (in kilocalorieën) is nodig om een verpakking van 0,450 kg bevroren groenten oorspronkelijk bij 0 ° C te ontdooien als de fusiewarmte dezelfde is als die van water?
- een zak met 0ºC ijs is veel effectiever in het absorberen van energie dan een zak met dezelfde hoeveelheid 0ºC water. (a) hoeveel warmteoverdracht is nodig om de temperatuur van 0,800 kg water te verhogen van 0ºC tot 30,0 ºC? (B) hoeveel warmteoverdracht nodig is om eerst te smelten 0.800 kg 0ºC ijs en dan zijn temperatuur verhogen? (C) leg uit hoe uw antwoord de stelling ondersteunt dat het ijs effectiever is.
- (a) hoeveel warmteoverdracht is nodig om de temperatuur van een 0,750 kg aluminium pot met 2,50 kg water te verhogen van 30,0 ºC tot het kookpunt en vervolgens 0,750 kg water weg te koken? (b) Hoe lang duurt dit als de snelheid van de warmteoverdracht is 500 W 1 watt = 1 joule/seconde (1 W = 1 J/s)?
- de vorming van condensatie op een glas ijswater zorgt ervoor dat het ijs sneller smelt dan het anders zou doen. Als 8.00 g condensatie vormt zich op een glas dat zowel water als 200 g ijs bevat, hoeveel gram van het ijs zal smelten als gevolg? Stel dat er geen andere warmteoverdracht plaatsvindt.
- Tijdens een reis merk je dat een zak ijs van 3,50 kg gemiddeld één dag meegaat in je koelbox. Wat is het gemiddelde vermogen in watt dat het ijs binnenkomt als het begint bij 0ºC en volledig smelt tot 0ºC water in precies één dag 1 watt = 1 joule / seconde (1 W = 1 J/s)?
- op een bepaalde droge zonnige dag zou de temperatuur van een zwembad met 1,50 ºC stijgen als er geen verdamping was. Welk deel van het water moet verdampen om precies genoeg energie weg te voeren om de temperatuur constant te houden?
- (a) hoeveel warmteoverdracht is nodig om de temperatuur van een stuk ijs van 0,200 kg te verhogen van -20,0 ºC tot 130ºC, inclusief de energie die nodig is voor faseveranderingen? (B) hoeveel tijd is nodig voor elke fase, uitgaande van een constante warmteoverdracht van 20,0 kJ/s? (c) Maak een grafiek van temperatuur versus tijd voor dit proces.in 1986 brak een gigantische ijsberg los van de Ross Ice Shelf in Antarctica. Het was ongeveer een rechthoek van 160 km lang, 40.0 km breed en 250 m dik. (A) Wat is de massa van deze ijsberg, aangezien de dichtheid van ijs 917 kg/m3 bedraagt? (B) hoeveel warmteoverdracht (in joules) is nodig om het te smelten? (C) hoeveel jaar zou alleen zonlicht nodig zijn om ijs zo dik te smelten, als het ijs gemiddeld 100 W/m2 absorbeert, 12.00 uur per dag?
- hoeveel gram koffie moet verdampen uit 350 g koffie in een glazen beker van 100 g om de koffie af te koelen van 95,0 ºC tot 45,0 ºC? Men mag aannemen dat de koffie dezelfde thermische eigenschappen heeft als water en dat de gemiddelde verdampingswarmte 2340 kJ/kg (560 cal/g) is. (U kunt de verandering in massa van de koffie negeren als het afkoelt, wat u een antwoord geeft dat iets groter is dan juist.)
- (a) Het is moeilijk een brand op een olietanker te blussen, omdat elke liter ruwe olie bij verbranding 2,80 × 107 J energie afgeeft. Om deze moeilijkheid te illustreren, bereken het aantal liter water dat moet worden besteed om de energie te absorberen die vrijkomt bij het verbranden van 1,00 L Ruwe olie, als het water zijn temperatuur verhoogd van 20,0 ºC tot 100ºC, kookt het, en de resulterende stoom wordt verhoogd tot 300ºC. b) bespreken van bijkomende complicaties die worden veroorzaakt door het feit dat Ruwe olie een kleinere dichtheid heeft dan water.
- de energie die vrijkomt uit condensatie bij onweersbuien kan zeer groot zijn. Bereken de energie die vrijkomt in de atmosfeer voor een kleine storm met een straal van 1 km, ervan uitgaande dat 1,0 cm regen gelijkmatig over dit gebied wordt neergeslagen.
- om vorstschade te voorkomen, wordt 4.00 kg 0ºC water op een fruitboom gespoten. (a) hoeveel warmteoverdracht vindt plaats als het water bevriest? (B) hoeveel zou de temperatuur van de 200-kg boom dalen als deze hoeveelheid warmte overgedragen van de boom? Neem de soortelijke warmte op 3,35 kJ/kg * ºC en neem aan dat er geen faseverandering optreedt.
- een aluminium kom van 0,250 kg met 0,800 kg soep bij 25,0 ºC wordt in een vriezer geplaatst. Wat is de uiteindelijke temperatuur als 377 kJ Energie wordt overgedragen uit de kom en soep, ervan uitgaande dat de thermische eigenschappen van de soep dezelfde zijn als die van water?
- een ijsblokje van 0,0500 kg bij -30,0 ºC wordt in 0,400 kg water van 35,0 ºC in een zeer goed geïsoleerde container geplaatst. Wat is de uiteindelijke temperatuur?
- Als u 0,0100 kg 20,0 ºC water op een blok ijs van 1,20 kg giet (dat aanvankelijk op -15,0 ºC ligt), Wat is dan de uiteindelijke temperatuur? U mag aannemen dat het water zo snel afkoelt dat de effecten van de omgeving verwaarloosbaar zijn.inheemse mensen koken soms in waterdichte manden door hete stenen in water te leggen om het aan de kook te brengen. Welke massa van 500ºc gesteente moet in 4.00 kg 15.0 ºC water worden geplaatst om de temperatuur op 100ºC te brengen, als 0,0250 kg water als damp ontsnapt uit de eerste sissende? U kunt de effecten van de omgeving verwaarlozen en de gemiddelde soortelijke warmte van de rotsen als die van graniet beschouwen.
- Wat zou de eindtemperatuur van de pan en het water zijn bij de berekening van de eindtemperatuur wanneer warmte tussen twee lichamen wordt overgebracht: koud Water in een hete Pan gieten als 0,260 kg water in de pan werd geplaatst en 0,0100 kg water onmiddellijk verdampte, zodat de rest op een gemeenschappelijke temperatuur met de pan zou komen?
- in sommige landen wordt vloeibare stikstof gebruikt op zuivel vrachtwagens in plaats van mechanische koelkasten. Een 3.Voor een levertijd van 00 uur is 200 L vloeibare stikstof nodig, met een dichtheid van 808 kg / m3. a) Bereken de warmteoverdracht die nodig is om deze hoeveelheid vloeibare stikstof te verdampen en de temperatuur te verhogen tot 3,00 ºC. (Gebruik cp en neem aan dat het constant is over het temperatuurbereik.) Deze waarde is de hoeveelheid koeling van de vloeibare stikstofvoorraden. (B) Wat is deze warmteoverdrachtssnelheid in kilowattuur? c) de hoeveelheid koeling die wordt verkregen door het smelten van een identieke massa van 0 ° C ijs te vergelijken met de hoeveelheid koeling die wordt verkregen door het verdampen van de vloeibare stikstof.sommige wapenliefhebbers maken hun eigen kogels, waarbij ze de loden kogels smelten en gieten. Hoeveel warmteoverdracht is nodig om de temperatuur te verhogen en 0.500 kg lood te smelten, vanaf 25,0 ºC?
verklarende woordenlijst
sublimatiewarmte: de energie die nodig is om een stof van de vaste fase in de dampfase te veranderen
latente warmtecoëfficiënt: een fysische constante die gelijk is aan de hoeveelheid warmte die wordt overgedragen voor elke 1 kg van een stof tijdens de faseverandering van de stof
sublimatie: de overgang van de vaste fase naar de dampfase
geselecteerde oplossingen voor problemen & oefeningen
1. 35,9 kcal
3. (a) 591 kcal; (b) 4,94 × 103 s
5. 13,5 W
7. (a) 148 kcal; (b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. (a) 9,67 L; (b) Ruwe olie is minder dicht dan water, zodat het op het water drijft, waardoor het wordt blootgesteld aan de zuurstof in de lucht, die het gebruikt om te verbranden. Ook, als het water onder de olie, het is minder efficiënt in het absorberen van de warmte die door de olie.
12. a) 319 kcal; B) 2,00 ºC
14. 20,6 ºC
16. 4,38 kg
18. (a) 1,57 × 104 kcal; (b) 18,3 kW ⋅ h; (c) 1,29 × 104 kcal
- waarden genoteerd bij de normale smelt-en kooktemperaturen bij standaard atmosferische druk (1 atm). ↵
- bij 37,0 ºC (lichaamstemperatuur) is de warmte van verdamping Lv voor water 2430 kJ/kg of 580 kcal/kg ↵
- bij 37,0 ºC (lichaamstemperatuur) is de warmte van verdamping Lv voor water 2430 kJ/kg of 580 kcal / kg ↵