A Microbial Biorealm page on the genus Enterococcus faecalis
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
soort
Enterococcus faecalis
beschrijving en significantie
enterokokken zijn grampositieve cocci die zware omstandigheden in de natuur kunnen overleven. Ze kunnen worden gevonden in de bodem, water en planten. Sommige stammen worden gebruikt bij de vervaardiging van voedingsmiddelen, terwijl andere de oorzaak zijn van ernstige infecties bij mensen en dieren (zo is bekend dat ze de gastro-intestinale en genitale delen van de mens koloniseren). Ze worden geassocieerd met zowel gemeenschap als ziekenhuis verworven infecties. Enterokokken kunnen groeien bij een temperatuurbereik van 10 tot 42°C en in omgevingen met brede pH-waarden. Sommigen staan bekend als beweeglijk. Terwijl er meer dan 15 soorten van het geslacht Enterococcus zijn, zijn 80-90% van de klinische isolaten E. faecalis (8). Enterokokken vormen meestal korte ketens of worden in paren gerangschikt. Onder bepaalde groeiomstandigheden verlengen ze echter en verschijnen ze cocobacillair. In het algemeen zijn enterokokken Alfa-hemolytisch. Sommigen bezitten het Groep D Lancefield-antigeen en kunnen worden ontdekt gebruikend monoclonal antilichaam-gebaseerde agglutinatietests.Enterococcen zijn typisch catalase negatief, en zijn anaërobe. Ze kunnen groeien in 6,5% NaCl, kunnen esculine hydrolyseren in aanwezigheid van 40% galzouten en zijn pyrrolidonylarylamidase en leucinearylamidase positief (8). Enterokokken hebben bewezen een therapeutische uitdaging voor te stellen vanwege hun resistentie tegen vele antimicrobiële geneesmiddelen, “met inbegrip van celwand actieve stoffen; aminoglycosiden, penicilline en ampicilline, en vancomycine” (1). De enterokokken hebben de capaciteit om een breed scala aan antimicrobiële resistentiefactoren te verwerven, die ernstige problemen opleveren bij de behandeling van patiënten met enterokokkeninfecties (8). Over het algemeen kunnen enterokokkenisolaten met een verminderde gevoeligheid voor vancomycine worden gecategoriseerd als vanA, vanB en vanC. vanA en vanB vormen de grootste bedreiging omdat zij het meest resistent zijn en de resistentiegenen op een plasmide worden gedragen. Aangezien de resistentiegenen op een plasmide worden gedragen, zijn zij gemakkelijk overdraagbaar, E. faecalis kan deze plasmiden door conjugatie overdragen (2). E. faecalis zijn ook resistent tegen teicoplanine. Enterokokken stammen die afhankelijk zijn van vancomycine zijn gevonden, maar zijn zeldzaam en minder vaak voor dan vancomycine-resistente stammen (aangeduid als “Vancomycine-resistente enterokokken” of “VRE”) (1).
Genome structure

vanwege vele gevaren voor de volksgezondheid waren de gegevens van de genoomsequentie van een stam van Enterococcus noodzakelijk. De stam die voor het rangschikken van genoomdna werd gekozen was E. faecalis V583, het eerste vancomycine-resistente isolaat in de Verenigde Staten. Het genoom van Stam V583 werd gesequenced door het Instituut voor genoomonderzoek (TIGR). Het enterokokken genoom toont E. faecalis metabolisch divers is en een brede waaier van regelgevende systemen bevat. Stam V583 bevat vier DNA-moleculen: de belangrijkste 3.218.030 basispaar bacteriële chromosoom en drie cirkelvormige plasmiden. Het chromosoom bevat ongeveer 3.500 open leesframes (ORFs), ongeveer 1/3 van deze ORFs heeft geen toewijsbare functie (8). De drie plasmiden zijn cirkelvormige molecules van DNA die als Plasmid-1, Plasmid-2, en Plasmid-3 worden geà dentificeerd. Plasmid – 1 bevat 66.320 bp, Plasmid – 2 bevat 17.963 bp, en Plasmid-3 bevat 57.660 bp. De plasmiden coderen een aantal genen, waaronder transposases, multi-drug resistance proteã nen, en een ppgpp-gereguleerde groei inhibitor (8). De gemiddelde G + C samenstelling van het E. faecalis chromosoom is 37,38%. Omdat het DNA-molecuul zo groot is, komen regionale afwijkingen van het gemiddelde voor. Een van deze locaties is het grote segment geassocieerd met de “vancomycine resistentie gen cluster gepositioneerd in de buurt van 2,22 Mb,” met een grote toename in procent G+C inhoud (8). Deze verschillen verbonden aan antibioticaresistentie of virulentie suggereerden de verwerving van genetisch materiaal van een vreemde soort door horizontale overdracht. Het is nog onbekend of de overdrachten verantwoordelijk zijn voor de variaties in de make-up van DNA. De informatie in het genoom van E. faecalis V583 zal het begrijpen van hoe het organisme zich heeft aangepast aan een veelzijdige menselijke ziekteverwekker. Met behulp van vergelijkende genomica zal de rol van de verschillende regulerende elementen beter worden begrepen in de manier waarop zij reageren op verschillende omgevingsstress en in de expressie van potentiële virulentiefactoren (8). Meer studies zoals deze zullen nieuwe geneesmiddelen suggereren om bacteriële infecties veroorzaakt door de enterokokken.Het genoom bevat ook 3 Ebp (codering voor de endocarditis biofilm-geassocieerde pili) operons die belangrijk zijn voor biofilm productie van E. faecalis stam OG1RF. Deze soort gebruikt deze operons om oppervlakte pili te produceren. . De oppervlakte pili worden gebruikt voor “bevestiging aan de gastheeroppervlakken en zijn antigenisch bij mensen tijdens endocarditis” (9).
De TIGR bevat een volledige lijst van genen voor de E. faecalis chromosomen.
celstructuur en metabolisme
celmetabolisme
De enterokokken leven in ruwe omgevingen, zoals het darmkanaal van mens en dier. Groei onder deze vijandige omstandigheden vereist dat E. faecalis een flexibel metabolisme heeft. E. faecalis kan niet alleen fermenteren om melkzuur te produceren, maar kan ook “een spectrum van energiebronnen van koolhydraten, glycerol, lactaat, malaat, citraat, diaminozuren en manya-ketozuren kataboliseren” (3).Het is aangetoond dat E. faecalis onder geselecteerde groeiomstandigheden de groei kan verbeteren door oxidatieve fosforylering met behulp van een proton-drijfkracht die door elektronentransport wordt vastgesteld. Een gevolg van” ontluikende ademhaling is de productie van krachtige oxidanten ” (bijvoorbeeld superoxide en waterstofperoxide), oxidatieve stress kan de E. faecalis verdragen (3). De tolerantie van deze stress, gecombineerd met andere ernstige groeiomstandigheden, laat E. faecalis groeien bij 10 tot 45°C, in galzouten, en bij extreem lage en hoge pHs. Bovendien kan E. faecalis zich verzetten tegen azide, detergenten, zware metalen en ethanol. Omdat E. faecalis verschillende suikerbronnen kan gebruiken, kan het in diverse omgevingen leven, vooral in de darm waar de voedingsstoffen beperkt zijn (2). In de darm ontlenen E. faecalis het grootste deel van hun energie aan de fermentatie van niet-geabsorbeerde suikers. E. faecalis kan ook energie krijgen door mucines af te breken, een koolhydraat dat zwaar geglycosyleerd is en geproduceerd wordt door intestinale kelk cellen (2).E. faecalis gebruikt een “phosphoenolypyruvate phosphotransferase system (PTS) om suikers buiten de cel te detecteren en de opname van suikers te koppelen aan fosforylering” (2). Hierdoor wordt minder energie (ATP) verspild in vergelijking met hoe suiker wordt verzameld door niet-PTS-systemen. De suikers die door E. faecalis worden gemetaboliseerd omvatten: D-glucose, D-fructose, lactose, maltose (alle PTS-substraten). In enterococcen reguleert PTS ook het glycerolmetabolisme, inductoruitzetting en katabolietonderdrukking (8). E. faecalis is een van de weinige Gram-positieve bacteriën met een laag G+C-gehalte die suiker uitstoten tijdens de groei op glucose, een fenomeen dat bekend staat als inductor-verdrijving (8). E. faecalis kan zelfs glycerol fermenteren onder aerobe en microaerofiele omstandigheden. E. faecalis kan ook onder anaerobe omstandigheden op glycerol groeien omdat het “een gen tot expressie brengt voor nad + – gebonden anaerobe glyceroldehydrogenase activiteit” (8). Glycerol kan het celmembraan passeren met behulp van een eiwit genaamd de glycerol diffusion facilitator (GlpF). De GlpF maakt de concentratie van glycerol binnen en buiten de cel gelijk, het eiwit wordt geremd door glycolyse. E. faecalis zijn in staat om te leven in extreme alkalische pH en hoge zoutconcentratie. Deze eigenschappen vereisen kationtransport om de constante cytosolic ionensamenstelling essentieel voor homeostase te handhaven. Alle cellen moeten overtollig natrium verdrijven om cytosolic concentraties in bereik te handhaven dat homeostase begunstigt. E. faecalis drukt zowel een na+/H+ antiporter als een vacuolaire ATPase (2) uit. Kalium is een belangrijke intracellulaire kation. De kaliumconcentratie binnen E. faecalis van 0,4 tot 0,6 M is essentieel voor normaal cellulair metabolisme, het “neutraliseert intracellulaire anionen, activeert diverse enzymen, en reguleert cytosolic pH” (8). E. faecalis drukt ten minste twee kaliumtransporters uit om de regeling uit te voeren, KtrI en KtrII samen met het Kep-systeem voor K+ extrusie (8). Hoewel bekend is dat KtrI en KtrII K+ opnamesystemen zijn (ze zijn k+/h+ symporters), is er weinig meer bekend over de eiwitten.
celstructuur
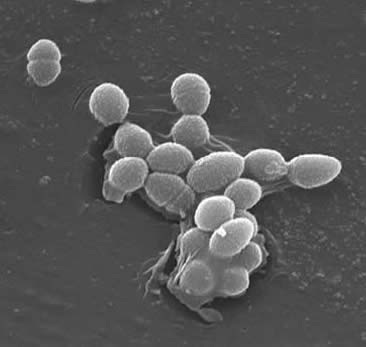
enterokokken zijn grampositieve cocci die doorgaans korte ketens vormen of in paren zijn gerangschikt (3). Onder bepaalde groeiomstandigheden kunnen ze verlengen en coccobacillair lijken. De celwand van E. faecalis is 20 tot 38% van het gewicht van de droge cel (in de exponentiële en stationaire fase cellen). Gezien het feit dat de E. faecalis een Gram-positieve bacterie is, zijn er drie hoofdcomponenten die de celwand vormen: peptidoglycaan, teichoic zuur en polysaccharide. 40% van de celwand bestaat uit peptidoglycaan, terwijl de rest van de celwand bestaat uit een “rhamnose-bevattende polysaccharide en een ribitol-bevattende teichoëzuur” (3). De peptidioglycaan functies (zoals in de meeste Gram-positieve cellen) om zich te verzetten tegen barsten veroorzaakt door hoge cytoplasmische osmotische druk. E. faecalis wordt over het algemeen beschouwd als een niet-ingekapseld organisme, wat blijkt uit het “ontbreken van een detecteerbaar slijmfenotype” (3). Echter, subsets van E. faecalis isolaten bezitten een capsulair polysaccharide. E. faecalis kan genetisch materiaal (plasmiden) uitwisselen door conjugatieprocessen geïnduceerd door kleine peptide feromonen (2). Oppervlakteproteïne “aggregatiestoffen die een specifieke ligand op recipiente cellen herkennen” zorgen voor succesvolle verbindingen voor conjugatie (2).E. faecalis heeft ook de capaciteit om oppervlakte pili te maken die tot de vorming van een biofilm kan leiden. De E. faecalis stammen die endocarditis veroorzaken bevatten grote hoeveelheden van deze pili. De pili zorgen voor bevestiging aan host oppervlakken (bijvoorbeeld het hartweefsel). De stammen van E. faecalis die endocarditis veroorzaken produceren de “biofilm significant vaker en ook in grotere mate dan niet-endocarditis isolaten” (9).
ecologie
E. faecalis is een zeer diverse soort enterokokken. Het interageert met veel andere organismen en heeft effecten op het milieu. De enterokokken zijn leden van de bacteriële gemeenschap bewonen de dikke darm in mensen. Ze zijn ook een natuurlijk onderdeel van de darmflora bij de meeste andere zoogdieren en vogels (8). De enterokokken komen ook voor in bodem, planten en water. Wanneer ze worden gevonden in water is het meestal omdat het water was besmet met fecale materie. Hoewel E. faecalis niet vaak voorkomt in planten, zijn er andere stammen van enterokokken gevonden bij planten en waarschijnlijk wel bij een verontreinigde waterbron (8).De ecologie van antibioticaresistentie en virulentie-genoverdracht in het milieu is nog steeds niet goed begrepen. Insecten, zoals huisvliegen (HF), die zich ontwikkelen in rottend organisch materiaal, kunnen antibioticaresistente bacteriën uit de mest van dieren en andere rottende organische substraten overbrengen naar woonomgevingen (7). HF zijn perfecte transmitters vanwege de levende microbiële gemeenschappen die aanwezig zijn in de habitats waar ze zich ontwikkelen (bijvoorbeeld uitwerpselen). Naast de goede overdrachtskwaliteiten zijn de manier waarop HF ‘ s hun jongen voeden (regurgitatie) en hun aantrekkingskracht op menselijke voeding. Aangezien HF lange afstanden kan vliegen, is dit insect zeer goed voor het verspreiden van fecale bacteriën, waaronder menselijke en dierlijke pathogenen, en mogelijk antibioticaresistente stammen van enterokokken (7). Een recente studie onderzocht op antibioticaresistentie en virulentiegenen in enterokokken van HF in fastfoodrestaurants in Kanasas. Deze studie toonde aan dat” huisvliegen in voedselhandling-en serveerfaciliteiten antibioticaresistente en potentieel virulente enterokokken kunnen dragen die de capaciteit hebben voor horizontale overdracht van antibioticaresistentie genen naar andere bacteriën ” (7).De effecten die E. faecalis heeft op het milieu de neiging om negatiever te zijn. Ze besmetten meestal de watervoorziening die kan leiden tot geïnfecteerde planten en infecties bij mensen (8). De antibiotische factoren kunnen ook worden getransporteerd door verschillende insecten (b.v. huisvliegen) en dieren, wat leidt tot toenemende aantallen virulente E. faecalis.
pathologie
enterokokken zijn naar voren gekomen als een belangrijke oorzaak van nosocomiale infecties, en binnen deze groep veroorzaakt Enterococcus faecalis het merendeel van de humane enterokokkeninfecties. Deze infecties kunnen lokaal of systematisch zijn en omvatten urinewegen en abdominale infecties, wondinfecties, bacteriëmie en endocarditis (2). Omdat E. faecalis in staat is om talrijke milieu-uitdagingen te overleven (zoals extreme temperaturen en de aanwezigheid van galzouten) en omdat ze resistentie kunnen verwerven tegen meerdere antibiotica, zijn deze bacteriën een groot gezondheidsprobleem geworden. Het National Nosocomial Infection Surveillance (NNIS) systeem heeft sinds 1989 een toename gemeld van de incidentie van infecties veroorzaakt door Vancomycine-resistente enterokokken (VRE) (1). Dit kan leiden tot ernstige gezondheidsproblemen, waaronder het gebrek aan beschikbare antibioticumtherapie voor Vree-infecties, omdat de meeste VRE-stammen naast vancomycine resistent zijn tegen meerdere antibiotica (zoals aminoglyscoides en ampicilline). De overdracht van vanocmycine-resistente genen van VRE naar andere grampositieve pathogenen is een ernstig probleem voor de volksgezondheid. De meest voorkomende manier waarop de E. faecalis infectie veroorzaakt komt voor in een ziekenhuis / langdurige zorg faciliteit is overdracht van E. faecalis tussen patiënten (8). Enterokokken kunnen op handen van gezondheidswerkers worden gedragen en van de ene patiënt naar de andere worden gedragen (overgedragen). Er is aangetoond dat VRE op de handen tot 60 minuten kan aanhouden (8). De overdracht van de handen van een gezondheidswerker aan de patiënt kan plaatsvinden bij contact met de intraveneuze of urinaire katheters van de patiënt. Rectale thermometers, niet goed gereinigd na gebruik, kunnen de VRE ook van patiënt naar patiënt overbrengen. Soms kan de transmissie resulteren in kolonisatie van de GI-tractus van de patiënt met de verworven stam. De nieuwe stam wordt dan onderdeel van de endogene flora van de patiënt (8). De verworven stam, die antibiotische resistentiegenen draagt, kan in het maag-darmkanaal leven. Infecties ontstaan dan uit deze nieuw verworven E. faecalis stammen.E. faecalis kan veel infecties veroorzaken in het menselijk lichaam. De meest voorkomende infectie veroorzaakt door enterococcen is infectie van de urinewegen. E. faecalis kan lagere urineweginfecties (UTI) veroorzaken, zoals cystisis, prostatitis en epididymitis (8). E. faecalis worden ook gevonden in intra-abdominale, bekken, en weke delen infecties. De E. faecalis kan nosocomiale bacteriëmie veroorzaken. De bron van bacteriëmie is meestal de urinewegen, ontstaan uit een geïnfecteerde intraveneuze katheter. Endocarditis is de ernstigste enterokokkeninfectie, omdat het een ontsteking van de hartkleppen veroorzaakt. In veel gevallen van endocarditis, antibiotische behandeling mislukt en een operatie om de geïnfecteerde klep te verwijderen is noodzakelijk (8). Minder vaak voorkomende infecties veroorzaakt door E. faecalis zijn meningitis, hematogene, osteomyelitis, septische artritis en (zeer zelden) pneumonie. Vanwege de resistentie van enterokokken tegen veel antibiotica is de behandeling van deze infecties moeilijk.
toepassing op biotechnologie
enterokokken zijn onderzocht voor mogelijk gebruik als probioticum (een voedingssupplement dat levende niet-virulente microbiële cellen bevat waarvan wordt aangenomen dat ze bij inname de samenstelling van de darmmicroflora gunstig beïnvloeden). Toediening van de E. faecalis-stam blijkt diarree te verminderen. De E. faecalis probiotica worden gebruikt in kippen – /varkens – / veevoer om diarree bij de dieren te verminderen (8).
vanwege de hoge ziekte veroorzakende eigenschappen van E. faecalis is veel meer onderzoek gedaan naar het stoppen van de virulentie van E. faecalis dan het gunstige gebruik van E. faecalis.
lopend onderzoek
1.) Hoop op infecties veroorzaakt door Enterococcus faecalis (4)
Het is bekend dat vancomycine-resistente bacteriën (bijv. E. faecalis) veel problemen voor de samenleving opleveren en bij mensen bacteriële infecties veroorzaken die moeilijk te behandelen zijn. De enterokokkeninfecties zijn uitdagend omdat de organismen de capaciteit hebben om snel resistentiegenen te verwerven en te verspreiden. Ceftobiprole (BPR) werd gebruikt als een onderzoek cefalosporine tegen Gram-positieve cocci. BPR is een breedspectrum parenteraal cefalosporine met hoge affiniteiten van grampositieve en gramnegatieve penicillinebindende eiwitten. Het vertoont ook stabiliteit tegen hydrolyse door β-lactamasen.Deze studie onderzocht de activiteit van BRP tegen een grote verzameling E. faecalis, waarbij werd gekeken naar BPR bactericide activiteit tegen vancomycine-resistente isolaten. De studie toonde aan dat gevoelig voor BPR bij E. faecalis niet wordt beïnvloed door de aanwezigheid van vancomycine resistentie of door β-lactamase productie. In de stammen van E. faecalis die ofwel vancomycine-resistentie (fenotypen van VanA en vanB) ofwel ampiciliïne-resistentie vertoonden, was de BPR bactericide. De onderzoekers toonden aan dat BPR bactericide activiteit tegen E. faecalis vertoonde bij een dosis van 750mg, waardoor 100% van de E. faecalis activiteit werd geremd. Hoewel de aanwezigheid van het enzym β-lactamase zeldzaam is bij E. faecalis, brengt de aanwezigheid ervan het gebruik van de meest effectieve anti-enterokokken β-lactams (bijv. ampicilline) in gevaar. BPR is een slecht substraat voor β-lactamase enzym, wat de uitstekende activiteit tegen β-lactamase producerende E. faecalis verklaart.Dit onderzoek toonde aan dat BPR een krachtige werking heeft tegen een zeer grote verzameling E. faecalis. De activiteit van de BPR werd niet beïnvloed door vancomycine resistentie of productie van β-lactamase. Daarom is BPR een hoopvol middel voor gebruik om β-lactamase producerende en vancomycine-resistente E. faecalis infecties bij mensen te behandelen.
2.) Onderzoeken hoe Enterococcus faecalis resistent wordt tegen het geneesmiddel linezolid (5)
wanneer antibiotica worden gebruikt bij de behandeling van een bacteriële infectie, kunnen deze een impact hebben op de darmflora. Resistente bacteriën kunnen worden geselecteerd tijdens de behandeling, zoals enterococcen, en zijn potentieel pathogeen. Het ontstaan van resistentie is een probleem voor nieuwe antibiotica, omdat het de bruikbaarheid van antibiotica zou kunnen riskeren.Deze studie onderzocht het ontstaan van resistentie tegen antibiotica door E. faecalis. Meer specifiek keken de onderzoekers naar resistentie tegen linezolide (de eerste van een nieuwe klasse antibiotica die bekend staat als de “oxazolidinonen”). Linezolid kan worden gebruikt tegen meerdere geneesmiddelenresistente Gram-positieve cocci ‘ s, waaronder VRE. Het remt bacteriële eiwitsynthese door specifiek te binden aan een domein in de 50S ribosomale subeenheid en wordt niet beïnvloed door de resistentiemechanismen die andere antibiotica beïnvloeden. In deze studie werd gekeken naar de mate van opkomst van linezolide-resistente E. faecalis mutanten in het spijsverteringskanaal van gnotobiotische muizen. De does van linezolide werd in water gevoerd met doses variërend van 0,5, 0,005 tot 0,005 g / L. de mutanten waren allemaal afhankelijk van de gegeven linezolide, de resistentieniveaus namen toe met de duur van de blootstelling. Er werden geen mutanten geïsoleerd in afwezigheid van linezolide, wat erop wijst dat de novo resistentie tegen linezolide ongewoon was bij de enterokokken.Het onderzoek vond dat een verandering in één enkel 23S rRNA gen de kritieke stap in de totstandkoming van linezolid weerstand was. Primaire kolonisatie met single-mutanten werd al 5 dagen na aanvang van de behandeling bij muizen waargenomen.Deze experimenten met muizen helpen verklaren het patroon van de opkomst van resistentie tegen linezolide waargenomen in klinische isolaten. Het onderzoeksteam toonde aan dat dosis van cruciaal belang is voor de dynamiek van resistentie. Deze bevindingen moeten helpen bij het definiëren van de beste therapeutische strategieën om de opkomst van resistentie in de klinische setting te minimaliseren, mogelijk het redden van vele levens.
3.) Een Ser/Thr kinase bij Enterococcus faecalis blijkt antimicrobiële resistentie te bemiddelen (6)
Enterococcus faecalis veroorzaakt veel van de antibioticaresistente infecties in ziekenhuizen, een gevolg van zijn inherente resistentie tegen bepaalde antibiotica en van zijn vermogen om te overleven en zich te vermenigvuldigen in het darmkanaal.De genetische basis van de resistentie gezien bij E. faecalis is niet goed bekend, dit onderzoek probeert een oorzaak van de resistentie te identificeren. De onderzoekers toonden aan dat PrkC, een ééncomponent signalerende proteã ne die een eukaryotic-type ser/Thr kinase domein bevat, voor inherente antimicrobial weerstand en intestinale persistentie van E. faecalis toestond. Ze vonden dat een E. faecalis mutant ontbreekt PrkC groeide aan een wild-type tarief in de afwezigheid van antimicrobiële stress maar toonde verhoogde gevoeligheid voor cel-envelop-actieve verbindingen, met inbegrip van antibiotica die cel-wand biogenese en gal detergentia gericht.PrkC reguleert fysiologische processen in E. faecalis die de sleutel zijn tot zijn succes als een nosocomiale pathogeen. De voorspelde structuur van de onderzoekers van PrkC was een cytoplasmic kinasedomein dat door een transmembraansegment wordt gescheiden dat om uncross-verbonden peptidoglycan wordt verondersteld te binden. Dit stelde voor dat PrkC een transmembraanreceptor was die de integriteit van de celwand van E. faecalis controleert en adaptieve reacties bemiddelt om die intergrity te handhaven. PrKC is belangrijk voor E. faecalis om nosocomial besmettingen te veroorzaken, die suggereren dat de signalerende proteã Ne een doel voor de ontwikkeling van therapie is om besmettingen door antibiotisch-resistente enterokokken te verhinderen.
1. I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Te Lezen, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Het Durkin’, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. “Rol van mobiel DNA in de evolutie van Vancomycine-resistente Enterococcus faecalis.” Wetenschap. Maart 2003. Vol. 299, nr. 5615. p. 2071-2074
2.) Murrary BE. Mei 1998. “Diversiteit onder de multidrug-resistente enterokokken.”Opkomende Infectieziekten. Vol. 4, nummer 1. blz. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo, en Janet T. Shigei. Kleurenatlas van medische Bacteriologie. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. “Time-Kill en Synergism Studies van Ceftobiprole tegen Enterococcus faecalis, met inbegrip van ß-Lactamase-producerende en vancomycine-resistente isolaten.”Antimicrobial Agents and Chemotherapy. Juni 2007. Vol. 51, nummer 6. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. ” Dose Dependence of Emergence of Resistance to Linezolid in Enterococcus faecalis in Vivo.”The Journal of Infectious Diseases. 2007. Vol. 195. p. 1480-1488.
6.) Kristich C., Wells C., Dunny G. “Een Eukaryotic-type ser/Thr kinase in Enterococcus faecalis bemiddelt antimicrobiële resistentie en intestinale persistentie.”Proceedings of the National Academy of Sciences of the United States of America. Februari 2007. Vol. 104, nr. 9. blz. 3508-3513.
7.) Macovei, L., Zurek, L. ” Ecology of Antibiotic Resistance Genes: Characterization of Enterococcci from housefly Collected in Food Settings.”Applied and Environmental Microbiology. Juni 2006. Vol. 72, nummer 6. 4028-4035.
8. Gilmore, Michael. De enterokokken: pathogenese, Moleculaire Biologie en antibiotische resistentie. Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. “Endocarditis and biofilm-associated pili of Enterococcus faecalis.”The Journal of Clinical Investigation. Oktober 2006. Nummer 116. 2799-2807.
uitgegeven door Richard A. Martinez van UC San Diego, student van Rachel Larsen.