Chemguide: Core Chemistry 14 – 16
dubbele en drievoudige covalente bindingen
deze pagina introduceert de mogelijkheid van meerdere (dubbele of drievoudige) covalente bindingen tussen atomen met behulp van zuurstof, stikstof, kooldioxide en etheen als voorbeelden. Deze worden gekozen omdat ze allemaal gewoonlijk worden gespecificeerd op Britse syllabussen voor 14-16-jarigen.
Ik neem aan dat u de pagina over covalente binding hebt gelezen en toegang hebt tot een periodiek systeem zoals dat u van deze site kunt downloaden.
dubbele binding in zuurstof
als je zuurstof opzoekt op het periodiek systeem, zul je zien dat het een atoomnummer heeft van 8 – en dus heeft het neutrale atoom 8 protonen en 8 elektronen. Deze zullen worden geregeld 2,6.
dus je hebt twee atomen zoals deze:
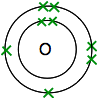
elk heeft twee ongepaarde elektronen. Om de maximale energetische stabiliteit te krijgen, moeten deze allemaal worden gekoppeld.
dus de oxygenen delen twee paar elektronen:
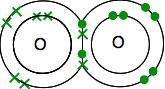
Dit is veel gemakkelijker te zien met behulp van lijnen om paren van gedeelde elektronen weer te geven:
![]()
drievoudige binding in stikstof
Als u stikstof in het periodiek systeem vindt, zult u in staat zijn om uit te zoeken dat de elektronische structuur 2,5 is. Vergeleken met zuurstof, heeft het daarom een paar elektronen en drie ongepaarde elektronen in zijn buitenste niveau.
om het zo energetisch stabiel mogelijk te maken, zal het deze allemaal moeten koppelen in covalente bindingen. Twee stikstofatomen zullen daarom op deze manier combineren:
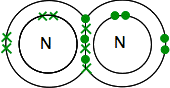
opnieuw is dit veel gemakkelijker te zien met behulp van lijnen om paren gedeelde elektronen weer te geven:
![]()
dubbele binding in kooldioxide
carbon ‘ s elektronische structuur is 2,4 met 4 ongepaarde elektronen in het buitenste niveau.
zuurstof is 2,6 met 2 paar elektronen en 2 ongepaarde elektronen in het buitenste niveau.
je moet eindigen met alle elektronen gekoppeld – en er is maar één manier om het te doen.
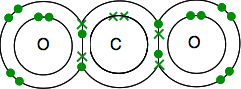
zoals voorheen is de binding gemakkelijker te zien met behulp van lijnen voor het verbinden van elektronen.
![]()
als er twee bindingsparen van elektronen tussen twee atomen zijn, wordt het, niet verrassend, een dubbele binding genoemd. Dus elke zuurstof is verbonden met het koolstofatoom in het midden door een dubbele binding.
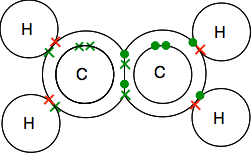
dubbele binding in etheen, C2H4
etheen en andere soortgelijke verbindingen met dubbele binding tussen koolstofatomen zijn belangrijke stoffen in de chemie. U zult ze later in de cursus meer in detail ontmoeten.
kijk zorgvuldig naar het diagram van de punten en kruisjes en zorg ervoor dat u begrijpt hoe het allemaal in elkaar past. Het moet zo zijn dat alle afzonderlijke elektronen in zowel de koolstof als de waterstof in bondingparen zijn gekoppeld.
Als u diagrammen tegenkomt die de verbindingsparen als lijnen tonen, kunt u een van twee versies vinden.
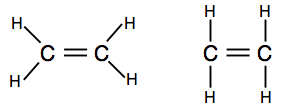
de eerste toont de werkelijke vorm van het molecuul beter, maar de tweede is ook perfect aanvaardbaar op dit niveau.
Waar wilt u nu naartoe?
naar de volgende pagina in deze sectie over covalente binding . . .
naar het menu atoomstructuur en binding . . .
naar het menu Chemie 14-16 . . .
naar het hoofdmenu van Chemguide . . .