Wat is ionische binding?
chemische bindingen ontstaan wanneer de totale energie van de gebonden atomen lager is dan de totale energie van de afzonderlijke atomen.De vorm van de binding wordt bepaald door de elektronenregeling die de energie minimaliseert.
in sommige gevallen worden elektronen gedeeld tussen atomen – dit wordt covalente binding genoemd.
in andere gevallen is er een volledige overdracht van een of meer elektronen van het ene atoom naar het andere.Het atoom dat elektronen verliest wordt een positief geladen ion.Het atoom dat elektronen ontvangt wordt een negatief geladen ion.
Dit leidt tot ionische binding – de wederzijdse elektrostatische aantrekking van positieve en negatieve charges.In de zuiverste vorm, ionische binding, is niet gericht. Het kan worden beschouwd als eenvoudige Coulombische attractie tussen puntladingen.Dit verschilt van covalente binding, waarbij het delen van elektronen resulteert in directionele bindingen.
elektronenoverdracht
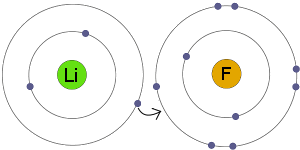
Li transfereert een elektron naar F. het resultaat is dat zowel de resulterende ionen elektrisch geladen worden en een volledig, stabiel elektron hebben.granaten.
elektrostatische aantrekking
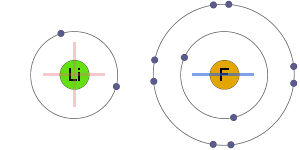
de positieve en negatieve ionen worden elektrostatisch aangetrokken aan elkaar, wat resulteert in een ionische binding.
De coulombische kracht heeft geen voorkeursrichting, met als gevolg dat ionverbindingen de neiging hebben om te bestaan als gigantische kristalroosterstructuren van samengepakte ionen.
een monster van het kristalrooster van Lithiumfluoride

elektronegativiteit en ionische binding
twee elementen hebben de neiging ionisch te binden wanneer ze sterk verschillen in elektronegativiteit.
Periodiek Systeem van elektronegativiteit
hoe lichter de tint groen, hoe hoger de elektronegativiteit. Grijs betekent dat er geen waarde bekend is. (Klik op de afbeelding voor een grotere weergave.)

covalent Bindingskarakter
absoluut zuivere ionisch gebonden verbindingen bestaan niet echt, omdat het positief geladen ion de elektronwolk van het negatieve ion polariseert.Dit is vooral merkbaar bij kleine, hoog geladen metaalionen zoals Al3+, hoewel het polariserende effect tot op zekere hoogte aanwezig is in alle ionverbindingen.De polarisatie is effectief een directioneel, elektron die effect delen, vandaar introduceert het een kleine hoeveelheid covalentie in Ionische samenstellingen.
de verhouding van ionisch / covalent gedrag in een binding kan zeer ruw geschat worden met behulp van de Paulingschaal van elektronegativiteit.Linus Pauling schatte dat een elektronegativiteitsverschil van 1,7 tussen elementen leidt tot binding die 50 procent ionisch is.
waarden onder 1 komen overeen met het domineren van covalente binding en waarden boven 2 met het domineren van ionische binding.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
De C-H binding met een verschil van 0,35 zal covalent zijn, terwijl NaCl binding bij 2,23 ionisch zal zijn.HCl binding op 0,96 zal polair covalent zijn, en LiI binding op 1,68 zal 50/50 ionisch / covalent zijn.het grootste elektronegativiteitsverschil is 3,19, tussen cesium (0,79) en fluor (3,98). De resulterende binding is ongeveer 95 procent ionisch van karakter.
