eigenschappen van covalente verbindingen
toen we het hadden over vaste ionverbindingen in Ionverbindingen, ontdekten we dat hun eigenschappen vaak voortkomen uit de sterke aantrekkingskracht van tegengestelde elektrische ladingen. Het zou niet als een verrassing moeten komen om te ontdekken dat de eigenschappen van covalente verbindingen grotendeels te wijten zijn aan de aard van covalente bindingen.
een van de belangrijkste dingen om te onthouden over covalente verbindingen is dat ze niet ionisch zijn. Dit lijkt voor de hand liggend, maar het verschil is eigenlijk subtieler dan je je kunt voorstellen. Om dit concept te illustreren, kijk naar de volgende figuur:
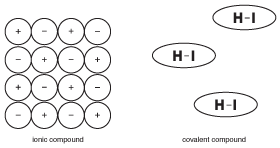
figuur 9.5 de eigenschappen van vaste ionverbindingen zijn gebaseerd op het feit dat veel ionen stevig op hun plaats worden gehouden met elektrische krachten. De Molecules in covalente samenstellingen, werken echter met relatieve onafhankelijkheid van naburige molecules.
in tegenstelling tot ionverbindingen, waar alle ionen in een groot kristal elkaar helpen bij elkaar te houden, worden de moleculen in een covalente verbinding bij elkaar gehouden door krachten die “intermoleculaire krachten” worden genoemd, die veel zwakker zijn dan chemische bindingen (meer over intermoleculaire krachten in vaste stoffen). Als gevolg daarvan worden de moleculen in een covalente verbinding niet tot elkaar aangetrokken zo veel als de ionen in ionische verbindingen. Dit verschil in structuur is belangrijk in het begrijpen van de eigenschappen van covalente samenstellingen.
covalente verbindingen hebben lage smelt-en kookpunten
zoals in Ionverbindingen wordt vermeld, is een grote hoeveelheid energie nodig om een ionverbinding te smelten vanwege de sterke interacties tussen kationen en anionen in een ionenkristal. Nochtans, in covalente samenstellingen, zijn alle molecules slechts zwak aan naburige molecules gebonden; daarom, vergt het zeer weinig energie om covalente molecules van elkaar te scheiden.
veel beginnende scheikundestudenten geloven ten onrechte dat wanneer een covalent molecuul smelt, covalente bindingen worden verbroken. Dit is vals. Als ionische verbindingen smelten, faalt de Ionische aantrekking. Wanneer covalente verbindingen smelten, trekken de moleculen gewoon weg van elkaar, waardoor de bindingen intact blijven.
covalente verbindingen zijn slechte geleiders
Ionverbindingen zijn grote geleiders van elektriciteit wanneer opgelost of gesmolten. Zoals vermeld in Ionverbindingen, is dit omdat ionverbindingen mobiele ionen hebben die elektrische lading van de ene plaats naar de andere kunnen overbrengen. Ze geleiden ook heel goed warmte omdat de ionen allemaal vlak naast elkaar liggen, waardoor energie efficiënt van de ene plaats naar de andere kan worden overgebracht.
covalente verbindingen daarentegen zijn bijna altijd goede isolatoren van zowel elektriciteit als warmte. Elektriciteit kan niet efficiënt worden geleid door covalente verbindingen omdat er geen ionen zijn om de elektrische lading te verplaatsen. Een uitstekend voorbeeld hiervan is in uw eigen huis, waar het metaal in uw verlengsnoeren is bedekt met plastic om te voorkomen dat uw kat wordt geëlektrocuteerd. Warmte gaat ook niet goed door covalente verbindingen omdat de moleculen niet zo strak aan elkaar worden gehouden als de ionen in een ionische verbinding, waardoor warmteoverdracht minder efficiënt is. Daarom gebruik je ovenwanten om je koekjes uit de oven te halen in plaats van je handen te bedekken met zout.
covalente verbindingen verbranden soms
organische verbindingen zijn covalente verbindingen die koolstof bevatten. Ze bevatten meestal ook waterstof. en kan kleinere hoeveelheden andere elementen zoals stikstof, zwavel, fosfor, zuurstof, of een van de halogenen bevatten.
veel covalente verbindingen zijn ontvlambaar en verbranden gemakkelijk door toevoeging van warmte. De belangrijkste groep van covalente verbindingen die brandbaar zijn worden organische verbindingen genoemd. Organische verbindingen branden omdat ze koolstof en waterstof bevatten, die beide mooi combineren met zuurstof bij hoge temperaturen.
het is belangrijk om in gedachten te houden dat niet alle covalente verbindingen branden?bijvoorbeeld, water is een covalente verbinding en je zult het heel moeilijk hebben om er een vuur mee aan te steken. Echter, veel meer covalent dan ionische verbindingen zijn brandbaar.
Ontvlambaarheid is een algemene eigenschap van covalente verbindingen omdat een grote meerderheid van de bekende covalente verbindingen organisch is. Aangezien de meeste organische verbindingen branden, kunnen we dit veilig opsommen als een eigenschap van covalente verbindingen, ook al zijn er veel covalente verbindingen die niet branden.
uittreksel uit de Complete Idiot ‘ s Guide to Chemistry 2003 door Ian Guch. Alle rechten voorbehouden, met inbegrip van het recht op volledige of gedeeltelijke reproductie in welke vorm dan ook. Gebruikt in overleg met Alpha Books, lid van Penguin Group (USA) Inc.
om dit boek rechtstreeks bij de uitgever te bestellen, bezoek de website van Penguin USA of bel 1-800-253-6476. U kunt dit boek ook bij Amazon kopen.com en Barnes & Noble.