een 49-jarige man met een voorgeschiedenis van alcoholmisbruik heeft de laatste 36 uur klachten van gegeneraliseerde buikpijn en braken. De patiënt is bekend bij de afdeling voor alcoholgerelateerde bezoeken en blijft dagelijks drinken. Bij aankomst, hij is tachycardische en tachypneic, en lichamelijk onderzoek bevindingen omvatten droge slijmvliezen, verminderde sakin turgor, epigastrische gevoeligheid, en een tremor in beide handen. Laboratoriumstudies tonen een serumbicarbonaat van 10 mEq/L, een anion gap van 30, een serum glucose van 95 mg / dL, een lactaatacidose met pH 7,2, hypofosfatemie en spoorketonurie. Abdominale CT scan is normaal. Hij ontkent een voorgeschiedenis van diabetes mellitus, inname van toxische alcoholen, of recente ziekte.
deze patiënt kan een van de vele diagnoses hebben, maar zijn presentatie en laboratoriumbevindingen komen het meest overeen met alcoholische ketoacidose (AKA). AKA kan een gemeenschappelijke diagnose van ED zijn en komt typisch voor in chronische alcoholdrinkers die een abrupte onderbreking in hun alcoholinname hebben gekoppeld aan verminderde glycemische inname en intravasculaire volumeuitputting.1
in de meeste gevallen leidt een precipiterend voorval zoals pancreatitis, gastritis of een aspiratiepneumonie tot een abrupte afname van de orale inname. Ongeveer 24 tot 72 uur na het stoppen van PO inname, AKA kan ontwikkelen.2 deze patiënten hebben meestal een lage of afwezige serum alcoholconcentratie en kunnen zich presenteren met verschillende graden van alcohol terugtrekking. Een duidelijk sensorium is echter een kenmerk van deze aandoening. De aanwezigheid van een verandering in bewustzijn suggereert sterk dat er een ander proces aanwezig is.3
hoewel de onderliggende pathofysiologie complex is, helpt een goed begrip in hoge mate bij de diagnose en behandeling van deze aandoening.
Er zijn drie algemene concepten die rijden, ook bekend als:
- alcoholopname, aangevuld met verminderde calorie-inname en dehydratie, bevordert een ketotische toestand.ketoacidose wordt veroorzaakt door een combinatie van factoren, waaronder door verhongering geïnduceerde hypoinsulinemie, oxidatie van alcohol tot de verschillende ketonmetabolieten, lipolyse met vrij vetzuur (FFA) afgifte en intravasculaire volumescontractie. De relatieve verhongeringstoestand in AKA leidt tot bovenmatige glucagonafscheiding en verminderde perifere insulineconcentraties, die een belangrijke rol in het ontwikkelen van ketoacidose speelt. Het metabolisme van vetten door lipolyse produceert bèta-hydroxybutyraat (BHB) en acytyl-acetaat (ACA). Deze ketonen worden gebruikt voor cellulaire ademhaling om energie door de productie van adenosine trifosfaat (ATP) te verstrekken, maar toe te voegen aan de anion gap acidose die in AKA wordt gezien.
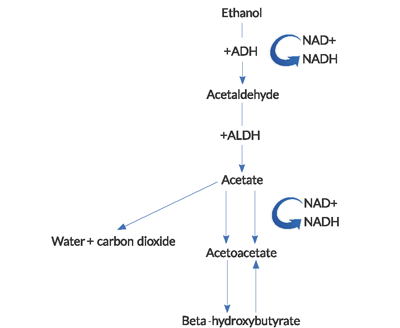
- Tijdens het metabolisme van ethanol worden hoge hoeveelheden NADH (de gereduceerde vorm van nicotinamide-adeninedinucleotide ) gegenereerd.4
NAD+ is een co-enzym dat wordt gebruikt om elektronen in intracellulaire redoxreacties te dragen. De vermindering van NAD+ en consequentiële accumulatie en onbalans van NADH in het metabolisme van ethanol heeft verscheidene belangrijke gevolgen. BHB generatie overheerst over de productie van ACA in deze hoge NADH tot NAD+ verhouding. Deze abnormale verhouding leidt tot een remming van de citroenzuurcyclus en hepatische gluconeogenese, die gedeeltelijk verklaart waarom hyperglycemie zeldzaam is bij deze patiënten.Bijna contra-intuïtief, is er een mislukking om normale niveaus van NAD+ en ACA in AKA te regenereren. De reoxidization van NADH aan NAD+ schijnt door een combinatie van factoren, met inbegrip van hypofosfatemia en een functioneel blok binnen mitochondria te worden beperkt.2de lactaatacidose gezien in AKA is te wijten aan een abnormale redox toestand. Pyruvate is een substraat dat in talrijke energie-producerende wegen wordt gebruikt, maar in alcoholische ketoacidose, wordt het verschoven van zijn normale metabolische wegen aan anderen die lactaatproductie verhogen. Bovendien is de regeneratie van pyruvaat uit melkzuur verminderd.
- een verhoogde adrenerge toestand en volumedepletie verergeren ketose en remt de gluconeogenese, waardoor een toestand ontstaat die bevorderlijk is voor het ontstaan en het behoud van een ketotisch milieu.het lichaam reageert op uithongering, uitdroging en hypoglykemie met het vrijkomen van contraregulerende hormonen. Deze hormonen verhogen de sympathische toon, verlagen de insulineafgifte en verhogen de ketonconcentratie door de afgifte van FFA ‘ s en het verminderde perifere ketonmetabolisme. Al deze veranderingen bestendigen de ketotische toestand totdat glucose opnieuw in het systeem wordt ingevoerd. Significante dehydratie als gevolg van braken en verminderde orale inname leiden tot een verminderde renale ketonklaring, wat de situatie verder verergert.2de differentiële diagnose voor AKA moet onder meer uithongering ketose en diabetische ketoacidose (DKA). Hoewel een grondige geschiedenis kan helpen om het verschil te verkleinen, is een metabolisch panel essentieel om de diagnose te bevestigen. Anion gaten van 30 mEq / L of meer kunnen worden gezien in AKA, hoewel de kloof kan worden verduisterd door een gelijktijdige primaire metabole alkalose als gevolg van braken. In feite, zijn er gevalrapporten van patiënten met AKA die een alkalemische serum pH toe te schrijven aan overmatig braken hebben.De anion kloof in honger ketose is meestal veel lager, met bicarbonaatniveaus zelden onder 18 mEq / L, en serum pH meestal boven 7.30.2 in DKA, daarentegen, kan de anion gap vrij hoog zijn, met bicarbonaatniveaus die vaak de enkele cijfers bereiken. Hyperglycemie met glycosurie, typisch gezien bij diabetische ketoacidose (DKA), is zeldzaam met AKA.4 chronische ondervoeding leidt tot lage glycogeenreserves en de verhoogde adrenerge tonus leidt tot remming van hepatische gluconeogenese. Ketonuria, huidig in alle drie van deze voorwaarden, kan de strengheid van AKA verwarren.Ketonurie wordt gemeten door de nitroprusside test, waarbij een kleurverandering de relatieve concentratie van aceton en ACA in de urine aangeeft. De aanwezigheid van BHB, de meest prominente keton aanwezig in AKA, wordt niet weerspiegeld door de nitroprusside test. Dit verklaart waarom de patiënten met AKA geen of slechts lichte ketonuria op aanvankelijke presentatie kunnen tonen, met een paradoxale verhoging aangezien de voorwaarde omgekeerd is. Naarmate de verhouding ACA: BHB normaliseert, worden zowel de detecteerbare ACA als BHB in de urine uitgescheiden.
differentiële diagnose
andere levensbedreigende aandoeningen die een significante anion gap acidose kunnen veroorzaken, moeten ook in de differentiële diagnose worden overwogen. De toxische alcoholen, in het bijzonder methanol en ethyleenglycol, kunnen opzettelijk of per ongeluk worden ingenomen in deze patiëntenpopulatie. Deze inname kan leiden tot aanzienlijke morbiditeit en mortaliteit indien niet adequaat beheerd.5 veranderde mentale toestand is een gemeenschappelijk kenmerk van toxische alcohol inname, maar wordt meestal niet gezien in AKA.5
patiënten hebben doorgaans een initiële osmolaire gap die overgaat naar een verhoogde anion gap wanneer de toxische alcohol wordt gemetaboliseerd. Verhoogde serum BHB concentratie kan vrij verhoogd zijn in AKA, maar dit sluit niet noodzakelijk de mogelijkheid van toxische alcohol inname uit; noch sluit de afwezigheid van een osmolaire of anion kloof de diagnose uit. Terwijl patiënten in AKA een lichte lactaatacidose hebben, zou de aanwezigheid van een significant verhoogd lactaatniveau de zoektocht naar een onderliggende ziekte moeten veroorzaken. Zelden, kan een combinatie van AKA en een van deze andere gebeurtenissen voorkomen en een diagnostisch raadsel presenteren. Bij gebrek aan een duidelijke en nauwkeurige anamnese moet rekening worden gehouden met het tijdstip, de aard en de hoeveelheid van de inname en de bijbehorende symptomen, in combinatie met observatie en laboratoriumonderzoek.
behandeling
de omkering van ketose en krachtige rehydratie staan centraal in de behandeling van AKA. Naast isotone vloeistofvervanging zijn dextrose bevattende intraveneuze vloeistoffen nodig. Typisch, verstrekt 5% dextrose met half-normale zoutoplossing aan een tarief van 150 mL per uur voldoende glucose om de alvleesklier te stimuleren om insuline af te scheiden, toestaand randweefsels om ketonen te metaboliseren en FFA-versie te remmen.2 Het staat het lichaam ook toe om NAD + te regenereren, die door de metabolische veranderingen wordt geremd die door AKA worden veroorzaakt. Intraveneuze infusie van dextrose bevattende vloeistof moet worden gestopt zodra de bicarbonaatspiegels 18-20 mEq/L hebben bereikt en de patiënt orale inname verdraagt. Dit gebeurt doorgaans 8 tot 16 uur na aanvang van de behandeling.2 alcoholonttrekking bij deze patiënten dient agressief te worden behandeld met intraveneuze benzodiazepines. Thiamine, folaat en andere elektrolyten, met name fosfaat en kalium, moeten mogelijk bij deze patiënten worden aangevuld.6 interessant, is de meerderheid van morbiditeit gezien in AKA toe te schrijven aan het onderliggende proces dat de stopzetting van alcohol veroorzaakte.
conclusie van het geval
de patiënt kreeg 4 liter normale zoutoplossing en werd gestart met D5-1/2 NS vóór opname. Hij kreeg IV valium voor alcoholonttrekking, en thiamine, folaat en fosfaat werden aangevuld. Hij werd in het ziekenhuis opgenomen voor drie dagen voor het beheer van AKA en alcohol terugtrekking, dan ontslagen eenmaal tolereren orale inname en in goede staat. Hij werd drie weken later gezien op de spoedeisende hulp voor een soortgelijke presentatie.
Tabel 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Pathway of alcohol metabolism
(ADH = alcohol dehydrogenase, ALDH = aceetaldehyde dehydrogenase).
- Palmer, Jerry P. alcoholische ketoacidose: klinische en laboratoriumpresentatie, pathofysiologie en behandeling. Clinics in endocrinology and metabolism 12.2 (1983): 381-389.
- Duffens K, Marx JA. Alcoholische ketoacidosis beoordeling.The Journal of emergency medicine 5.5 (1987): 399-406.
- Wrenn KD, Slovis CM, Minion GE, et al. Het syndroom van alcoholische ketoacidose. The American journal of medicine 91.2 (1991): 119-128.Marx JA, Hockberger RS, Walls RM, et al., EDS. Rosens ™ spoedeisende geneeskunde: concepten en klinische praktijk. Philadelphia, PA: Mosby / Elsevier; 2013. Hoofdstuk 185 alcoholgerelateerde ziekte door John T. Finnell.Kraut Ja, Kurtz I. ” toxische alcoholinname: klinische kenmerken, diagnose en behandeling. Clinical Journal of the American Society of Nephrology 3.1 (2008): 208-225.
- Miller PD, Heinig R, Waterhouse C. Treatment of alcoholic acidosis: the role of dextrose and fosfor. Archives of internal medicine 138.1 (1978): 67-72.