periodieke trends en solventeffecten in nucleofiliciteit
er zijn voorspelbare periodieke trends in nucleofiliciteit. Horizontaal over de tweede rij van de tabel beweegt de trend in nucleofiliciteit parallel met de trend in basiciteit:
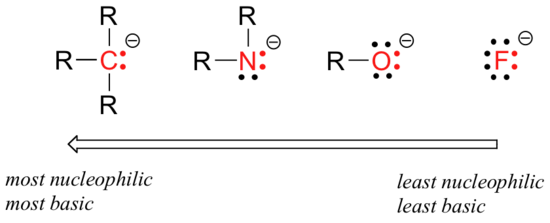
de redenering achter de horizontale nucleofiliciteitstrend is dezelfde als de redenering achter de basiciteitstrend: meer elektronegatieve elementen houden hun elektronen strakker vast, en zijn minder in staat om ze te doneren om een nieuwe band te vormen.
deze horizontale trends vertellen ons ook dat aminen nucleofieler zijn dan alcoholen, hoewel beide groepen gewoonlijk als nucleofielen optreden in zowel laboratorium-als biochemische reacties.
bedenk dat de basiciteit van atomen afneemt als we verticaal naar beneden bewegen in een kolom op het periodiek systeem: thiolaationen zijn bijvoorbeeld minder basisch dan alkoxide-ionen en bromide-ion is minder basisch dan chloride-ion, dat op zijn beurt minder basisch is dan fluoride-ion. Bedenk ook dat deze trend kan worden verklaard door rekening te houden met de toenemende omvang van de ‘elektronenwolk’ rond de grotere ionen: de elektronendichtheid die inherent is aan de negatieve lading wordt verspreid rond een groter gebied, wat de stabiliteit verhoogt (en dus de basiciteit vermindert).
De verticale periodieke trend voor nucleofiliciteit is iets ingewikkelder dan die voor basiciteit: afhankelijk van het oplosmiddel waarin de reactie plaatsvindt, kan de nucleofilicity trend in beide richtingen gaan. Laten we het eenvoudige voorbeeld van de SN2 reactie hieronder nemen:
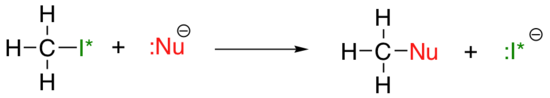
. . .waar Nu-een van de halogenide-ionen is: fluoride, chloride, bromide of jodide, en de verlatingsgroep I* is een radioactieve isotoop van jodium (waardoor we de verlatingsgroep kunnen onderscheiden van het nucleofiel in dat geval waar beide jodide zijn). Als deze reactie optreedt in een protisch oplosmiddel (dat wil zeggen een oplosmiddel dat een waterstof gebonden heeft aan een zuurstof of stikstof – water, methanol en ethanol zijn de belangrijkste voorbeelden), dan zal de reactie het snelst gaan wanneer jodide het nucleofiel is, en het traagst wanneer fluoride het nucleofiel is, wat de relatieve sterkte van het nucleofiel weergeeft.
relatieve nucleofiliciteit in een protisch oplosmiddel
Dit is natuurlijk tegengesteld aan de verticale periodieke trend voor basiciteit, waarbij jodide het minst basisch is. Wat is hier aan de hand? Zou de sterkere basis, met zijn meer reactieve, niet-gebonden valentie-elektronen, niet ook de sterkere nucleofiel moeten zijn?
zoals hierboven vermeld, heeft het allemaal te maken met het oplosmiddel. Vergeet niet, we hebben het nu over de reactie die loopt in een protisch oplosmiddel zoals ethanol. Protische solventmoleculen vormen zeer sterke ion-dipoolinteracties met het negatief geladen nucleofiel, waardoor in wezen een ‘solventkooi’ rond het nucleofiel ontstaat:

wil het nucleofiel de elektrofiel aanvallen, dan moet het ten minste gedeeltelijk uit zijn solvent-kooi breken. De eenzame paarelektronen op het grotere, minder basisch jodide-ion interageren minder strak met de protonen op de protische oplosmiddelmoleculen – zo is het jodide-nucleofiel beter in staat om zich los te maken van zijn solvent-kooi in vergelijking met het kleinere, meer basisch fluoride-ion, waarvan de eenzame paarelektronen strakker gebonden zijn aan de protonen van de kooi.
het beeld verandert als we overschakelen naar een polair aprotisch oplosmiddel, zoals aceton, waarin een moleculaire dipool aanwezig is, maar geen waterstof gebonden aan zuurstof of stikstof. Fluoride is het beste nucleofiel en jodide het zwakste.

Relatieve nucleophilicity in een polar aprotisch oplosmiddel
De reden voor de omkering is dat, met een aprotisch oplosmiddel, de ion-dipool interacties tussen oplosmiddel en nucleophile zijn veel zwakker: de positieve einde van het oplosmiddel van de dipool is verborgen in het interieur van het molecuul, en het is dus afgeschermd van de negatieve lading van de nucleophile.
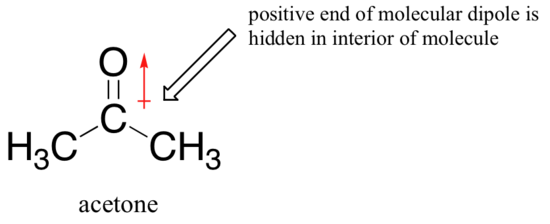
een zwakkere solvent-nucleofiele interactie betekent een zwakkere solvent-kooi voor het nucleofiel om door te breken, dus het solvent-effect is veel minder belangrijk, en het meer basisch fluoride-ion is ook het betere nucleofiel.
waarom niet een volledig niet-polair oplosmiddel, zoals hexaan, gebruiken voor deze reactie, zodat de solvent kooi volledig wordt geëlimineerd? Het antwoord hierop is eenvoudig: het nucleofiel moet in oplossing zijn om met de elektrofiel merkbaar te kunnen reageren, en een oplosmiddel zoals hexaan zal een geladen (of zeer polair) nucleofiel helemaal niet oplossen. Daarom gebruiken chemici polaire aprotische oplosmiddelen voor nucleofiele substitutiereacties in het laboratorium: ze zijn polair genoeg om het nucleofiel op te lossen, maar niet zo polair om het op te sluiten in een ondoordringbare solventkooi. Naast aceton, zijn drie andere algemeen gebruikte polaire aprotic oplosmiddelen acetonitril, dimethylformamide (DMF), en dimethylsulfoxide (DMSO).
in de biologische chemie, waar het oplosmiddel protisch (water) is, is de belangrijkste implicatie van de periodieke trends in nucleofiliciteit dat thiolen krachtiger nucleofielen zijn dan alcoholen. De thiolgroep in een cysteïne aminozuur is bijvoorbeeld een krachtig nucleofiel en werkt vaak als nucleofiel in enzymatische reacties, en natuurlijk zijn negatief geladen thiolaten (RS -) nog nucleofieler. Dit wil niet zeggen dat de hydroxylgroepen op serine, threonine en tyrosine ook niet als nucleofielen fungeren – dat doen ze wel.