Doelen
- Bekende en onbekende oplossingen van de metaal-ionen \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) en \(\ce{Hg^{2+}}\) worden geanalyseerd met behulp van papier chromatografie.
- een onbekende oplossing die enkele van deze kationen bevat, zal worden geïdentificeerd door vergelijking met de Rf-waarden en kleuren van de gekleurde vlekken van bekende oplossingen.
De meeste chemici en vele andere wetenschappers moeten regelmatig mengsels scheiden en de bestanddelen ervan identificeren. Het vermogen om de stoffen die in een monster worden gevonden kwalitatief te identificeren, kan van cruciaal belang zijn. Een milieuchemicus die monsters van verontreinigd grondwater onderzoekt, zal bijvoorbeeld willen weten welke giftige ionen in een monster aanwezig kunnen zijn.
chromatografie is een van de eerste hulpmiddelen die in dergelijke situaties worden gebruikt. In deze techniek kunnen vele soorten mengsels worden gescheiden in de component zuivere stoffen; in vergelijking met een standaardmonster kan ook elk bestanddeel voorlopig worden geïdentificeerd.
Er bestaan vele chromatografievarianten, die elk zijn ontworpen om specifieke soorten mengsels te scheiden. De gemeenschappelijke eigenschap van elk type van chromatografie is dat een mobiele fase (een vloeistof of gas) door een stationaire fase (een vast lichaam) wordt geduwd. Tabel 1 geeft een overzicht van verschillende variëteiten van chromatografie en typische identiteiten van de fasen. Papierchromatografie zal in dit experiment worden gebruikt.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
het voorbeeld van kolomchromatografie (figuur 1) toont de typische kenmerken van deze analytische techniek. Het diagram toont een experiment waar een tweecomponentenmengsel aan kolomchromatografie wordt onderworpen. De kolom is verpakt met een vast materiaal genaamd de stationaire fase. Een vloeibaar oplosmiddel of eluting-oplossing wordt in de kolom gegoten en bevochtigt het vaste verpakkingsmateriaal volledig. Vervolgens wordt het mengsel op de bovenkant van de natte kolom geladen en wordt er meer eluent toegevoegd. Zwaartekracht trekt de mobiele fase naar beneden door de stationaire fase en de componenten in het mengsel beginnen te bewegen door de kolom met verschillende snelheden. In het diagram beweegt component A sneller dan component B; dus wordt component B langer op de kolom bewaard dan component A. meestal is dit te wijten aan een verschil in oplosbaarheid van de twee verbindingen in het oplosmiddel en/of aan een verschil in aantrekking tot het vaste verpakkingsmateriaal. Naarmate er meer eluent aan de bovenkant van de kolom wordt toegevoegd, zullen de componenten de kolom uiteindelijk afzonderlijk verlaten. De tijd die nodig is om de kolom te verlaten, de zogenaamde retentietijd, zal reproduceerbaar zijn voor elke component onder de gegeven ingestelde omstandigheden-mobiele en stationaire fase identiteiten, temperatuur en kolombreedte. Zodra de componenten de kolom verlaten, kan het oplosmiddel door verdamping worden verwijderd en kunnen de zuivere componenten verder worden geanalyseerd of geïdentificeerd.
figuur 1: een typisch kolomchromatografieexperiment toont de scheiding van een tweecomponentenmengsel aan.
voorlopige identificatie van de bestanddelen kan worden bereikt door het onbekende mengsel een zorgvuldig bereid bekend mengsel te vergelijken: als een bekend bestanddeel onder dezelfde omstandigheden dezelfde retentietijd heeft als een onbekend bestanddeel, is het waarschijnlijk—maar niet overtuigend—dat de twee bestanddelen hetzelfde zijn. Verdere analyse kan nodig zijn om deze hypothese te bevestigen. Als de bekende en de onbekende hebben verschillende retentie tijden, dan is het niet waarschijnlijk dat de twee componenten identiek zijn.
andere variaties van chromatografie gebruiken capillaire werking—de aantrekking van een vloeistof op een vast oppervlak—om een oplosmiddel door vast materiaal te trekken. Een informele versie van papierchromatografie kan worden waargenomen wanneer een in inkt geschreven pagina in contact komt met water of andere vloeistoffen. De inkt loopt en verschillende kleuren zijn gescheiden in de inkt streep.
het onderstaande diagram (Figuur 2) toont het resultaat van een experiment met dunnelaagchromatografie. Twee zwarte inktvlekken op het vaste oppervlak hebben een oplosmiddel door hen laten gaan. Het oplosmiddel is water of een andere vloeistof die door de stationaire fase door capillaire actie wordt getrokken. In dit voorbeeld wordt een stuk kunststof bekleed met een poedervormige vaste stof gebruikt als de stationaire fase. Als alternatief kan een stuk filtreerpapier als stationaire fase worden gebruikt. Het experiment toont aan dat de zwarte inkt een mengsel is dat verschillende gekleurde stoffen bevat. Elke component heeft een iets andere Oplosbaarheid in de mobiele fase, dus wanneer de vloeistof door de stationaire fase wordt getrokken, beweegt elke component met een andere snelheid, het scheiden van de inkt in vlekken van verschillende kleuren.
Figuur 2: dunnelaagchromatografie van zwarte inkt na ontwikkeling. Deze foto laat een veel voorkomend probleem zien waarbij de vlekken verbreden als ze de plaat omhoog bewegen, en uiteindelijk aan de bovenkant van de plaat samensmelten.
in dit experiment worden soortgelijke principes gebruikt om verschillende metaalkationen te scheiden door middel van een papieren chromatografieprocedure. De metaalionen – \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\ce{cu^{2+}}\), en \(\ce{Hg^{2+}}\)—hebben verschillende Oplosbaarheid in de mobiele fase—waterige \(\ce{HCl}\) met ethyl en butylalcohol—en zullen met verschillende snelheden het papier op. De verschillende metaal-ion oplosbaarheden zijn waarschijnlijk te wijten aan de vorming van verschillende verbindingen met het chloride-ion en hun variërende vermogen om op te lossen in het organische oplosmiddel.
een diagram dat aangeeft hoe het papier moet worden voorbereid, wordt hieronder getoond. Standaardoplossingen die elk van deze ionen bevatten, worden op het papier Gespot met behulp van een capillaire buis, samen met een standaardoplossing die alle vijf ionen bevat. Een onbekende zal ook worden gespot op het papier. Zodra het papier klaar is, zal het worden ontwikkeld door het papier in het eluent te plaatsen. Na 75-90 minuten wordt het papier gevisualiseerd door het te bevochtigen met een waterige oplossing die kaliumjodide, \(\ce{KI}\) en kaliumferrocyanide, \(\ce{K4}\) bevat. De unieke kleur die voor elk ion wordt waargenomen wordt veroorzaakt door een chemische reactie met de visualisatieoplossing. Dit is een nuttige manier om te bepalen welke ionen aanwezig zijn in een onbekend mengsel.
Figuur 3: Diagram waaruit blijkt hoe het papier moet worden voorbereid voor het chromatografieexperiment
de afstand die het ion op het papier beweegt, kan ook worden gebruikt om het ion te identificeren. Echter, omdat studenten hun chromatografie experimenten zullen ontwikkelen voor verschillende hoeveelheden tijd en onder iets verschillende omstandigheden, zal elke student iets verschillende gemeten afstand voor een bepaald ion hebben. De verhouding tussen de afstand bewogen door een ion (\(D\)) en de afstand bewogen door het oplosmiddel (\(F\), oplosmiddelfront) is kenmerkend en zou voor alle studenten bijna hetzelfde moeten zijn. Deze verhouding wordt Rf genoemd, of ” retentiefactor.”
\
Procedure
materialen en uitrusting
chemische stoffen: 0.1 m waterige oplossingen van \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\), en \(\ce{Cu(NO3)2}\), elk met speciale capillaire buizen; eluting oplossing (waterige \(\ce{HCl}\) met ethyl en butylalcohol); visualisatie oplossing (waterige oplossing van \(\ce{Ki}\) en \(\CE{K4}\)).
apparatuur: schoon chromatografiepapier; latexhandschoenen voor eenmalig gebruik (nitril-handschoenen zijn verkrijgbaar in het magazijn voor mensen met een latexallergie); bekerglas van 600 mL; plastic folie; pincet of bekergang; liniaal *
* Items verkregen uit voorraadkamer
veiligheid
Vermijd contact met de metaalionenoplossingen, het eluteermiddel en de visualiseeroplossing. Draag wegwerphandschoenen om uw chromatogram aan te raken nadat de elutie optreedt en voor de rest van het experiment. Adem de dampen van het eluting-oplosmiddel of de visualiseeroplossing niet in. Plaats het natte chromatogram op een papieren handdoek, niet direct op de laboratoriumbank. Gebruik de visualiseringsoplossing alleen in de ruimte die door uw instructeur wordt geboden. Gooi de handschoenen en het chromatogram na het experiment weg in de opgegeven afvalcontainer. Was uw handen grondig na contact met alle oplossingen in dit lab.
voorbereiding van het papier voor chromatografie
- elk paar leerlingen moet een stuk filtreerpapier krijgen met de afmetingen in Figuur 3. Zorg ervoor dat het papier schoon is en zonder scheuren of plooien. Gebruik een potlood—geen pen—en een liniaal om een lijn over het papier te tekenen Een cm van de lange rand van het papier. Je ziet de metaalionoplossingen op deze lijn. Schrijf je naam in potlood in de linkerbovenhoek van het papier.
- oefen het spotten van water-en / of ionenoplossingen op een strook filtreerpapier, zodat u weet hoe u vlekken van de juiste grootte kunt maken. Gebruik glazen capillaire buizen om de ionen op het papier te spotten. Oplossing wordt aangebracht door een capillaire buis met de oplossing licht en snel aan te raken op de lijn die u op het papier tekende. De spots moeten tussen 5-8 mm in diameter. Plekken groter dan deze zullen zich overmatig verspreiden tijdens het experiment en analyse moeilijk maken.
- bekend 0.1 m waterige oplossingen van \(\ce{AgNO3}\), \(\ce{Hg(NO3) 2}\), \(\ce{Fe(NO3) 3}\), \(\ce{Co(NO3) 2}\) en \(\ce{Cu(NO3) 2}\) worden geleverd in reageerbuisjes die elk twee of drie capillaire buizen bevatten. Begin aan de linkerkant, markeer de identiteit van het ion onder elke plek met een potlood; dan spot elk bekend ion zorgvuldig op de lijn. Vermijd besmetting van de capillaire buis met andere ionen en plaats de capillaire buizen terug in de juiste reageerbuis. Een reageerbuis met een bekend mengsel van alle vijf ionen is ook voorzien van een set capillaire buizen. Spot dit mengsel ook op de lijn. Omdat deze oplossing verdunner is dan de single-ion bekende oplossingen, breng het bekende mengsel drie keer, laat de plek drogen tussen elke toepassing. Een warmte lamp zal helpen om de plek sneller te drogen.
- in reageerbuisjes, samen met capillaire buisjes, zijn ook verschillende onbekenden aanwezig. Uw instructeur zal u vertellen welke onbekende moet worden gebruikt. De onbekenden zullen tussen één en vier kationen bevatten, en zijn verdunder dan de single-ion bekende oplossingen. Het onbekende zal ook twee en vier keer moeten worden toegepast voor de twee proeven, laat de plek drogen tussen elke toepassing. In het geval van een fout, moet u de onbekende op twee plaatsen langs de lijn te vinden, zodat twee proeven beschikbaar zijn voor analyse.
ontwikkelen van het chromatografiepapier
- plaats een stuk tape langs de rechterbovenrand, zoals weergegeven in Figuur 3. Vorm dan een cilinder door de twee korte randen van het papier met de tape te verbinden. Zorg ervoor dat de randen elkaar niet raken. Het papier moet lijken op Figuur 4.
Figuur 4: gevouwen papier moet er zo uitzien voordat het experiment wordt ontwikkeld.
- verkrijg 15 mL van de eluteeroplossing. Giet voorzichtig wat van dit oplosmiddel in een bekerglas van 600 mL en draai voorzichtig voor een tweede of twee. Let op: adem de dampen van deze oplossing niet in! Zorg ervoor dat het niveau van de vloeistof onder de vleklijn op het papier zal zijn zodra het papier in de ontwikkelkamer wordt geplaatst.
- plaats de papieren cilinder in het bekerglas met de gemarkeerde rand naar beneden. De vlekken moeten zich boven het niveau van het oplosmiddel bevinden. Het papier mag de zijkanten van het bekerglas niet raken. Bedek het bekerglas zorgvuldig met plastic folie en plaats het gedurende 75-90 minuten in de kap. Het oplosmiddel moet beginnen om het papier omhoog te bewegen. Zodra de beker is bedekt, zorg ervoor dat het niveau en niet storen tijdens de ontwikkelperiode. Uw instructeur kan een opdracht voor u om te werken aan terwijl u wacht.
visualisatie en analyse van het papier
- zodra de ontwikkelingsperiode voorbij is, draag wegwerphandschoenen en verwijder het papier uit het bekerglas. Latex handschoenen zijn verkrijgbaar in het lab en nitril handschoenen zijn beschikbaar in het magazijn voor mensen met Latex allergieën. Laat het oplosmiddel terug in het bekerglas druppelen en verwijder de tape. Leg het chromatografiepapier op een papieren handdoek en markeer onmiddellijk de voorkant van het oplosmiddel met een potlood. Giet het gebruikte eluting oplosmiddel in de bijgeleverde afvalcontainer. Droog het papier onder een warmte lamp in de kap. Let: Adem de dampen niet in! Zorg ervoor dat u het papier niet onder de lamp verbrandt.
- zodra het papier droog is, breng het naar het visualisatiestation op de papieren handdoek. Dompel het papier kort in de visualiseringsoplossing in een ondiepe schaal in de dampkap. Haal het papier onmiddellijk uit de oplossing en laat overtollig papier op het station druppelen. Leg het natte papier op een droge papieren handdoek en droog het onmiddellijk onder een warmtelamp en breng het vervolgens naar uw bank voor analyse.
- Zoek eerst elke bekende single-ion en noteer de kleuren die u waarneemt. Sommige vlekken kunnen na verloop van tijd vervagen, dus neem de kleuren op terwijl het papier nog nat is. Meet de afstand elke verplaatste plek, D, met een liniaal. Meet tot het midden van elke plek. Registreer uw gegevens in de gegevenstabel.
- meet de afstand tot de voorkant van het oplosmiddel, F. De waarde van F moet ongeveer hetzelfde zijn over het hele papier. Gebruik deze waarden om de Rf voor elk ion te berekenen. Voer de metingen uit zoals weergegeven in Figuur 5. Elke waargenomen plek heeft zijn eigen Rf-waarde. Noteer uw resultaten in de gegevenstabel.
Figuur 5: Meting van de afstanden die worden gebruikt bij de berekening van Rf voor een spot.
- op de rijstrook die het mengsel bevat, vindt u elk ion en noteert u de afstand die door elk ion wordt afgelegd. Bereken de Rf voor elk ion in deze rijstrook. De waarden dienen nauw overeen te komen met die welke in de enkelvoudige ionenbronnen worden waargenomen.
- in de rijstrook met de onbekenden, zoek het midden van elke waargenomen plek en noteer de afstand en bereken de Rf-waarden. Gebruik de baan met de duidelijkste plekken. De kleur-en Rf-waarden voor de onbekende vlekken moeten nauw overeenkomen met enkele van de bekende ionen. U moet nu in staat zijn om te bepalen welke ion of ionen worden gevonden in uw Onbekende. Registreer uw gegevens in de bijbehorende tabel.
- Maak een schets van uw chromatogram in de ruimte die op uw labrapportformulier is aangegeven, waarbij u de positie en de grootte en vorm van elke plek op het papier bij benadering aangeeft. Gooi het papier weg in de daarvoor bestemde afvalcontainer.
Cleanup
plaats het chromatografiepapier en de gebruikte handschoenen in de meegeleverde afvalcontainer. De gebruikte elutingoplossing had al in een andere afvalcontainer moeten worden geplaatst. Merk op dat er twee verschillende afvalcontainers zijn voorzien voor dit experiment dus zorg ervoor dat u de labels leest zodat u de juiste gebruikt! Zorg ervoor dat u uw handen grondig wast voordat u het laboratorium verlaat.
Pre-laboratoriumtoewijzing: Papierchromatografie
- Een tweecomponentenmengsel wordt geanalyseerd met papierchromatografie. Component A is oplosbaarder in de mobiele fase dan component B. Het volgende resultaat wordt verkregen. Bereken de Rf voor elke component en label de identiteit van elke plek.
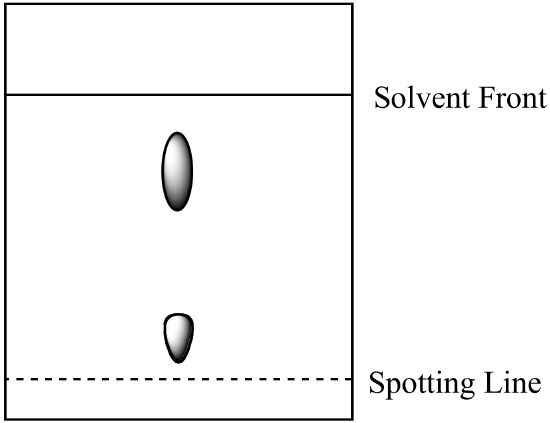
- het mengsel uit vraag 1 (hierboven) wordt geanalyseerd met behulp van kolomchromatografie met dezelfde mobiele fase en een stationaire fase van silicagel. Welke component heeft de kortere retentietijd? Leg je antwoord uit. (Neem aan dat hetzelfde type bindingskrachten tussen de componenten en de stationaire fase aanwezig zijn in zowel papierchromatografie als kolomchromatografie.)
- een onbekend vloeibaar monster wordt geanalyseerd met behulp van papierchromatografie, waarbij oplosmiddel X als mobiele fase wordt gebruikt. Een plek wordt waargenomen nadat de plaat is ontwikkeld en gevisualiseerd. Dezelfde onbekende stof wordt opnieuw geanalyseerd met behulp van oplosmiddel Y als de mobiele fase. Deze keer worden drie vlekken waargenomen nadat de plaat is ontwikkeld en gevisualiseerd.
- Is het onbekende monster een zuivere stof of een mengsel? Leg uw antwoord uit, inclusief een mogelijke reden voor de verschillende observaties in de twee experimenten.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Onbekende ID-Code | Ionen Geïdentificeerd |
|---|---|
Vragen en Conclusies
- Welke criteria werden gebruikt voor het identificeren van het ion(s) gevonden in het onbekende? Leg je antwoord in minstens drie zinnen uit. Eventuele problemen bij het identificeren van ionen bevatten.
- Als u het experiment slechts 30 minuten laat lopen, Wat is dan het waarschijnlijke resultaat? Zouden er problemen ontstaan bij de identificatie van het onbekende?
- als \(\ce{Co^{2+}}\) en \(\ce{Cu^{2+}}\) vlekken dezelfde kleur hadden, zou de identificatie van een onbekende dan moeilijker zijn? Leg je antwoord uit.