Video \(\Paginindex{1}\): A brief introduction to the genius of Mendelejev.
toen vroege chemici ertsen zuiverden en meer elementen ontdekten, realiseerden ze zich dat verschillende elementen konden worden gegroepeerd door hun vergelijkbare chemische gedrag. Een dergelijke groepering omvat lithium (Li), natrium (Na), en kalium (K): Deze elementen zijn allemaal glanzend, geleiden warmte en elektriciteit goed, en hebben vergelijkbare chemische eigenschappen. Een tweede groep omvat calcium (Ca), strontium (Sr) en barium (Ba), die ook glanzend, goede geleiders van warmte en elektriciteit, en hebben chemische eigenschappen gemeen. De specifieke eigenschappen van deze twee groepen verschillen echter aanzienlijk van elkaar. Bijvoorbeeld: Li, Na, en K zijn veel meer reactief dan Ca, Sr, en Ba; Li, Na, en K vormen samenstellingen met zuurstof in een verhouding van twee van hun atomen aan één zuurstofatoom, terwijl Ca, Sr, en Ba samenstellingen met één van hun atomen aan één zuurstofatoom vormen. Fluor (F), chloor (Cl), Broom (Br) en jodium (I) vertonen ook soortgelijke eigenschappen, maar deze eigenschappen zijn drastisch verschillend van die van een van de bovenstaande elementen.Dimitri Mendelejev in Rusland (1869) en Lothar Meyer in Duitsland (1870) erkenden onafhankelijk dat er een periodiek verband bestond tussen de eigenschappen van de elementen die op dat moment bekend waren. Beide gepubliceerde tabellen met de elementen gerangschikt volgens toenemende atoommassa. Maar Mendelejev ging een stap verder dan Meyer: hij gebruikte zijn tafel om het bestaan van elementen te voorspellen die de eigenschappen zouden hebben die vergelijkbaar zijn met aluminium en silicium, maar die nog onbekend waren. De ontdekkingen van gallium (1875) en germanium (1886) vormden een grote steun voor Mendelejev ‘ s werk. Hoewel Mendelejev en Meyer een lang conflict hadden over de prioriteit, worden Mendelejev ‘ s bijdragen aan de ontwikkeling van het periodiek systeem nu meer algemeen erkend (figuur \(\Paginindex{1}\)).
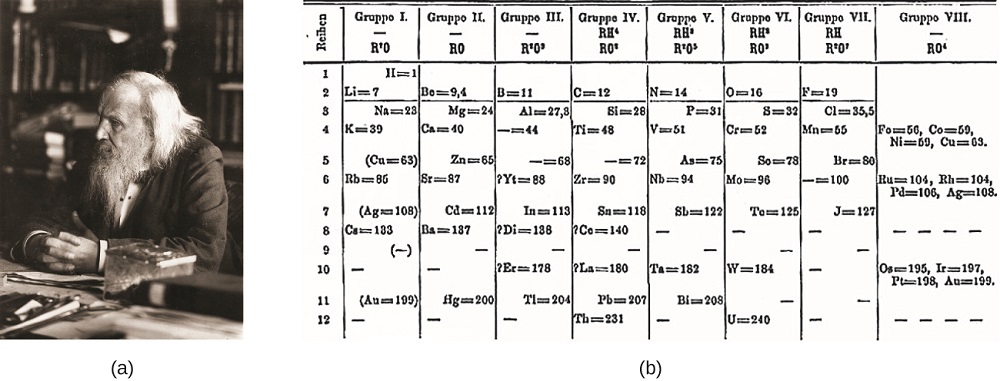
figuur \(\Paginindex{1}\): (a) Dimitri Mendelejev wordt algemeen gecrediteerd met het creëren (b) het eerste periodiek systeem van de elementen. (credit a: modification of work by Serge Lachinov; credit b: modification of work by “Den fjättrade ankan” / Wikimedia Commons)
Video \(\Paginindex{2}\): Een inleiding tot de organisatie van het periodiek systeem in perioden en groepen. Deze organisatie zal belangrijk zijn als we voortbouwen op de principes van de chemie.
tegen de twintigste eeuw werd het duidelijk dat de periodieke relatie atoomnummers inhield in plaats van atoommassa ‘ s. De moderne verklaring van deze relatie, de periodieke wet, is als volgt: de eigenschappen van de elementen zijn periodieke functies van hun atoomgetallen. Een modern periodiek systeem rangschikt de elementen in toenemende volgorde van hun atoomnummers en groepeert atomen met vergelijkbare eigenschappen in dezelfde verticale kolom (figuur \(\Paginindex{2}\)). Elke doos vertegenwoordigt een element en bevat zijn atoomnummer, symbool, gemiddelde atoommassa en (soms) naam. De elementen zijn gerangschikt in zeven horizontale rijen, die perioden of reeksen worden genoemd, en 18 verticale kolommen, die groepen worden genoemd. Groepen worden bovenaan elke kolom gelabeld. In de Verenigde Staten waren de labels traditioneel cijfers met hoofdletters. IUPAC raadt echter aan om de nummers 1 tot en met 18 te gebruiken, en deze labels komen vaker voor. Om de tabel op een enkele pagina te laten passen, worden Delen van twee van de rijen, in totaal 14 kolommen, gewoonlijk onder het hoofdgedeelte van de tabel geschreven.

figuur \(\Paginindex{2}\): elementen in het periodiek systeem zijn georganiseerd volgens hun eigenschappen.
veel elementen verschillen sterk in hun chemische en fysische eigenschappen, maar sommige elementen zijn vergelijkbaar in hun gedrag. Bijvoorbeeld, veel elementen lijken glanzend, zijn kneedbaar (kunnen worden vervormd zonder te breken) en nodulair (kan worden getrokken in draden), en geleiden warmte en elektriciteit goed. Andere elementen zijn niet glanzend, kneedbaar of nodulair, en zijn slechte geleiders van warmte en elektriciteit. We kunnen de elementen sorteren in grote klassen met gemeenschappelijke eigenschappen: metalen (elementen die glanzend, kneedbaar, goede geleiders van warmte en elektriciteit—schaduw geel); niet-metalen (elementen die dof lijken, slechte geleiders van warmte en elektriciteit-schaduw groen); en metalloïden (elementen die warmte en elektriciteit matig goed geleiden, en bezitten sommige eigenschappen van metalen en sommige eigenschappen van niet-metalen-gearceerde paars).
de elementen kunnen ook worden ingedeeld in de hoofdgroep-elementen (of representatieve elementen) in de kolommen met het label 1, 2 en 13-18; de overgangsmetalen in de kolommen met het label 3-12; en binnenste overgangsmetalen in de twee rijen aan de onderkant van de tabel (de bovenste rij-elementen worden lanthaniden genoemd en de onderste rij-elementen zijn actiniden; figuur \(\Paginindex{3}\)). De elementen kunnen verder worden onderverdeeld door meer specifieke eigenschappen, zoals de samenstelling van de verbindingen die ze vormen. De elementen in groep 1 (de eerste kolom) vormen bijvoorbeeld verbindingen die bestaan uit één atoom van het element en één atoom waterstof. Deze elementen (behalve waterstof) staan bekend als alkalimetalen, en ze hebben allemaal vergelijkbare chemische eigenschappen. De elementen in groep 2 (de tweede kolom) vormen verbindingen die bestaan uit één atoom van het element en twee atomen van waterstof: deze worden alkalische aardmetalen genoemd, met vergelijkbare eigenschappen onder de leden van die groep. Andere groepen met specifieke namen zijn de pnictogenen (Groep 15), chalcogenen (groep 16), halogenen (groep 17) en edelgassen (groep 18, ook bekend als inerte gassen). De groepen kunnen ook worden aangeduid door het eerste element van de groep: bijvoorbeeld, de chalcogenen kunnen worden genoemd de zuurstofgroep of zuurstof familie. Waterstof is een uniek, niet-metallisch element met eigenschappen die vergelijkbaar zijn met de elementen van groep 1 en groep 17. Om die reden kan waterstof aan de bovenkant van beide groepen, of door zichzelf worden weergegeven.
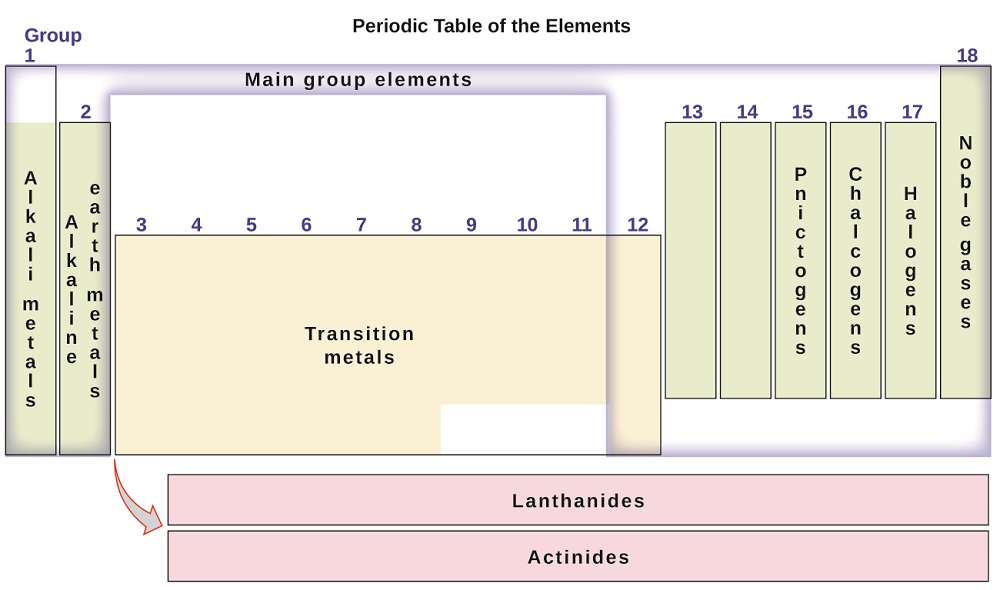
figuur \(\Paginindex{3}\): het periodiek systeem organiseert elementen met vergelijkbare eigenschappen in groepen.
voorbeeld \(\Paginindex{1}\): groepen van elementen benoemen
atomen van elk van de volgende elementen zijn essentieel voor het leven. Geef de groepsnaam voor de volgende elementen:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selenium
- barium
- lithium
Antwoord
edelgas
Antwoord b
chalcogen
Antwoord c
alkaline aarde metaal
Antwoord d
alkali metalen
In het bestuderen van de periodieke tabel, het is je misschien opgevallen iets over de atomaire massa ‘ s van enkele van de elementen. Element 43 (technetium), element 61 (promethium) en de meeste elementen met atoomnummer 84 (polonium) en hoger hebben hun atoommassa tussen vierkante haakjes. Dit wordt gedaan voor elementen die volledig bestaan uit instabiele, radioactieve isotopen (u leert meer over radioactiviteit in het hoofdstuk nucleaire chemie). Een gemiddeld atoomgewicht kan niet worden bepaald voor deze elementen omdat hun radio-isotopen aanzienlijk kunnen variëren in relatieve abundantie, afhankelijk van de bron, of zelfs niet bestaan in de natuur. Het getal tussen vierkante haakjes is het atoommassa getal (en de geschatte atoommassa) van de meest stabiele isotoop van dat element.
samenvatting
Video \(\Paginindex{3}\): een samenvatting van de ontdekking en eigenschappen van het periodiek systeem.
de ontdekking van de periodieke herhaling van soortgelijke eigenschappen tussen de elementen leidde tot de formulering van het periodiek systeem, waarin de elementen zijn gerangschikt in volgorde van toenemend atoomnummer in rijen bekend als perioden en kolommen bekend als groepen. Elementen in dezelfde groep van het periodiek systeem hebben vergelijkbare chemische eigenschappen. Elementen kunnen worden geclassificeerd als metalen, metalloïden, en niet-metalen, of als een hoofdgroep elementen, overgang metalen, en innerlijke overgang metalen. Groepen zijn van links naar rechts 1-18 genummerd. De elementen in groep 1 staan bekend als de alkalimetalen; die in groep 2 zijn de aardalkalimetalen; die in 15 zijn de pnictogenen; die in 16 zijn de chalcogenen; die in 17 zijn de halogenen; en die in 18 zijn de edelgassen.