leerdoelen
aan het einde van deze sectie kunt u:
- de relaties tussen microscopische en macroscopische hoeveelheden in een gas uitleggen
- problemen oplossen met gasmengsels
- problemen oplossen met betrekking tot de afstand en tijd tussen botsingen van een gasmolecuul
we hebben druk en temperatuur onderzocht op basis van hun macroscopische definities. Druk is de kracht gedeeld door het gebied waarop de kracht wordt uitgeoefend, en de temperatuur wordt gemeten met een thermometer. We kunnen een beter begrip krijgen van druk en temperatuur uit de kinetische theorie van gassen, de theorie die de macroscopische eigenschappen van gassen relateert aan de beweging van de moleculen waaruit ze bestaan. Ten eerste maken we twee veronderstellingen over moleculen in een ideaal gas.
- Er is een zeer groot aantal n moleculen, alle identiek en elk met massa m.
- de moleculen volgen de wetten van Newton en zijn in continue beweging, die willekeurig en isotroop is, dat wil zeggen hetzelfde in alle richtingen.
om de ideale gaswet af te leiden en het verband tussen microscopische hoeveelheden zoals de energie van een typisch molecuul en macroscopische hoeveelheden zoals temperatuur, analyseren we een monster van een ideaal gas in een stijve container, waarover we twee andere veronderstellingen maken:
- de moleculen zijn veel kleiner dan de gemiddelde afstand tussen hen, dus hun totale volume is veel kleiner dan dat van hun container (die volume V heeft). Met andere woorden, we nemen de Van der Waals constante b, het volume van een mol gasmoleculen, te verwaarlozen in vergelijking met het volume van een mol gas in de container.
- de moleculen maken perfect elastische botsingen met de wanden van de container en met elkaar. Andere krachten op hen, waaronder de zwaartekracht en de aantrekkingen vertegenwoordigd door de Van der Waals constante A, zijn verwaarloosbaar (zoals nodig is voor de aanname van isotropie).
de botsingen tussen moleculen komen niet voor in de afleiding van de ideale gaswet. Ze verstoren de afleiding ook niet, omdat botsingen tussen moleculen die bewegen met willekeurige snelheden nieuwe willekeurige snelheden geven. Bovendien, als de snelheden van gasmoleculen in een container aanvankelijk niet willekeurig en isotroop zijn, zijn moleculaire botsingen wat hen willekeurig en isotroop maakt.
we maken nog meer aannames die de berekeningen vereenvoudigen, maar het resultaat niet beïnvloeden. Eerst laten we de container een rechthoekige doos zijn. Ten tweede, we beginnen met het overwegen van monatomaire gassen, die waarvan de moleculen bestaan uit enkele atomen, zoals helium. Dan kunnen we aannemen dat de atomen geen energie hebben behalve hun translationele kinetische energie; bijvoorbeeld, ze hebben geen rotatie-of trillingsenergie. (Later bespreken we de validiteit van deze aanname voor echte monatomaire gassen en doen we er afstand van om diatomaire en polyatomaire gassen te overwegen.)
figuur \(\Pagindex{1}\) toont een botsing van een gasmolecuul met de wand van een container, zodat het een kracht uitoefent op de wand (volgens de derde wet van Newton). Deze botsingen zijn de bron van druk in een gas. Naarmate het aantal moleculen toeneemt, neemt het aantal botsingen, en dus de druk, toe. Ook als de gemiddelde snelheid van de moleculen hoger is, is de gasdruk hoger.
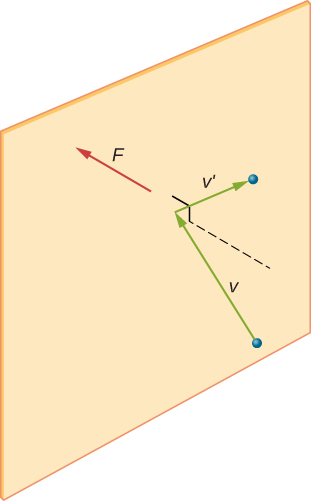
in een gasmonster in een container zorgt de willekeur van de moleculaire beweging ervoor dat het aantal botsingen van moleculen met een deel van de wand in een bepaalde tijd fluctueert. Maar omdat een groot aantal moleculen in korte tijd botst met de wand, schommelt het aantal botsingen op de schaal van tijd en ruimte die we meten slechts met een kleine, meestal niet waarneembare fractie van het gemiddelde. We kunnen deze situatie vergelijken met die van een casino, waar de uitkomsten van de weddenschappen willekeurig zijn en de casino ‘ s takings schommelen door de minuut en het uur. Echter, over lange tijden, zoals een jaar, de casino ‘ s takings zijn zeer dicht bij de gemiddelden verwacht van de kansen. Een tank gas heeft enorm meer moleculen dan een casino gokkers in een jaar, en de moleculen maken enorm meer botsingen in een seconde dan een casino weddenschappen heeft.
een berekening van de gemiddelde kracht uitgeoefend door moleculen op de wanden van de doos leidt ons naar de ideale gaswet en naar het verband tussen temperatuur en moleculaire kinetische energie. (In feite zullen we twee gemiddelden nemen: één na verloop van tijd om de gemiddelde kracht te krijgen die wordt uitgeoefend door een molecuul met een bepaalde snelheid, en dan een ander gemiddelde over moleculen met verschillende snelheden.) Deze benadering werd ontwikkeld door Daniel Bernoulli (1700-1782), die het meest bekend is in de natuurkunde voor zijn werk over fluid flow (hydrodynamica). Opmerkelijk genoeg deed Bernoulli dit werk voordat Dalton de opvatting van materie als bestaande uit atomen vaststelde.
figuur \(\Pagindex{2}\) toont een container vol gas en een uitgebreide weergave van een elastische botsing van een gasmolecuul met een wand van de container, opgesplitst in componenten. We hebben aangenomen dat een molecuul klein is in vergelijking met de scheiding van moleculen in het gas, en dat de interactie met andere moleculen kan worden genegeerd. Onder deze omstandigheden is de ideale gaswet experimenteel geldig. Omdat we ook hebben aangenomen dat de wand stijf is en de deeltjes punten zijn, is de botsing elastisch (door behoud van energie—er is nergens voor de kinetische energie van een deeltje om te gaan). Daarom blijft de kinetische energie van het molecuul constant, en daarom blijven de snelheid en de omvang van het momentum ook constant. Deze aanname is niet altijd geldig, maar de resultaten in de rest van deze module worden ook verkregen in modellen die de moleculen energie en momentum laten uitwisselen met de wand.
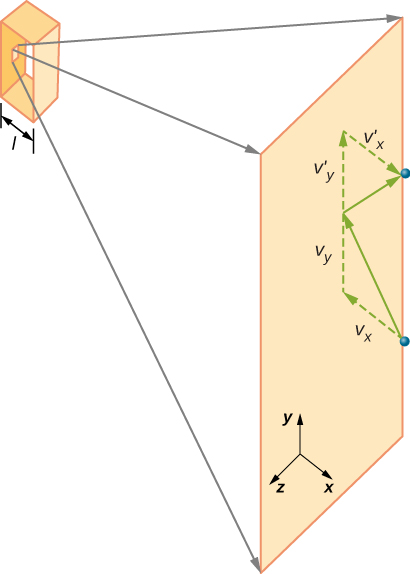
als de snelheid van het molecuul verandert in de x-richting, verandert het momentum van \(-m_x\) naar \(+mv_x\). De verandering in momentum is dus \(\Delta mv = +mv_x -(-mv_x) = 2mv_x\). Volgens de impuls-momentumstelling gegeven in het hoofdstuk over lineaire momentum en botsingen, wordt de kracht uitgeoefend op het IDE molecuul, waar i de moleculen van 1 tot N labelt, gegeven door \
(in deze vergelijking alleen staat p voor momentum, niet druk. Er is geen kracht tussen de wand en het molecuul behalve wanneer het molecuul de muur raakt. Gedurende de korte tijd van de botsing is de kracht tussen het molecuul en de wand relatief groot, maar dat is niet de kracht die we zoeken. We zijn op zoek naar de gemiddelde kracht, dus nemen we \(\Delta t\) aan als de gemiddelde tijd tussen botsingen van het gegeven molecuul met deze wand, dat is de tijd waarin we een botsing verwachten te vinden. Zij L vertegenwoordigen de lengte van de doos in de x-richting. Dan is \(\Delta t\) de tijd die het molecuul nodig heeft om over de doos en terug te gaan, een afstand 2l, met een snelheid van \(v_x\). Dus \(\delta t = 2l/v_x\), en de uitdrukking voor de kracht wordt
\
deze kracht is te wijten aan één molecuul. Om de totale kracht op de muur te vinden, F, moeten we de bijdragen van alle n moleculen toevoegen:
\
we gebruiken nu de definitie van het gemiddelde, die we aanduiden met een maat, om de kracht te vinden:
we willen de kracht in termen van snelheid v, in plaats van de x-component van de snelheid. Merk op dat de totale snelheid kwadraat de som is van de kwadraten van zijn componenten, zodat
\
met de aanname van isotropie, de drie gemiddelden aan de rechterkant gelijk zijn, dus
\
door dit te vervangen in de uitdrukking voor F geeft
\
de druk is F/A, dus verkrijgen we
\ waar we \(V = Al\) voor het volume gebruikten. Dit geeft het belangrijke resultaat
\
door deze vergelijking te combineren met \(pV = Nk_BT\) geeft
\
we kunnen de gemiddelde kinetische energie van een molecuul, \(\frac{1}{2}m\overline{v}^2\), van de linkerkant van de vergelijking krijgen door N te delen en te vermenigvuldigen met 3/2.
gemiddelde kinetische energie per molecuul
De gemiddelde kinetische energie van een molecuul is recht evenredig met zijn absolute temperatuur:
\
de vergelijking \(\overline{K} = \frac{3}{2} k_BT\) is de gemiddelde kinetische energie per molecuul. Merk in het bijzonder op dat niets in deze vergelijking afhangt van de molecuulmassa (of een andere eigenschap) van het gas, de druk, of iets anders dan de temperatuur. Als monsters van helium en xenongas, met zeer verschillende molecuulmassa ‘ s, bij dezelfde temperatuur zijn, hebben de moleculen dezelfde gemiddelde kinetische energie.
de interne energie van een thermodynamisch systeem is de som van de mechanische energieën van alle moleculen erin. We kunnen nu een vergelijking geven voor de interne energie van een monatomisch ideaal gas. In zo’ n gas is de enige energie van de moleculen hun translationele kinetische energie. Daarom hebben we \(E_{int} = N\ overline{K}\), of
\
vaak willen we deze vergelijking gebruiken in termen van mollen:
\
We kunnen\(\overline{K} = \frac{1} {2} m\overline{v}^2 = \frac{3} {2} k_BT\) voor een typische snelheid van een molecuul in een ideaal gas in termen van temperatuur om te bepalen wat bekend staat als de wortel-gemiddelde-kwadraat (RMS) snelheid van een molecuul.
RMS Snelheid van een Molecuul
De root-mean-square (rms) snelheid van een molecuul, of de vierkantswortel van het gemiddelde van het kwadraat van de snelheid \(\overline{v}^2\), is
\
De rms snelheid is niet het gemiddelde of de meest waarschijnlijke snelheid van de moleculen, zoals we zullen zien in de Verdeling van de Moleculaire Snelheden, maar het biedt een gemakkelijk berekende schatting van de moleculen’ snelheid die is gerelateerd aan hun kinetische energie. Opnieuw kunnen we deze vergelijking schrijven in termen van de gasconstante R en de molaire massa M In kg / mol:
\
we dwalen een moment af om een vraag te beantwoorden die bij u opkwam: wanneer we het model toepassen op atomen in plaats van theoretische puntdeeltjes, verandert rotatie kinetische energie dan onze resultaten? Om deze vraag te beantwoorden, moeten we een beroep doen op de kwantummechanica. In de kwantummechanica kan rotatie kinetische energie niet zomaar een waarde aannemen; het is beperkt tot een discrete verzameling van waarden, en de kleinste waarde is omgekeerd evenredig met de rotatietraagheid. De rotatietraagheid van een atoom is klein omdat bijna al zijn massa in de kern zit, die typisch een straal heeft kleiner dan \(10^{-14} m\). De minimale rotatie-energie van een atoom is dus veel meer dan \(\frac{1}{2}k_BT\) voor elke haalbare temperatuur, en de beschikbare energie is niet genoeg om een atoom te laten roteren. We zullen op dit punt terugkomen bij het bespreken van diatomaire en polyatomaire gassen in de volgende sectie.
voorbeeld \(\Paginindex{1}\): Kinetische energie en snelheid berekenen van een gasmolecuul
- Wat is de gemiddelde kinetische energie van een gasmolecuul Bij \(20.0^oC\) (kamertemperatuur)?
- vind de rms-snelheid van een stikstofmolecuul (\(N_2\)) bij deze temperatuur.
strategie
(a) de bekende in de vergelijking voor de gemiddelde kinetische energie is de temperatuur:
\
alvorens waarden in deze vergelijking te vervangen, moeten we de gegeven temperatuur omzetten in kelvin: \(T = (20.0 + 273) \, K = 293 \, K\). We kunnen de rms-snelheid van een stikstofmolecuul vinden met behulp van de vergelijking
\
maar we moeten eerst de massa van een stikstofmolecuul vinden. Het verkrijgen van de molaire massa van stikstof \(N_2\) uit het periodiek systeem, vinden we
\
oplossing
- De temperatuur alleen is voldoende voor ons om de gemiddelde translationele kinetische energie te vinden. Het vervangen van de temperatuur in de translationele kinetische energievergelijking geeft \
- het vervangen van deze massa en de waarde voor \(k_B\) in de vergelijking voor \(v_{RMS}\) levert \
significantie
merk op dat de gemiddelde kinetische energie van het molecuul onafhankelijk is van het type molecuul. De gemiddelde translationele kinetische energie hangt alleen af van de absolute temperatuur. De kinetische energie is erg klein in vergelijking met macroscopische energieën, zodat we niet voelen wanneer een luchtmolecuul onze huid raakt. Aan de andere kant, het is veel groter dan het typische verschil in gravitatiepotentiaal energie wanneer een molecuul beweegt van, Laten we zeggen, de top naar de bodem van een kamer, dus onze verwaarlozing van zwaartekracht is gerechtvaardigd in typische real-world situaties. De rms-snelheid van het stikstofmolecuul is verrassend groot. Deze grote moleculaire snelheden geven geen macroscopische beweging van lucht, omdat de moleculen bewegen in alle richtingen met gelijke waarschijnlijkheid. Het gemiddelde vrije pad (de afstand die een molecuul gemiddeld beweegt tussen botsingen, iets later besproken in dit gedeelte) van moleculen in de lucht is erg klein, dus de moleculen bewegen snel maar komen niet ver in een seconde. De hoge waarde voor rms-snelheid wordt weerspiegeld in de geluidssnelheid, die ongeveer 340 m/s bij kamertemperatuur is. Hoe hoger de rms-snelheid van luchtmoleculen, hoe sneller geluidstrillingen door de lucht kunnen worden overgebracht. De geluidssnelheid neemt toe met de temperatuur en is groter in gassen met kleine molecuulmassa ‘ s, zoals helium (zie figuur \(\Paginindex{3}\)).
voorbeeld \(\Paginindex{2}\): berekening van temperatuur: ontsnappingssnelheid van heliumatomen
om aan de zwaartekracht van de aarde te ontsnappen, moet een object aan de bovenkant van de atmosfeer (op een hoogte van 100 km) met 11,1 km/s van de aarde afreizen. deze snelheid wordt de ontsnappingssnelheid genoemd. Bij welke temperatuur zouden heliumatomen een rms-snelheid hebben die gelijk is aan de ontsnappingssnelheid?
strategie
Identificeer de knowns en unknowns en bepaal welke vergelijkingen te gebruiken om het probleem op te lossen.
oplossing
- Identificeer de knowns: v is de ontsnappingssnelheid, 11,1 km/s.
- Identificeer de unknowns: we moeten oplossen voor temperatuur, T. We moeten ook oplossen voor de massa m van het heliumatoom.
- Bepaal welke vergelijkingen nodig zijn.
- om de massa m van het heliumatoom te verkrijgen, kunnen we informatie uit het periodiek systeem gebruiken: \
- om op te lossen voor temperatuur T, kunnen we \ herschikken om \
- De bekende waarden in de vergelijkingen te vervangen en op te lossen voor de onbekenden, \ en \
significantie
Deze temperatuur is veel hoger dan de atmosferische temperatuur, die ongeveer 250 K (\(-25^oC\) of \(-10^van\)) op hoge hoogte is. Er zijn weinig heliumatomen in de atmosfeer, maar velen waren aanwezig toen de atmosfeer werd gevormd, en er worden er steeds meer gecreëerd door radioactief verval (zie het hoofdstuk over kernfysica). De reden voor het verlies van heliumatomen is dat een klein aantal heliumatomen snelheden hebben die hoger zijn dan de ontsnappingssnelheid van de aarde, zelfs bij normale temperaturen. De snelheid van een heliumatoom verandert van de ene botsing naar de andere, zodat er op elk moment een kleine maar niet-NUL kans is dat de snelheid van het atoom groter is dan de ontsnappingssnelheid. De kans is groot genoeg dat tijdens de levensduur van de aarde, bijna alle heliumatomen die in de atmosfeer zijn geweest, ontsnappingssnelheid hebben bereikt op grote hoogte en ontsnapt uit de zwaartekracht van de aarde. Zwaardere moleculen, zoals zuurstof, stikstof en water, hebben kleinere rms-snelheden, en dus is het veel minder waarschijnlijk dat een van hen hogere snelheden zal hebben dan de ontsnappingssnelheid. In feite is de kans zo klein dat miljarden jaren nodig zijn om aanzienlijke hoeveelheden zwaardere moleculen uit de atmosfeer te verliezen. Figuur \(\Pagindex{4}\) toont het effect van een gebrek aan atmosfeer op de maan. Omdat de zwaartekracht van de maan veel zwakker is, heeft hij bijna zijn hele atmosfeer verloren. De atmosferen van de aarde en andere lichamen worden vergeleken in de oefeningen van dit hoofdstuk.

oefening \(\Paginindex{2}\)
als je een zeer klein object, zoals een stuifmeelkorrel, in een gas beschouwt, dan is het aantal moleculen dat het oppervlak raakt ook relatief klein. Verwacht je dat de stuifmeelkorrel drukschommelingen ervaart als gevolg van statistische schommelingen in het aantal gasmoleculen dat het in een bepaalde tijd raakt?
antwoord
Ja. Dergelijke fluctuaties komen eigenlijk voor bij een lichaam van elke grootte in een gas, maar omdat het aantal moleculen immens is voor macroscopische lichamen, zijn de fluctuaties een klein percentage van het aantal botsingen, en de gemiddelden waarover in dit gedeelte wordt gesproken variëren onmerkbaar. Grofweg zijn de fluctuaties omgekeerd evenredig met de vierkantswortel van het aantal botsingen, dus voor kleine lichamen kunnen ze significant worden. Dit werd eigenlijk waargenomen in de negentiende eeuw voor stuifmeelkorrels in water en staat bekend als Brownse beweging.
Dampdruk, partiële druk en Dalton ‘ s Law
De druk die een gas zou veroorzaken als het het totale beschikbare volume bezet wordt de partiële druk van het gas genoemd. Als twee of meer gassen worden gemengd, komen ze tot thermisch evenwicht als gevolg van botsingen tussen moleculen; het proces is analoog aan warmtegeleiding zoals beschreven in het hoofdstuk over temperatuur en warmte. Zoals we hebben gezien uit de kinetische theorie, wanneer de gassen dezelfde temperatuur hebben, hebben hun moleculen dezelfde gemiddelde kinetische energie. Zo gehoorzaamt elk gas afzonderlijk aan de ideale gaswet en oefent dezelfde druk uit op de wanden van een container die het zou doen als het alleen zou zijn. Daarom is de totale druk in een mengsel van gassen de som van partiële drukken van de componentgassen, uitgaande van een ideaal gasgedrag en geen chemische reacties tussen de componenten. Deze wet staat bekend als Dalton ‘ s law of partial pressures, naar de Engelse wetenschapper John Dalton (1766-1844) die de wet voorstelde. Dalton ‘ s wet komt overeen met het feit dat de druk toeneemt volgens het principe van Pascal.
in een mengsel van ideale gassen in thermisch evenwicht is het aantal moleculen van elk gas evenredig met zijn partiële druk. Dit resultaat volgt uit het toepassen van de ideale gaswet op elk in de vorm \(p / n = RT / V\). Omdat de rechterkant hetzelfde is voor elk gas bij een bepaalde temperatuur in een container van een bepaald volume, is de linkerkant hetzelfde.
- partiële druk is de druk die een gas zou veroorzaken als het alleen zou bestaan.volgens de wet van Dalton is de totale druk de som van de partiële druk van alle aanwezige gassen.
- voor twee gassen (gelabeld met 1 en 2) in evenwicht in een container, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
een belangrijke toepassing van partiële druk is dat het in de chemie fungeert als de concentratie van een gas bij het bepalen van de snelheid van een reactie. Hier vermelden we alleen dat de gedeeltelijke druk van zuurstof in de longen van een persoon cruciaal is voor het leven en de gezondheid. De ademhaling van lucht die een gedeeltelijke druk van zuurstof onder 0,16 atm heeft kan coördinatie en oordeel aantasten, met name bij mensen die niet aan een hoge hoogte zijn geacclimatiseerd. Lagere partiële druk van \(O_2\) heeft ernstiger gevolgen; partiële druk onder 0,06 atm kan snel fataal zijn, en blijvende schade is waarschijnlijk zelfs als de persoon wordt gered. Echter, het gevoel van de noodzaak om te ademen, zoals bij het inhouden van de adem, wordt veel meer veroorzaakt door hoge concentraties van kooldioxide in het bloed dan door lage concentraties zuurstof. Dus, als een kleine kamer of kast is gevuld met lucht met een lage concentratie zuurstof, misschien omdat een lekkende cilinder van een gecomprimeerd gas daar wordt opgeslagen, zal een persoon geen “verstikking” gevoel voelen en kan gaan in stuiptrekkingen of het bewustzijn verliezen zonder iets verkeerd op te merken. Veiligheidsmonteurs besteden veel aandacht aan dit gevaar.
een andere belangrijke toepassing van partiële druk is de dampdruk, die de partiële druk is van een damp waarbij deze in evenwicht is met de vloeibare (of vaste, in het geval van sublimatie) fase van dezelfde stof. Bij elke temperatuur kan de gedeeltelijke druk van het water in de lucht de dampdruk van het water bij die temperatuur niet overschrijden, want wanneer de gedeeltelijke druk de dampdruk bereikt, condenseert het water uit de lucht. Dauw is een voorbeeld van deze condensatie. De temperatuur waarbij condensatie optreedt voor een luchtmonster wordt het dauwpunt genoemd. Het wordt gemakkelijk gemeten door een metalen bal langzaam af te koelen; het dauwpunt is de temperatuur waarbij condensatie voor het eerst op de bal verschijnt.
de dampdruk van water bij sommige temperaturen die van belang zijn voor de meteorologie wordt gegeven in Tabel\(\Paginindex{1}\).
| T(\(^oC\)) | dampspanning (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) bij een temperatuur wordt T gedefinieerd door
\
een relatieve vochtigheid van \(100\%\) betekent dat de partiële druk van water gelijk is aan de dampdruk; met andere woorden, de lucht is verzadigd met water.
voorbeeld \(\Paginindex{3}\): relatieve vochtigheid berekenen
Wat is de relatieve vochtigheid wanneer de luchttemperatuur \(25^oC\) is en het dauwpunt \(15^oC\)?
strategie
We zoeken gewoon de dampdruk op bij de gegeven temperatuur en die op het dauwpunt en vinden de verhouding.
oplossing
\
significantie
R. H. is belangrijk voor ons comfort. De waarde van \(53,8\%\) ligt binnen het bereik van \(40\%\) tot \(60\%\) aanbevolen voor comfort binnenshuis.
zoals vermeld in het hoofdstuk over temperatuur en warmte, daalt de temperatuur zelden onder het dauwpunt, omdat wanneer het het dauwpunt of het vorstpunt bereikt, water condenseert en een relatief grote hoeveelheid latente verdampingswarmte afgeeft.
gemiddeld vrij pad en gemiddelde Vrije Tijd
We beschouwen botsingen nu expliciet. De gebruikelijke eerste stap (en dat is alles wat we zullen nemen) is het berekenen van het gemiddelde vrije pad, \(\lambda\), de gemiddelde afstand die een molecuul aflegt tussen botsingen met andere moleculen, en de gemiddelde vrije tijd \(\tau\), de gemiddelde tijd tussen de botsingen van een molecuul. Als we aannemen dat alle moleculen bollen zijn met een straal \(r\) dan zal een molecuul met een ander botsen als hun centra zich binnen een afstand 2r van elkaar bevinden. Voor een gegeven deeltje zeggen we dat de oppervlakte van een cirkel met die straal, \(4\pi r^2\), de “doorsnede” is voor botsingen. Als het deeltje beweegt, volgt het een cilinder met dat dwarsdoorsnede gebied. Het gemiddelde vrije pad is de lengte \(\lambda\) zodanig dat het verwachte aantal andere moleculen in een cilinder van lengte \(\lambda\) en doorsnede \(4\pi r^2\) 1 is. Als we tijdelijk de beweging van de andere moleculen negeren dan degene waar we naar kijken, is het verwachte getal de getaldichtheid van moleculen, n/V, maal het volume, en het volume is \(4\pi r^2 \lambda\), dus we hebben \((N/V)4\pi r^2 \lambda = 1\), of
\
rekening houdend met de beweging van alle moleculen maakt de berekening veel moeilijker, maar de enige verandering is een factor \(\sqrt{2}\). Het resultaat is
\
In een ideaal gas kunnen we \(V/N = k_BT/p\) vervangen om
\
De gemiddelde vrije tijd \(\tau\) is gewoon het gemiddelde vrije pad gedeeld door een typische snelheid, en de gebruikelijke keuze is de rms-snelheid. Dan
\
berekenen van de gemiddelde Vrije Tijd
vind de gemiddelde vrije tijd voor argonatomen (\(m = 39.9 \, g / mol\)) bij een temperatuur van \(0^oC\) en een druk van 1,00 atm. Neem de straal van een argonatoom op \(1.70 \maal 10^{-10} \ ruimte m\).
oplossing
- Identificeer de knowns en converteer naar SI-eenheden. We weten dat de molaire massa 0 is.0399 kg / mol, de temperatuur is 273 K, de druk is \(1.01 \keer 10^5\, Pa\), en de straal is \(1.70 \keer 10^{-10}\, m\).
- vind de rms-snelheid: \(v_{RMS} = \sqrt{\frac{3RT}{M}} = 413 \, m / s\).
- substituut in de vergelijking voor de gemiddelde vrije tijd: \
significantie
We kunnen dit resultaat nauwelijks vergelijken met onze intuïtie over gasmoleculen, maar het geeft ons een beeld van moleculen die botsen met extreem hoge frequentie.
oefening \(\Pagindex{4}\)
welke heeft een langere gemiddelde vrije weg, vloeibaar water of waterdamp in de lucht?
antwoord
in een vloeistof liggen de moleculen heel dicht bij elkaar en botsen ze constant met elkaar. Om een gas bijna ideaal te laten zijn, omdat lucht onder normale omstandigheden is, moeten de moleculen zeer ver uit elkaar liggen. Daarom is het gemiddelde vrije pad veel langer in de lucht.
bijdragers en toeschrijvingen
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), en Bill Moebs met veel bijdragende auteurs. Dit werk is gelicenseerd door OpenStax University Physics onder een Creative Commons Attribution License (door 4.0).