moleculaire orbitalen van een Allylcarbocatie
de stabiliteit van de carbonatie van propeen wordt veroorzaakt door een geconjugeerd π-elektronensysteem. Een “dubbele band” bestaat niet echt. In plaats daarvan is het een groep van 3 aangrenzende, overlappende, niet-gehybridiseerde p-orbitalen die we een geconjugeerd π-elektronensysteem noemen. Je kunt duidelijk de interacties zien tussen alle drie de p orbitalen van de drie koolstofatomen wat resulteert in een echt stabiel kation. Het komt allemaal neer op waar de locatie van de elektronendeficiënte koolstof is.
moleculaire orbitale beschrijvingen kunnen allylstabiliteit op een andere manier verklaren met 2-propenyl. Fig.6
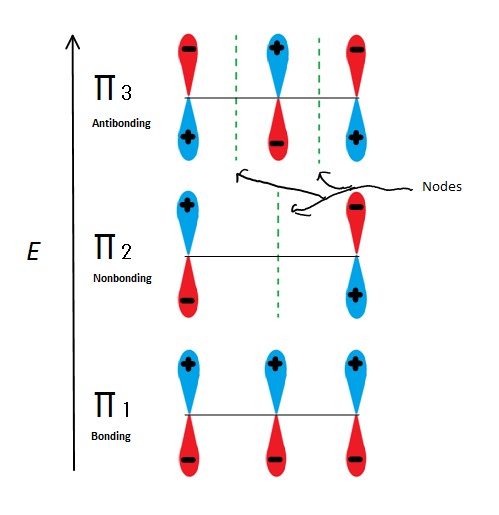
Fig.6 toont de 3 mogelijke moleculaire orbitalen van 2-propenyl
als we gewoon de π moleculaire orbitaal nemen en niet een van de s, krijgen we er drie. π1 bindt zich met geen knopen, π2 is niet-gebonden (met andere woorden, dezelfde energie als een reguliere p-orbitaal) met een knoop, en π3 is antibonderend met 2 knopen (geen van de orbitalen interacteren). De eerste twee elektronen zullen in de π1 moleculaire orbitaal gaan, ongeacht of het een kation, radicaal of anion is. Als het een radicaal of anion is, gaat het volgende elektron in de π2 moleculaire orbitaal. Het Laatste anion elektron gaat ook in de niet-gebonden orbitaal. Dus het maakt niet uit wat voor soort koolstofcentrum er bestaat, geen elektron zal ooit in de antibondende orbitaal gaan.
De bindings-orbitalen zijn de orbitalen met de laagste energie en zijn gunstig, daarom worden ze eerst gevuld. Hoewel de niet-gebonden orbitalen kunnen worden gevuld, is de totale energie van het systeem nog steeds lager en stabieler door de gevulde binding moleculaire orbitalen.
deze figuur laat ook zien dat π2 de enige moleculaire orbitaal is waar het elektron verschilt, en het is ook waar een enkele knoop door het midden gaat. Hierdoor liggen de ladingen van het molecuul voornamelijk op de twee eindkoolstoffen en niet op de middelste koolstof.
deze moleculaire orbitale beschrijving kan ook de stabiliteit van allylische koolstofcentra illustreren in Figuur 7.
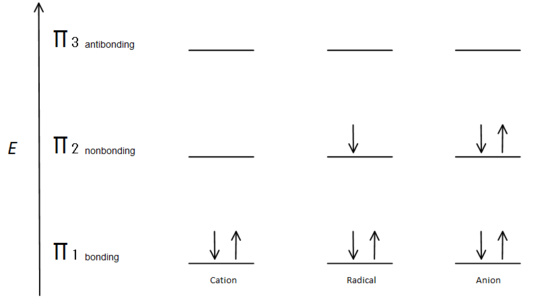
Fig.7 diagram dat laat zien hoe de elektronen vullen op basis van het Aufbau Principe.
De π binding orbitaal is lager in energie dan de niet-gebonden p orbitaal. Aangezien elk getoonde koolstofcentrum twee elektronen heeft in de lagere energie, binding π orbitalen, wordt de energie van elk systeem over het geheel genomen verlaagd (en dus stabieler), ongeacht kation, radicaal of anion.