Finn kilder: «Single bond» – nyheter · aviser · bøker · scholar · JSTOR (August 2012) (Lær hvordan og når man skal fjerne denne malen melding)
i kjemi, er en enkeltbinding en kjemisk binding mellom to atomer som involverer to valenselektroner. Det vil si at atomene deler ett par elektroner hvor bindingen dannes. Derfor er en enkeltbinding en type kovalent binding. Når de deles, er hver av de to elektronene som er involvert, ikke lenger i den eneste besittelsen av orbitalet der den oppsto. Snarere bruker begge de to elektronene tid i en av orbitalene som overlapper i bindingsprosessen. Som En Lewis-struktur er en enkeltbinding betegnet SOM ENː eller A-A, for Hvilken A representerer et element (Moore, Stanitski og Jurs 329). I den første gjengivelsen representerer hver prikk et delt elektron, og i den andre gjengivelsen representerer stangen begge elektronene som deles i enkeltbindingen.

en kovalent binding kan også være en dobbeltbinding eller en trippelbinding. En enkeltbinding er svakere enn enten en dobbeltbinding eller en trippelbinding. Denne forskjellen i styrke kan forklares ved å undersøke komponentbindingene som hver av disse typer kovalente bindinger består av(Moore, Stanitski og Jurs 393).
vanligvis er en enkeltbinding en sigma-binding. Et unntak er bindingen i diboron, som er en pi-binding. I motsetning består dobbeltbindingen av en sigma-binding og en pi-binding, og en trippelbinding består av en sigma-binding og to pi-obligasjoner (Moore, Stanitski og Jurs 396). Antall komponentobligasjoner er det som bestemmer styrkeforskjellen. Det står til grunn at enkeltbindingen er den svakeste av de tre fordi den består av bare en sigma-binding, og dobbeltbindingen eller trippelbindingen består ikke bare av denne typen komponentbinding, men også minst en ekstra binding.
enkeltbindingen har kapasitet til rotasjon, en egenskap som ikke er besatt av dobbeltbindingen eller trippelbindingen. Strukturen av pi-bindinger tillater ikke rotasjon (i hvert fall ikke ved 298 K), så dobbeltbindingen og trippelbindingen som inneholder pi-bindinger holdes på grunn av denne egenskapen. Sigma-bindingen er ikke så restriktiv, og enkeltbindingen kan rotere ved hjelp av sigma-bindingen som rotasjonsaksen (Moore, Stanitski og Jurs 396-397).
En annen egenskap sammenligning kan gjøres i bond lengde. Enkeltbindinger er den lengste av de tre typer kovalente bindinger som interatomic tiltrekning er større i de to andre typer, dobbel og trippel. Økningen i komponentbindinger er årsaken til denne tiltrengningsøkningen ettersom flere elektroner deles mellom de bundne atomer(Moore, Stanitski og Jurs 343).
Enkeltbindinger ses ofte i diatomiske molekyler. Eksempler på denne bruken av enkeltbindinger inkluderer H2, F2 og HCl.Enkeltbindinger ses også i molekyler som består av mer enn to atomer. Eksempler på denne bruken av enkeltbindinger inkluderer:
- begge bindingene I H2O
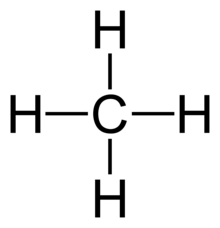
- Alle 4 bindinger I CH4
Enkeltbinding vises selv i molekyler så komplekse som hydrokarboner større enn metan. Typen av kovalent binding i hydrokarboner er ekstremt viktig i nomenklaturen til disse molekylene. Hydrokarboner som bare inneholder enkeltbindinger refereres til som alkaner(Moore, Stanitski og Jurs 334). Navnene på spesifikke molekyler som tilhører denne gruppen slutter med suffikset-ane. Eksempler er etan, 2-metylbutan og cyklopentan (Moore, Stanitski og Jurs 335).