Lewis diagram av mange et molekyl, men er ikke i samsvar med de observerte egenskapene til molekylet.
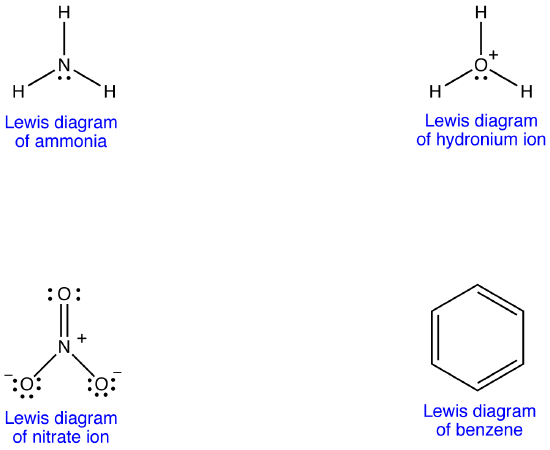
Eksempel 1: Nitrat Ion, Ifølge Lewis-diagrammet, har to typer nitrogen-oksygenbindinger, en dobbeltbinding og to enkeltbindinger, noe som tyder på at en nitrogen-oksygenbinding i nitrationen er kortere og sterkere enn hver av de to andre. Lewis-strukturen innebærer også, med hensyn til formell ladning, at det er to typer oksygenatomer i nitrationet, en formelt nøytral og hver av de andre to bærer en formell ladning på -1. Eksperimentelt har imidlertid de tre nitrogen-oksygenbindingene i nitrationen samme bindingslengde og samme bindingsenergi, og de tre oksygenatomer er uutslettelige. Lewis diagrammet ikke klarer å forklare strukturen og binding av nitrat ion tilfredsstillende.
To Ekstra Lewis diagrammer kan tegnes for nitrat ion.
ingen av Dem er imidlertid i samsvar med de observerte egenskapene til nitrationen og viser derfor ikke nitrationen riktig.
Eksempel 2: Benzen har ifølge Lewis-diagrammet to typer karbon-karbonbindinger, tre dobbeltbindinger og tre enkeltbindinger, noe som tyder på at hver av tre karbon-karbonbindinger i benzen er kortere og sterkere enn hver av de andre tre. Eksperimentelt har imidlertid de seks karbon-karbonbindingene i benzen samme bindingslengde og samme bindingsenergi. Lewis-diagrammet unnlater å forklare strukturen og bindingen av benzen tilfredsstillende.et attributt av molekyler som det klassiske Lewis-diagrammet ikke er i samsvar med de observerte egenskapene, er at andre gyldige Lewis-diagrammer kan genereres for dem. Et Ekstra Lewis-diagram kan tegnes for benzen.

ingen av Dem er imidlertid i samsvar med de observerte egenskapene til benzen og viser derfor ikke benzen riktig.Resonans teori Er et forsøk på å forklare strukturen av en art, som nitrat ion eller benzen, Ingen Lewis diagram som er i samsvar med de observerte egenskapene til arten. Den store fordelen med resonans teori er at selv om basert på streng matematisk analyse, resonans teori kan brukes med hell påkalle lite eller ingen matematikk. Resonans teori er forklart nedenfor ved hjelp av nitrat ion som eksempel.
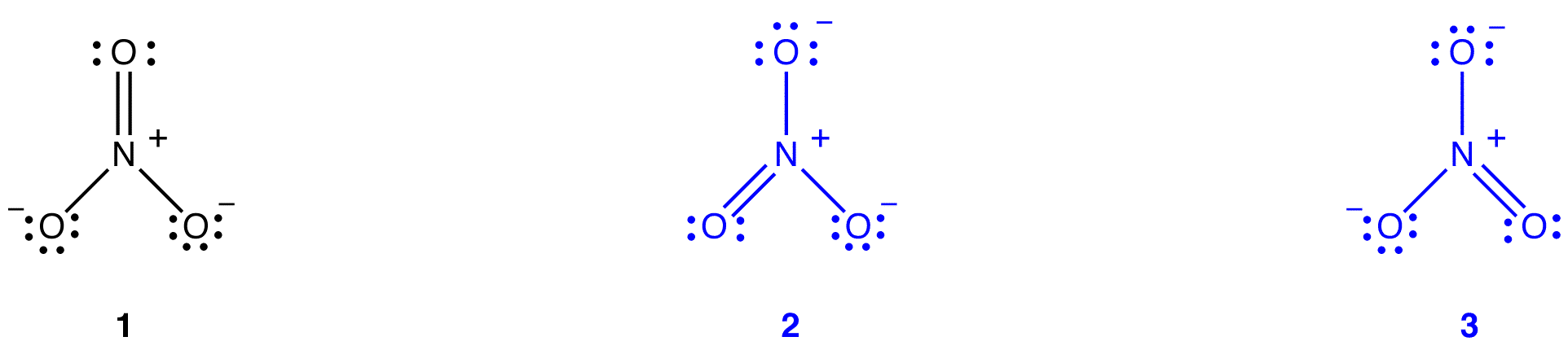
ifølge resonansteori er strukturen av nitrationet ikke 1 eller 2 eller 3, men gjennomsnittet av alle tre av dem, vektet av stabilitet. Lewis diagrammer 1, 2 og 3 kalles resonansformer, resonans strukturer eller resonans bidragsytere av nitrat ion. Strukturen av nitrationet sies å være en resonanshybrid eller ganske enkelt hybrid av resonansformer 1, 2 og 3. Når det er nødvendig å vise strukturen til nitrationen, trekkes resonansformene 1, 2 og 3, forbundet med en dobbelthodet pil.
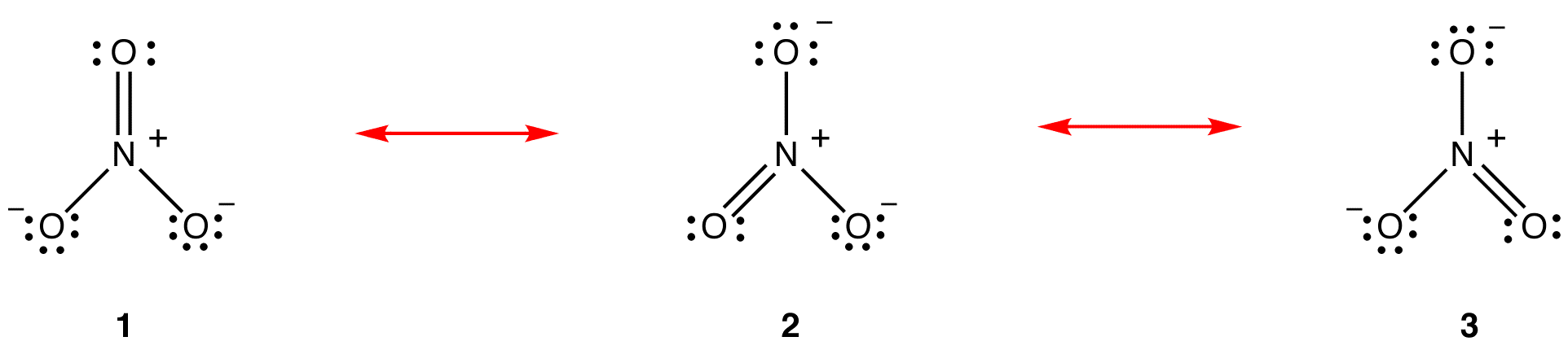
de tre resonansformene av nitrationen, 1, 2 og 3, er identiske, så de har samme stabilitet og bidrar derfor likt til hybriden. Siden den nøyaktige i hvilken grad hver resonansform av nitrationet bidrar til hybriden er kjent, kan bindingsordren for hver nitrogen-oksygenbinding samt den formelle ladningen på hvert oksygenatom i hybriden lett bestemmes:
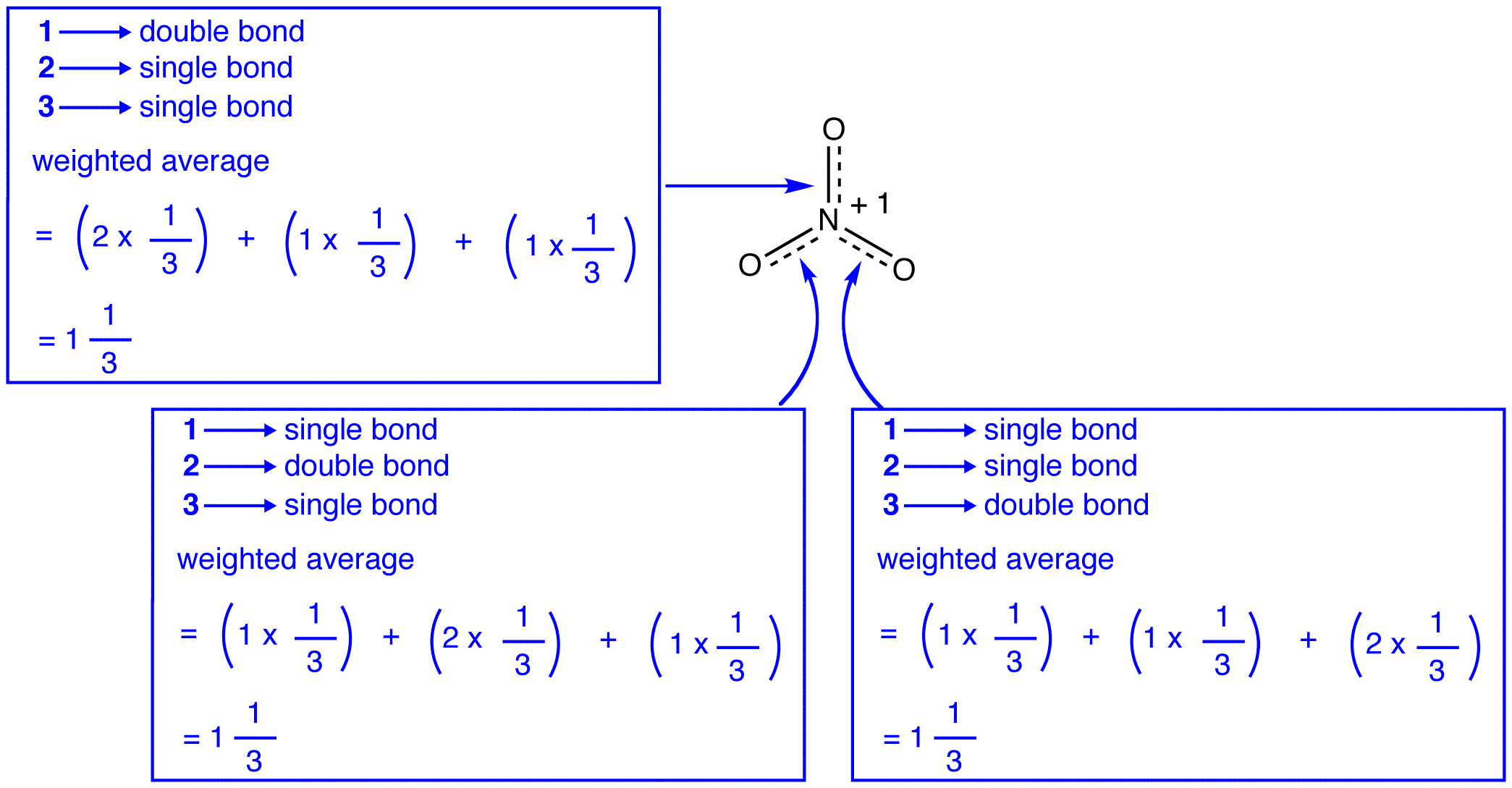
I henhold til resonansteori er hver binding i nitrationet en og en tredjedel av en binding, noe som er i samsvar med observasjonen at de tre bindingene i nitrationet har samme bindingslengde og samme bindingsenergi.
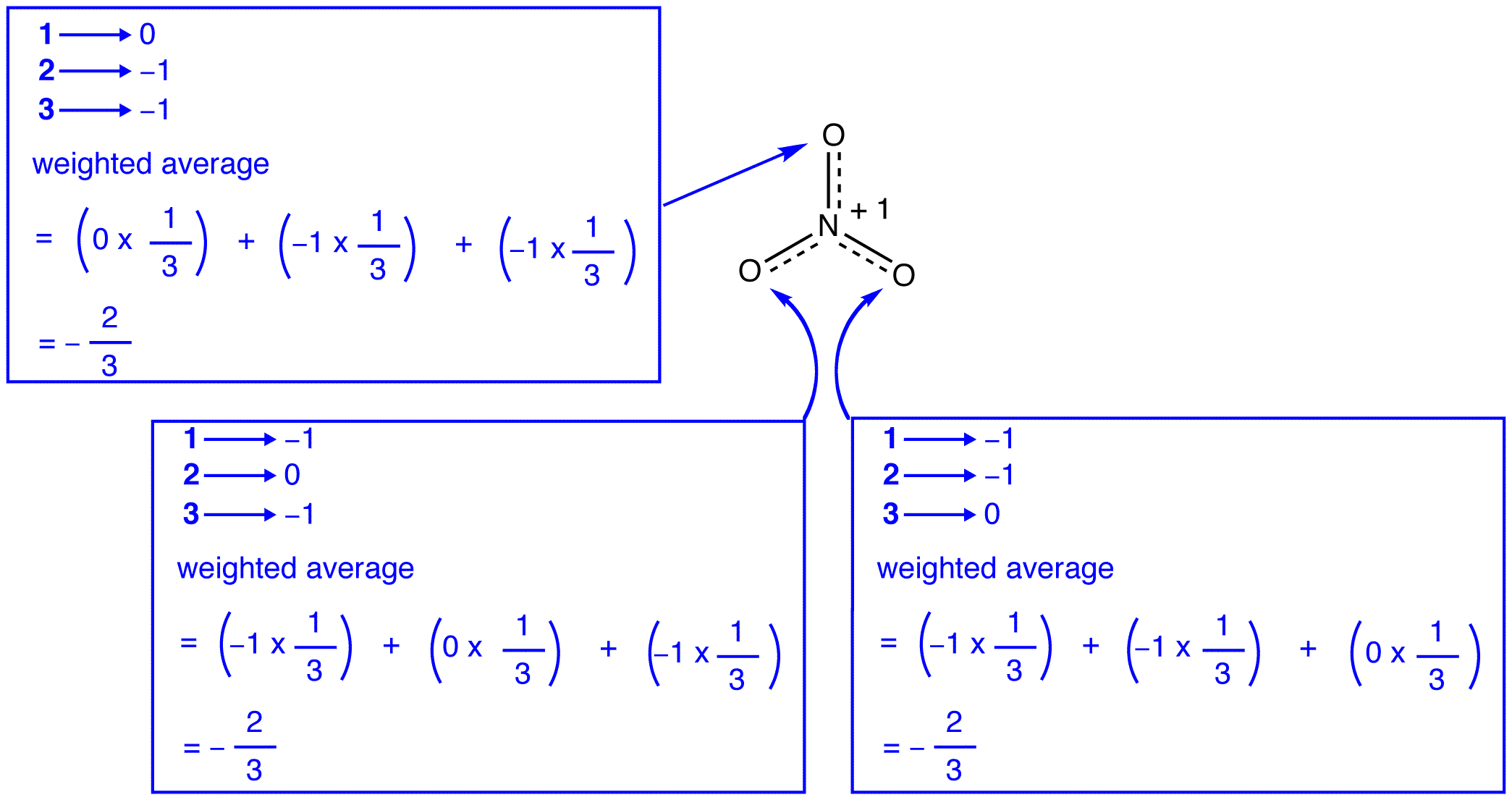
ifølge resonansteori har hvert oksygenatom i nitrationen en formell ladning på -2 / 3, som sammen med det faktum at de tre nitrogen-oksygenbindingene er identiske, er i samsvar med observasjonen at de tre oksygenatomer i nitrationen ikke skiller seg ut.
i hver resonansform av nitrationet er det to pi-elektroner, og de deles bare av to atomer. Et elektron som bare deles av to atomer sies å være lokalisert. Dermed er de to pi-elektronene i hver resonansform av nitrationet lokalisert. Nitrat ion, som representert ved hybrid, har to pi elektroner:
# elektroner i en pi bond = 2
# elektroner i tre av dem = 3 x (2/3)=2
de to pi-elektronene i nitrationet deles av totalt fire atomer, ett nitrogenatom og tre oksygenatomer. Et elektron som deles av mer enn to atomer sies å være delokalisert. Dermed blir de to pi-elektronene i nitrationen delokalisert. Delokalisering av pi elektroner i nitrat ion krever at de fire atomene være på samme plan, slik at lateral overlapping av p orbitaler på dem.

Hvis energien til nitrationen var det veide gjennomsnittet av energiene i sine tre resonansformer, akkurat som strukturen av nitrationen er det veide gjennomsnittet av strukturer av sine tre resonansformer, bør den være lik energien til en av de tre identiske resonansformene.:

hvis energien av hybrid var lik som en resonans form, gitt at alle kjemiske enheter (elementære partikler, atomer, molekyler, etc.) naturlig tendens til å være i lavest mulig energitilstand, ville det ikke være noen fordel for nitrat ion å eksistere som hybrid; det kan bare eksistere som en resonansform. Siden nitrationet eksisterer som hybrid, ikke som en resonansform, kan det utledes at hybridens energi er lavere enn for noen av resonansformene.

ifølge resonansteori er energien til et molekyl lavere enn den laveste energiresonansformen. Siden nitrationen har lavere energi og derfor er mer stabil enn noen av dens resonansformer, sies nitrationen å være resonansstabilisert.Det er to misoppfatninger om resonans teori blant begynnelsen studenter, sannsynligvis på grunn av bokstavelig tolkning av ordet resonans. De er beskrevet nedenfor, ved hjelp av nitrat ion som eksempel.
Misforståelse 1: Nitrationet eksisterer som resonansform 1 for et øyeblikk og endres deretter enten til resonansform 2 eller til resonansform 3, som interkonverterer, eller går tilbake til 1.

strukturen av nitrationet er ikke 1 eller 2 eller 3, men hybrid og endres ikke med tiden med mindre det gjennomgår en reaksjon.Misforståelse 2: I en prøve av nitrationer, på et gitt tidspunkt, eksisterer en tredjedel av ionene som resonansform 1, en annen en tredjedel som resonansform 2, og den gjenværende en tredjedel som resonansform 3.

i en prøve av nitrationer, på et gitt tidspunkt, har alle ioner samme struktur, som er hybrid.den klassiske analogien som brukes til å klargjøre disse to misforståelsene er muldyret (Morrison, Rt; Boyd, RN Organisk Kjemi, femte utgave; Allyn og Bacon: Boston, 1987, pg. 373). Biologisk er et muldyr en hybrid av en hest og et esel. Dette betyr ikke at et muldyr ligner en hest for et øyeblikk og deretter endres for å ligne et esel. Utseendet til et muldyr er en kombinasjon av det av en hest og et esel og endres ikke med tiden. Det betyr heller ikke at i en flokk ligner noen muldyr en hest og de andre et esel. I en flokk har alle muldyr samme utseende, som er en kombinasjon av en hest og et esel. Svakheten i denne analogien er at hester og esler eksisterer, mens resonansformer er strengt hypotetiske. En bedre analogi, sitert I Morrison Og Boyd, er neshornet. Ved å se et neshorn, kan man beskrive det som hybrid av en drage og en enhjørning, to skapninger som ikke eksisterer.
Regler For Tegning Av Resonansformer
1. Resonansformer er Lewis-diagrammer, som er basert på valensbindingsteori.De må derfor følge de grunnleggende reglene i valensbindingsteorien. Dermed kan hydrogen ikke ha mer enn to valenselektroner; Periode-to elementer kan ikke ha mer enn åtte valenselektroner; elementer i Periode tre og under kan ha mer enn åtte valenselektroner. for eksempel: i hver resonansform av nitrationet er det to elementer, nitrogen og oksygen, som Er Periode-to elementer. I ingen av resonansformene av nitrationet er det mer enn åtte valenselektroner på noen av atomene.
2. Alle resonansformer må ha samme sigma-bindingsramme, forskjellig bare i plasseringen av pi-elektroner og ikke-bundet valenselektroner. f. Eks: Alle tre resonansformer av nitrationet har samme sigma-bindingsramme:
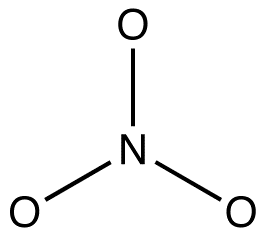
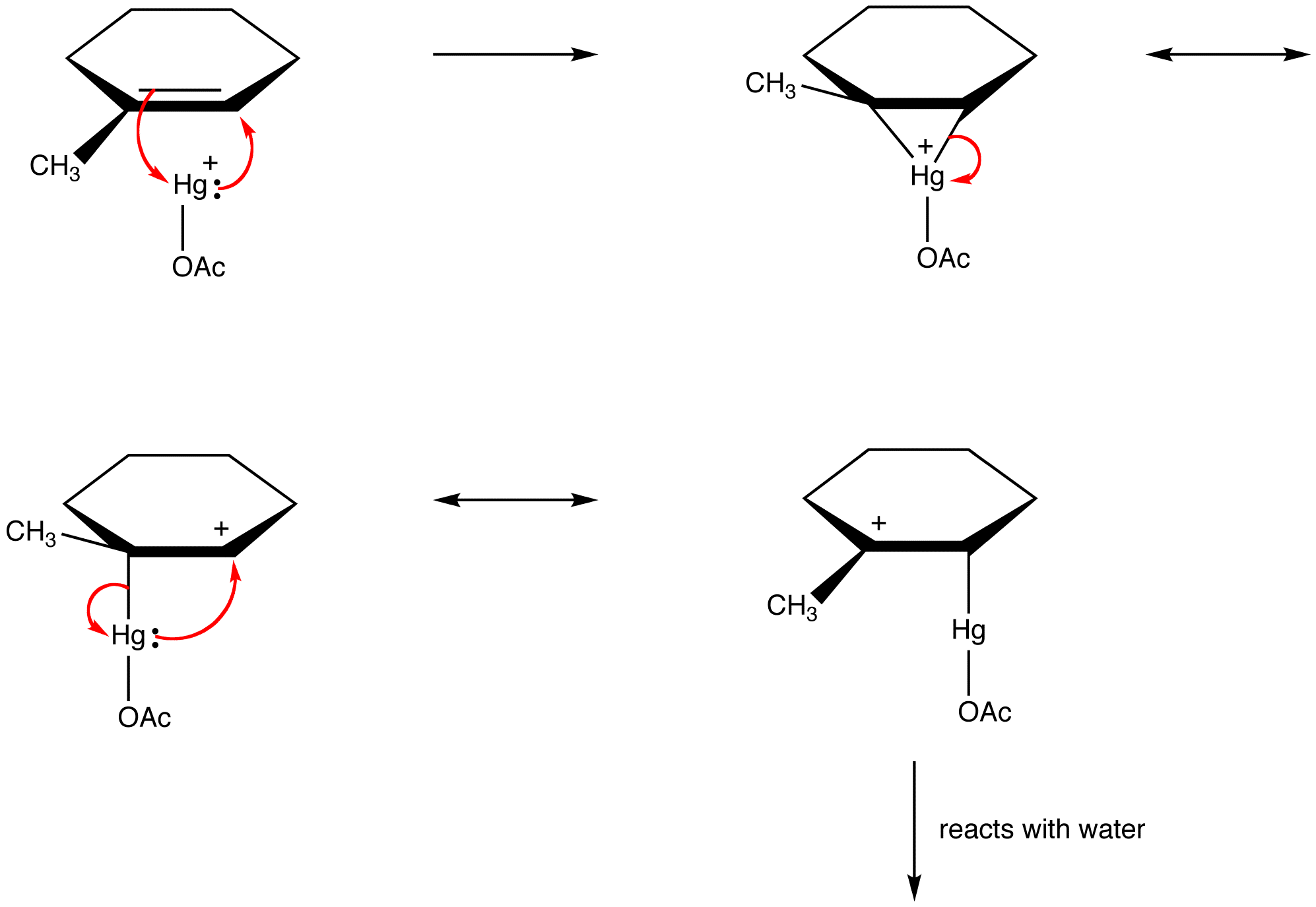
de adskiller seg fra hverandre bare på steder av pi-elektroner og ensomme par.Organiske kjemikere bryter i økende grad denne regelen for å forklare strukturer av reaktive mellomprodukter som resonansstabiliserte arter. eg: oxymercuration
Bestemmelse Av Relativ Bidrag Av Resonansformer Til Hybrid
de tre formene av nitrationet er identiske og har derfor samme stabilitet. Følgelig bidrar de like mye til hybrid. Resonansformene til de fleste resonansstabiliserte molekyler er forskjellige fra hverandre, slik at de ikke bidrar like til hybrid. Jo mer stabil resonansformen er, desto mer bidrar den til hybrid. Dermed krever bestemmelsen av relative bidrag eller resonansformer til hybrid bestemmelsen av deres relative stabilitet. Bruk følgende regler for å bestemme den relative stabiliteten til resonansformer. Regel 1: en resonansform der alle atomer har en oktett av valenselektroner, er mer stabil enn en der minst ett atom ikke gjør det. eg:
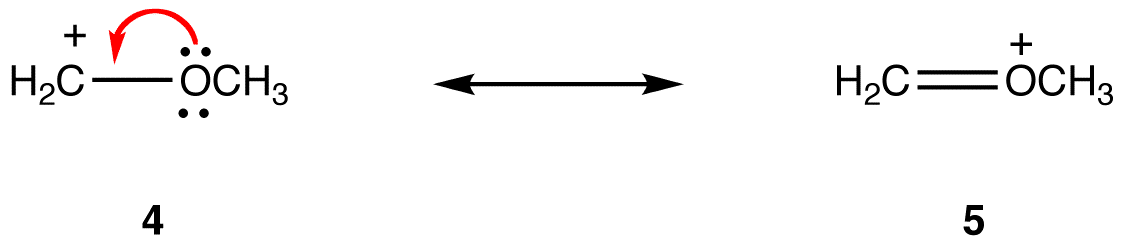
i resonansform 5 har alle atomer en oktett av valenselektroner; i 4 har ett atom, karbonatomet som bærer den formelle ladningen på +1, ikke. Dermed er resonansform 5 mer stabil enn resonansform 4.Regel 2: En resonansform som har en formell negativ ladning på et mer elektronegativt atom, er mer stabil enn en som har en formell negativ ladning på et mindre elektronegativt atom. eg:
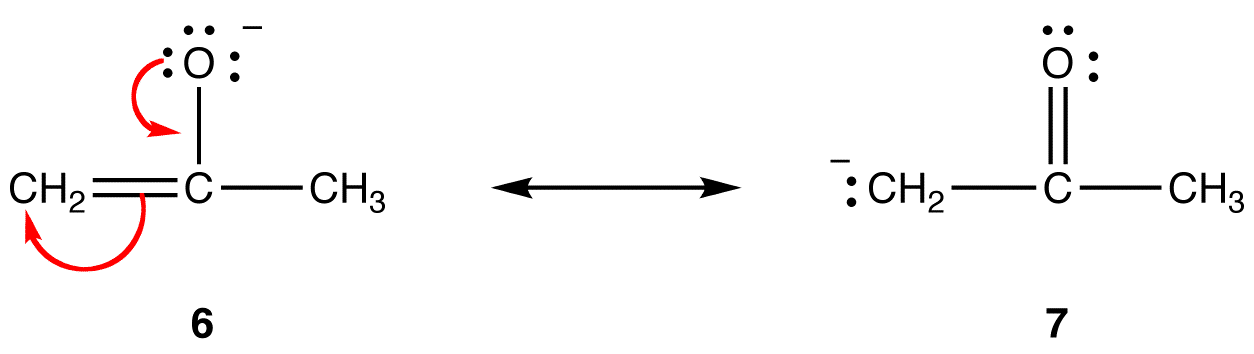
i resonansform 6 er den formelle negative ladningen på et oksygenatom; i 7 er det på et karbonatom. Oksygen er mer elektronegativ enn karbon. Dermed er resonansform 6 mer stabil enn resonansform 7.
trenden er motsatt med hensyn til formelle positive kostnader. Alt annet er lik, en resonansform som har en formell positiv ladning på et mindre elektronegativt atom er mer stabil enn en som har en formell positiv ladning på et mer elektronegativt atom. eg:
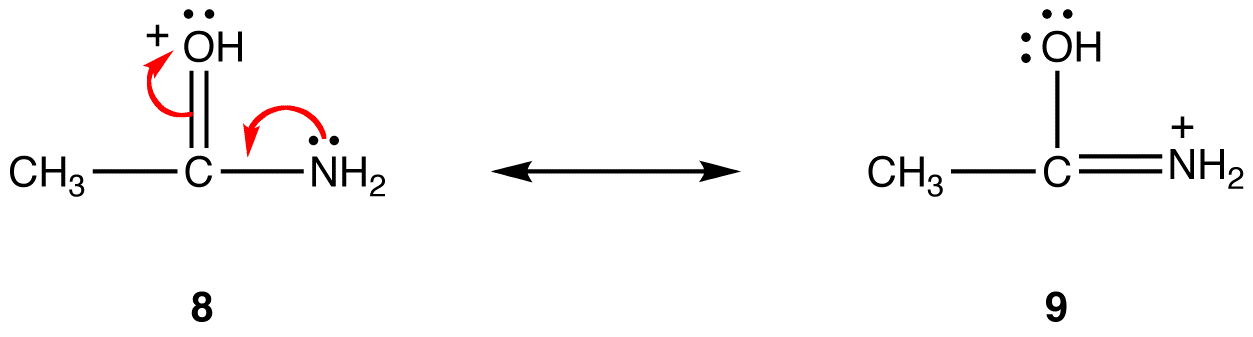
i resonansform 8 er den formelle positive ladningen på et oksygenatom; i 9 er det på et nitrogenatom. Nitrogen er mindre elektronegativ enn oksygen, og dermed er resonansform 9 mer stabil enn resonansform 8.
Regel 3:
alt annet er lik, en resonansform som ikke har en ladningsseparasjon, kalt en dipolar resonansform, er mer stabil enn en som gjør det. f. eks:
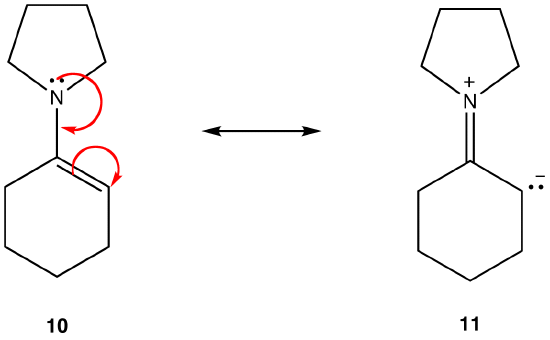
Resonansform 11 er en dipolar resonansform; 10 er ikke. Dermed er 10 mer stabil enn 11. Denne regelen er en konsekvens av vektorformen Av Coloumbs lov, ifølge hvilken motsatte kostnader tiltrekker seg. Konsekvensen er at for å holde motsatte ladninger skilt, er energi nødvendig, noe som betyr at 11 har høyere energi enn 10, så 10 er mer stabil enn 11.Regel 4: i dipolar resonansformer, alt annet er like, jo større avstanden mellom separerte ladninger, jo mer stabil resonansformen. f. eks:
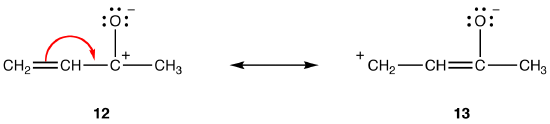
begge resonansformene 12 og 13 er dipolare resonansformer. Avstanden mellom de separerte ladningene er større i 13 (tre obligasjoner) enn i 12 (en binding), så 13 er mer stabil enn 12. Denne regelen er en konsekvens Av Den skalare formen Av Coloumbs lov, som sier at tiltrekningskraften mellom motsatte ladninger er omvendt proporsjonal med kvadratet av avstanden mellom dem. Dermed er energien som kreves for å holde de motsatte ladningene skilt i 12 høyere enn den i 13, noe som betyr at 12 har høyere energi enn 13, så 13 er mer stabil enn 12.ovennevnte regler kan ikke gjelde for resonans som involverer Elementer av Periode tre og under, på grunn av deres evne til å imøtekomme mer enn åtte elektroner i valensskallet. for eksempel:
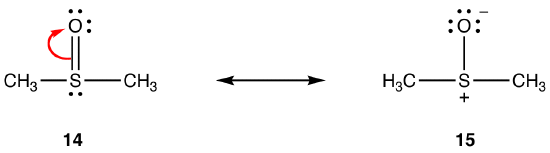
dobbeltbindingen i 14 består av en sigma-binding og en binding dannet ved overlapping av en 2p-orbital, som bærer to elektroner, i oksygenatomet og en tom 3d-orbital i svovelatomet. Disse to orbitalene har svært forskjellige energier, størrelser og former, så overlappingen mellom dem, kjent som en pn–dn-interaksjon, er svak. Følgelig er det lite dobbeltbindingskarakter i svovel-oksygenbindingen i hybrid, dvs. 15 er hovedresonansformen.
Bidragsytere og Attribusjoner
- Gamini Gunawardena fra Ochempal-siden (Utah Valley University)