Chemguide: Core Chemistry 14-16
Dobbel og trippel kovalente bindinger
Denne siden introduserer muligheten for flere (dobbel eller trippel) kovalente bindinger mellom atomer ved hjelp av oksygen, nitrogen, karbondioksid og eten som eksempler. Disse er valgt fordi de er alle vanligvis angitt PÅ UK pensum for 14-16 åringer.jeg antar at du har lest siden som introduserer kovalent binding og har tilgang til Et Periodisk Bord som det du kan laste ned fra dette nettstedet.
Dobbeltbinding i oksygen
hvis du ser opp oksygen I Det Periodiske Bordet, vil du finne at det har et atomnummer på 8-og så har det nøytrale atomet 8 protoner og 8 elektroner. Disse vil bli arrangert 2,6.
Så du har to atomer som dette:
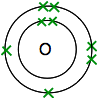
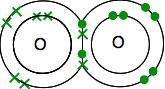
Hver har to uparede elektroner. For å få maksimal energisk stabilitet, må alle disse bli paret opp.
så oksygenene deler to par elektroner:
Dette er mye lettere å se ved hjelp av linjer for å representere par av delte elektroner:
![]()
Trippelbinding i nitrogen
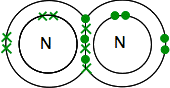
Hvis du finner nitrogen i det periodiske bordet vil du kunne finne ut at den elektroniske strukturen er 2,5. Sammenligner det med oksygen, har det derfor ett par elektroner og tre uparede elektroner i sitt ytre nivå.
for å gjøre det så energisk stabilt som mulig, må det koble alle disse opp i kovalente bindinger. To nitrogenatomer vil derfor kombinere på denne måten:
Dobbeltbinding i karbondioksid
er karbonens elektroniske struktur 2,4 med 4 uparede elektroner i ytre nivå.
Oksygen er 2,6 med 2 par elektroner og 2 uparede elektroner i ytre nivå.
Du må ende opp med alle elektronene paret – og det er bare en måte å gjøre det på.
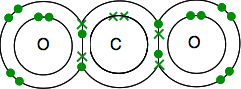
som før er bindingen lettere å se ved hjelp av linjer for liming av par elektroner.
![]()
hvis det er to bindingspar av elektroner mellom to atomer, kalles det ikke overraskende et dobbeltbinding. Så hvert oksygen er forbundet med karbonatomet i midten av en dobbeltbinding.
Dobbeltbinding i eten, C2H4
Eten og andre lignende forbindelser med dobbeltbindinger mellom karbonatomer er viktige stoffer i kjemi. Du vil møte dem mer detaljert senere i kurset.
Se nøye på punkt-og-kryss-diagrammet og vær sikker på at du forstår hvordan alt passer sammen. Det må være på denne måten slik at alle enkeltelektronene i både karbonene og hydrogenene er sammenkoblet i bindingspar.
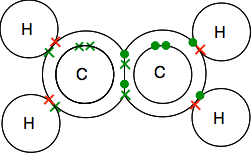
hvis du kommer over diagrammer som viser bindepar som linjer, kan du finne en av to versjoner.
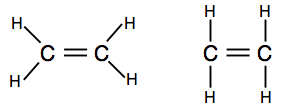
Den første viser molekylets faktiske form bedre, men den andre er også helt akseptabel på dette nivået.
Hvor vil du gå nå?
Til neste side i denne delen om kovalent binding . . .
til atomstrukturen og bonding-menyen . . .
Til Kjemi 14-16-menyen . . .
Til Chemguide Hovedmeny . . .