Egenskaper Av Kovalente Forbindelser
Når vi snakket om faste ioniske forbindelser i Ioniske Forbindelser, fant vi at deres egenskaper ofte stammer fra den sterke tiltrekningen av motsatte elektriske ladninger. Det bør ikke komme som en overraskelse å finne at egenskapene til kovalente forbindelser i stor grad skyldes naturen av kovalente bindinger.
En av de viktigste tingene å huske om kovalente forbindelser er at de ikke er ioniske. Dette virker åpenbart, men forskjellen er faktisk subtilere enn du kan forestille deg. For å illustrere dette konseptet, ta en titt på følgende figur:
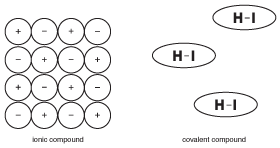
I Motsetning til ioniske forbindelser, hvor alle ioner i en stor krystall bidrar til å holde hverandre sammen, holdes molekylene i en kovalent forbindelse sammen av krefter kalt «intermolekylære krefter», som er mye svakere enn kjemiske bindinger (mer om intermolekylære krefter i Faste Stoffer). Som et resultat er molekylene i en kovalent forbindelse ikke tiltrukket av hverandre så mye som ioner i ioniske forbindelser. Denne forskjellen i struktur er viktig for å forstå egenskapene til kovalente forbindelser.
Kovalente Forbindelser Har Lave Smelte-og Kokepunkter
som nevnt i Ioniske Forbindelser, er det nødvendig med en stor mengde energi for å smelte en ionisk forbindelse på grunn av de sterke interaksjonene mellom kationene og anionene i en ionisk krystall. Men i kovalente forbindelser er alle molekyler bare svakt bundet til nabomolekyler; derfor tar det svært lite energi å skille kovalente molekyler fra hverandre.
Mange begynnende kjemistudenter tror feilaktig at når et kovalent molekyl smelter, brytes kovalente bindinger. Dette er falskt. Når ioniske forbindelser smelter, svikter den ioniske attraksjonen. Når kovalente forbindelser smelter, trekker molekylene bare bort fra hverandre, slik at bindingene blir intakte.
Kovalente Forbindelser Er Dårlige Ledere
Ioniske forbindelser er gode ledere av elektrisitet når de er oppløst eller smeltet. Som nevnt i Ioniske Forbindelser, er dette fordi ioniske forbindelser har mobile ioner som er i stand til å overføre elektrisk ladning fra ett sted til et annet. De leder også varme veldig bra fordi ionene er i orden ved siden av hverandre, noe som gjør det mulig for energi å overføres effektivt fra ett sted til et annet.
Kovalente forbindelser, derimot, er nesten alltid gode isolatorer av både elektrisitet og varme. Elektrisitet er ikke i stand til å utføre effektivt gjennom kovalente forbindelser fordi det ikke er noen ioner for å flytte den elektriske ladningen. Et utmerket eksempel på dette er i ditt eget hus, hvor metallet i skjøteledningene dine er dekket av plast for å unngå elektrokuting av katten din. Varme reiser heller ikke godt gjennom kovalente forbindelser fordi molekylene ikke er så tett holdt til hverandre som ioner i en ionisk forbindelse, noe som gjør varmeoverføring mindre effektiv. Dette er grunnen til at du bruker grytekluter til å ta kakene dine ut av ovnen i stedet for å belegge hendene med salt.
Kovalente Forbindelser Brenner noen Ganger
Organiske forbindelser er kovalente forbindelser som inneholder karbon. De inneholder vanligvis også hydrogen. og kan inneholde mindre mengder av andre elementer som nitrogen, svovel, fosfor, oksygen, eller noen av halogener.
Mange kovalente forbindelser er brannfarlige og brenner lett med tilsetning av varme. Hovedgruppen av kovalente forbindelser som er brannfarlige kalles organiske forbindelser. Organiske forbindelser brenner fordi de inneholder karbon og hydrogen, som begge kombinerer pent med oksygen ved høye temperaturer.
det er viktig å huske på at ikke alle kovalente forbindelser brenner?for eksempel er vann en kovalent forbindelse, og du vil ha svært vanskelig å starte en brann med den. Imidlertid er mange flere kovalente enn ioniske forbindelser brannfarlige.
Brennbarhet er en generell egenskap av kovalente forbindelser fordi et stort flertall av de kjente kovalente forbindelsene er organiske. Siden de fleste organiske forbindelser brenner, kan vi trygt liste dette som en egenskap av kovalente forbindelser, selv om det er mange kovalente forbindelser som ikke brenner.
Utdrag Fra Komplett Idiot Guide Til Kjemi 2003 Av Ian Guch. Alle rettigheter forbeholdt inkludert retten til reproduksjon helt eller delvis i enhver form. Brukes etter avtale Med Alpha Books, et medlem Av Penguin Group (USA) Inc.
for å bestille denne boken direkte fra utgiveren, besøk Penguin USA nettside eller ring 1-800-253-6476. Du kan også kjøpe denne boken På Amazon.com og Barnes & Edel.