Tilsetning av hydrogen til en karbon-karbon dobbeltbinding kalles hydrogenering. Den samlede effekten av et slikt tillegg er reduktiv fjerning av dobbeltbindingsfunksjonsgruppen. Regioselektivitet er ikke et problem, siden samme gruppe (et hydrogenatom) er bundet til hver av dobbeltbindingskarbonene. Den enkleste kilden til to hydrogenatomer er molekylært hydrogen (H2), men blanding av alkener med hydrogen resulterer ikke i noen merkbar reaksjon. Selv om den totale hydrogeneringsreaksjonen er eksoterm, forhindrer en høy aktiveringsenergi at den finner sted under normale forhold. Denne begrensningen kan omgåes ved bruk av en katalysator, som vist i følgende diagram.
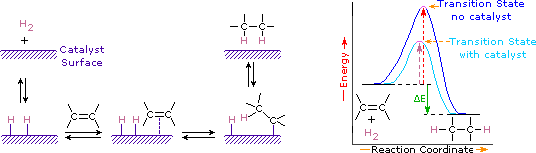
Katalysatorer er stoffer som endrer hastigheten (hastigheten) av en kjemisk reaksjon uten å bli konsumert eller vises som en del av produktet. Katalysatorer virker ved å senke aktiveringsenergien til reaksjoner, men de endrer ikke den relative potensielle energien til reaktantene og produktene. Finfordelte metaller, som platina, palladium og nikkel, er blant de mest brukte hydrogeneringskatalysatorene. Katalytisk hydrogenering foregår i minst to trinn, som vist i diagrammet. Først må alken adsorberes på overflaten av katalysatoren sammen med noe av hydrogenet. Deretter skifter to hydrogen fra metalloverflaten til karbonene i dobbeltbindingen, og det resulterende mettede hydrokarbonet, som er svakere adsorbert, forlater katalysatoroverflaten. Den nøyaktige naturen og tidspunktet for de siste hendelsene er ikke godt forstått.
som vist i energidiagrammet er hydrogeneringen av alkener eksoterm, og varme frigjøres tilsvarende DEN Δ (farget grønn) i diagrammet. Denne reaksjonsvarmen kan brukes til å evaluere den termodynamiske stabiliteten til alkener som har forskjellige antall alkylsubstituenter på dobbeltbindingen. For eksempel viser tabellen nedenfor hydrogeneringsvarmen for tre c5h10 alkener som gir det samme alkanproduktet (2-metylbutan). Siden en stor reaksjonsvarme indikerer en høy energireaktant, er disse varmene omvendt proporsjonale med stabilitetene til alken-isomerer. Til en grov tilnærming ser vi at hver alkylsubstituent på en dobbeltbinding stabiliserer denne funksjonelle gruppen med litt mer enn 1 kcal / mol.
| Alken Isomer | (CH3)2CHCH=CH2 3-metyl-1-buten |
CH2=C(ch3)ch2ch3 2-metyl-1-buten |
(ch3)2c=chch3 2-metyl-2-buten |
|---|---|---|---|
| reaksjonsvarmen | -30,3 kcal/MOL | -28,5 kcal/mol | -26,9 KCAL/MOL |
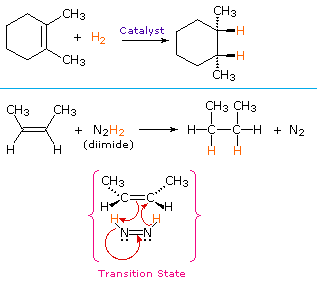
fra mekanismen Som Vises Her, Forventer vi at tilsetning av hydrogen skal skje med syn-STEREOSELEKTIVITET. Dette er ofte sant, men hydrogeneringskatalysatorene kan også forårsake isomerisering av dobbeltbindingen før hydrogentilsetning, i så fall kan stereoselektivitet være usikker.dannelsen av overgangsmetallkomplekser med alkener har blitt overbevisende demonstrert ved isolering av stabile platinakomplekser som Zeise ‘ s salt, K. H2O og ethylenebis(trifenylfosfin)platina, 2pt (H2C=CH2). I sistnevnte er platina tre-koordinat og nullvalent, Mens Zeises salt er et derivat av platina (II). En Modell Av Zeise salt og en diskusjon av den uvanlige bånd i slike komplekser kan sees ved å klikke her. Lignende komplekser er rapportert for nikkel og palladium, metaller som også fungerer som katalysatorer for alken hydrogenering.
en ikke-katalytisk prosedyre for syn-tilsetning av hydrogen gjør bruk av den ustabile forbindelsen diimid, N2H2. Dette reagenset må genereres i reaksjonssystemet, vanligvis ved oksidasjon av hydrazin, og den sterkt eksoterme reaksjonen favoriseres ved eliminering av nitrogengass (en meget stabil forbindelse). Diimid kan eksistere som cis-trans isomerer; bare cis-isomeren tjener som reduksjonsmiddel. Eksempler på alkenreduksjoner ved begge prosedyrer er vist nedenfor.
Bidragsytere
- William Reusch, Professor Emeritus (Michigan State U.), Virtuell Lærebok I Organisk Kjemi