Læringsmål
ved slutten av denne delen vil du kunne:
- Undersøke varmeoverføring.
- Beregn endelig temperatur fra varmeoverføring.
Så langt har vi diskutert temperaturendring på grunn av varmeoverføring. Ingen temperaturendring oppstår fra varmeoverføring hvis is smelter og blir flytende vann (dvs.under en faseendring). For eksempel, vurder vann som drikker fra ister som smelter på et tak som er oppvarmet Av Solen. Omvendt fryser vannet i en isbakke avkjølt av omgivelser med lavere temperatur.

Figur 1. Varme fra luften overføres til isen som forårsaker at den smelter. Energi er nødvendig for å smelte et fast stoff fordi de kohesive bindingene mellom molekylene i det faste stoffet må brytes fra hverandre slik at molekylene i væsken kan bevege seg rundt ved sammenlignbare kinetiske energier; dermed er det ingen temperaturstigning. På samme måte er det nødvendig med energi for å fordampe en væske, fordi molekyler i en væske interagerer med hverandre via attraktive krefter. Det er ingen temperaturendring før en faseendring er fullført. Temperaturen på en kopp brus til Å begynne MED VED 0 HRYVC forblir VED 0º til all isen har smeltet. Omvendt frigjøres energi under frysing og kondensering, vanligvis i form av termisk energi. Arbeid utføres av sammenhengende krefter når molekyler bringes sammen. Den tilsvarende energien må avgis (dissipated)for å tillate Dem Å holde Seg sammen Figur 2.energien involvert i en faseendring avhenger av to hovedfaktorer: antall og styrke av bindinger eller kraftpar. Antallet bindinger er proporsjonalt med antall molekyler og dermed til massen av prøven. Styrken av krefter avhenger av typen molekyler. Varmen Q som kreves for å endre fasen til en prøve av masse m er gitt ved
Q = mLf (smelting/frysing,
Q = mLv (fordampning/kondensering),
hvor latent fusjonsvarme, Lf og latent fordampningsvarme, Lv, Er materielle konstanter som bestemmes av den latente varmen.eksperimentelt. Se (Tabell 1).

Figur 2. (A) Energi er nødvendig for å delvis overvinne de attraktive kreftene mellom molekyler i et fast stoff for å danne en væske. Den samme energien må fjernes for frysing skal finne sted. (B) Molekyler separeres av store avstander når de går fra væske til damp, og krever betydelig energi for å overvinne molekylær tiltrekning. Den samme energien må fjernes for at kondens skal finne sted. Det er ingen temperaturendring før en faseendring er fullført.
Latent varme måles i enheter Av J / kg. Både Lf og Lv avhenger av stoffet, spesielt på styrken av dets molekylære krefter som nevnt tidligere. Lf og Lv kalles sammen latente varmekoeffisienter. De er latente eller skjulte, fordi i faseendringer går energi inn i eller forlater et system uten å forårsake temperaturendring i systemet; så i virkeligheten er energien skjult. Tabell 1 viser representative verdier For Lf og Lv, sammen med smeltepunkt og kokepunkt.
tabellen viser at betydelige mengder energi er involvert i faseendringer. La oss for eksempel se på hvor mye energi som trengs for å smelte et kilo is VED 0º for å produsere et kilo vann ved 0°C. Ved å bruke ligningen for temperaturendring og verdien for vann Fra Tabell 1 finner Vi At Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ er energien til å smelte et kilo is. Dette er mye energi da det representerer den samme mengden energi som trengs for å øke temperaturen på 1 kg flytende vann FRA 0º til 79.8 º. Enda mer energi er nødvendig for å fordampe vann; det ville ta 2256 kJ å bytte 1 kg flytende vann ved normalt kokepunkt (100º ved atmosfærisk trykk) til damp (vanndamp). Dette eksemplet viser at energien for en faseendring er enorm sammenlignet med energi knyttet til temperaturendringer uten faseendring.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Ta for eksempel det faktum at lufttemperaturer i fuktige klima sjelden går over 35,0 º, noe som skyldes at de fleste varmeoverføringer går inn i fordampningsvann i luften. På samme måte faller temperaturer i fuktig vær sjelden under duggpunktet fordi enorm varme frigjøres når vanndamp kondenserer.
vi undersøker effekten av faseendring mer presist ved å vurdere å tilsette varme til et utvalg av is ved −20º (Figur 3). Temperaturen på isen stiger lineært, absorberer varme med en konstant hastighet på 0.50 cal / g ⋅ º TIL den når 0º. En gang ved denne temperaturen begynner isen å smelte til all isen har smeltet, og absorberer 79,8 cal / g varme. Temperaturen forblir konstant VED 0º under denne faseendringen. Når all isen har smeltet, stiger temperaturen på det flytende vannet og absorberer varmen med en ny konstant hastighet på 1,00 cal / g ⋅ º. VED 100º begynner vannet å koke og temperaturen forblir konstant mens vannet absorberer 539 cal / g varme under denne faseendringen. Når all væske er blitt dampdamp, stiger temperaturen igjen, absorberer varme med en hastighet på 0,482 cal / g ⋅ º.
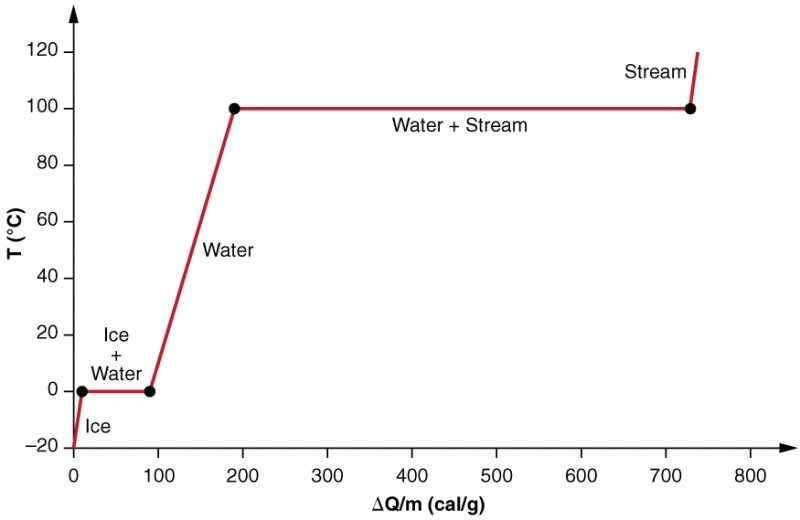
Figur 3. En graf av temperatur versus energi lagt til. Systemet er konstruert slik at ingen damp fordamper mens isen varmer å bli flytende vann, og slik at, når fordampning oppstår, damp forblir i systemet. De lange strekningene med konstante temperaturverdier VED 0 HRYVC og 100º reflekterer henholdsvis den store latente varmen av smelting og fordampning.
Vann kan fordampe ved temperaturer under kokepunktet. Mer energi er nødvendig enn ved kokepunktet, fordi den kinetiske energien til vannmolekyler ved temperaturer under 100º ER mindre enn VED 100º, og dermed er mindre energi tilgjengelig fra tilfeldige termiske bevegelser. Ta for eksempel det faktum at svette fra huden ved kroppstemperatur krever en varmetilførsel på 2428 kJ / kg, som er omtrent 10 prosent høyere enn den latente fordampningsvarmen VED 100º. Denne varmen kommer fra huden, og gir dermed en effektiv kjølemekanisme i varmt vær. Høy luftfuktighet hemmer fordampning, slik at kroppstemperaturen kan stige, og etterlater unevaporated svette på pannen.
Eksempel 1. Beregn Slutt Temperatur Fra Faseendring: Kjøling Brus Med Isbiter
Tre isbiter brukes til å kjøle en brus PÅ 20º med masse msoda = 0,25 kg. Isen er PÅ 0º og hver isbit har en masse på 6,0 g. Anta at bruset holdes i en skumbeholder slik at varmetapet kan ignoreres. Anta at bruset har samme varmekapasitet som vann. Finn den endelige temperaturen når all is har smeltet.
Strategi
isbitene har en smeltetemperatur PÅ 0º. Varme overføres fra brus til is for smelting. Smelting av is skjer i to trinn: først skjer faseendringen og solid (is) forvandles til flytende vann ved smeltetemperaturen, og temperaturen på dette vannet stiger. Smelting gir vann VED 0º, slik at mer varme overføres fra bruset til dette vannet til water plus soda-systemet når termisk likevekt, Qice = − Qsoda.
varmen som overføres til isen er
Qice = mus Lf + micecW(TF-0º).
varmen som avgis av brusen er Qsoda = msodacW(Tf−20º). Siden ingen varme går tapt, Qice = – Qsoda, slik at
mus Lf + micecW (Tf−0º) = – msodacW(Tf−20º).
Ta med alle vilkår som involverer Tf på venstre side og alle andre vilkår på høyre side. Løs for den ukjente mengden Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Løsning
- Identifiser kjente mengder. Massen av is er mus = 3 × 6.0 g = 0.018 kg og massen av soda er msoda = 0.25 kg.
- Beregn vilkårene i telleren: m sodacW (20º)=(0,25 kg) (4186 j/kg ⋅ º) (20º) = 20,930 J og micelf = (0,018 kg) (334,000 j/kg) = 6012 j.
- beregn nevneren: (msoda + mus) cw = (0,25 kg + 0.018 kg) (4186 k/(kg ⋅ º) = 1122 J/º.
- Beregn den endelige temperaturen: \displaystyle{T} _ {\text{f}}=\frac{20,930 \ text{ J}-6012 \ text{ J}}{1122\text{ J/}^{\circ} \ text{C}} = 13^{\circ} \ text{c}\\
Diskusjon
dette eksemplet illustrerer de enorme energiene som er involvert i en faseendring. Massen av is er omtrent 7 prosent massen av vann, men fører til en merkbar endring i temperaturen på brus. Selv om vi antok at isen var ved frysetemperaturen, er dette feil: den typiske temperaturen ER-6º. Denne korreksjonen gir imidlertid en slutttemperatur som i hovedsak er identisk med resultatet vi fant. Kan du forklare hvorfor?

Figur 4. Kondens på et glass iste. (kreditt: Jenny Downing)
vi har sett at fordampning krever varmeoverføring til en væske fra omgivelsene, slik at energi frigjøres av omgivelsene. Kondensering er omvendt prosess, og øker temperaturen i omgivelsene. Denne økningen kan virke overraskende, siden vi forbinder kondens med kalde gjenstander-glasset i figuren, for eksempel. Imidlertid må energi fjernes fra kondenserende molekyler for å lage en dampkondens. Energien er nøyaktig den samme som den som kreves for å gjøre faseendringen i den andre retningen, fra væske til damp, og så kan den beregnes Fra Q = mLv.
Kondens dannes i Figur 4 fordi temperaturen i den nærliggende luften reduseres til under duggpunktet. Luften kan ikke holde så mye vann som det gjorde ved romtemperatur, og så kondenserer vannet. Energi frigjøres når vannet kondenserer, noe som øker smeltingen av isen i glasset.
Real-World Søknad
Energi frigjøres også når en væske fryser. Dette fenomenet brukes av fruktdyrkere I Florida for å beskytte appelsiner når temperaturen er nær frysepunktet (0º). Dyrkere spray vann på plantene i frukthager slik at vannet fryser og varme slippes ut til de voksende appelsiner på trærne. Dette forhindrer at temperaturen i oransjen faller under frysing, noe som vil skade frukten.

Figur 14.11. Isen på disse trærne frigjorde store mengder energi når den frøs, noe som bidro til å forhindre at temperaturen på trærne faller under 0º. Vann sprøytes med vilje på frukthager for å forhindre hard frost. (kreditt: Hermann Hammer)
Sublimering er overgangen fra fast til dampfase. Du har kanskje lagt merke til at snø kan forsvinne i tynn luft uten spor av flytende vann, eller at isbiter forsvinner i en fryser. Det motsatte er også sant: Frost kan danne seg på svært kalde vinduer uten å gå gjennom væsketrinnet. En populær effekt er å lage «røyk» fra tøris, som er fast karbondioksid. Sublimering oppstår fordi likevektsdamptrykket av faste stoffer ikke er null. Visse luftfriskere bruker sublimering av et fast stoff for å injisere en parfyme inn i rommet. Moth baller er et litt giftig eksempel på en fenol (en organisk forbindelse) som sublimerer, mens noen faste stoffer, som osmiumtetroksid, er så giftige at de må holdes i forseglede beholdere for å hindre menneskelig eksponering for deres sublimering-produserte damper.

Figur 5. Direkte overganger mellom solid og damp er vanlige, noen ganger nyttige, og til og med vakre. Tørris sublimerer direkte til karbondioksidgass. Den synlige dampen er laget av vanndråper. (kreditt: Windell Oskay) (B) Frost danner mønstre på et veldig kaldt vindu, et eksempel på et fast stoff dannet direkte fra en damp. (kreditt: Liz West)
alle faseoverganger involverer varme. Ved direkte solid-dampoverganger er energien som kreves gitt Av ligningen Q = mLs, Hvor Ls er varmen av sublimering, som er energien som kreves for å endre 1.00 kg av et stoff fra den faste fasen til dampfasen. Ls er analog Med Lf og Lv, og verdien avhenger av stoffet. Sublimering krever energiinngang, slik at tøris er et effektivt kjølevæske, mens omvendt prosess (dvs.frosting) frigjør energi. Mengden energi som kreves for sublimering er av samme størrelsesorden som for andre faseoverganger.
materialet som presenteres i denne delen og den foregående delen tillater oss å beregne en rekke effekter knyttet til temperatur og faseendring. I hvert tilfelle er det nødvendig å identifisere hvilke temperatur – og faseendringer som finner sted og deretter bruke riktig ligning. Husk at varmeoverføring og arbeid kan føre til både temperatur-og faseendringer.
Problemløsningsstrategier for Effekten Av Varmeoverføring
- Undersøk situasjonen for å fastslå at det er en endring i temperatur eller fase. Er det varmeoverføring inn i eller ut av systemet? Når tilstedeværelsen eller fraværet av en faseendring ikke er åpenbar, kan du først løse problemet som om det ikke var noen faseendringer, og undersøke temperaturendringen som er oppnådd. Hvis det er tilstrekkelig å ta deg forbi et kokende eller smeltepunkt, bør du gå tilbake og gjøre problemet i trinn-temperaturendring—faseendring, påfølgende temperaturendring og så videre.
- Identifiser og list alle objekter som endrer temperatur og fase.
- Identifiser nøyaktig hva som må bestemmes i problemet(identifiser de ukjente). En skriftlig liste er nyttig.
- Lag en liste over hva som er gitt eller hva som kan utledes av problemet som nevnt(identifiser knowns).
- Løs riktig ligning for mengden som skal bestemmes (det ukjente). Hvis det er en temperaturendring, avhenger den overførte varmen av den spesifikke varmen (Se Tabell 1 I Temperaturendring og Varmekapasitet), mens for en faseendring avhenger den overførte varmen av latent varme. Se Tabell 1.
- Erstatt knowns sammen med sine enheter i riktig ligning og få numeriske løsninger komplett med enheter. Du må gjøre dette i trinn hvis det er mer enn ett trinn i prosessen(for eksempel en temperaturendring etterfulgt av en faseendring).
- Sjekk svaret for å se om det er rimelig: er det fornuftig? For eksempel, vær sikker på at temperaturendringen ikke også forårsaker en faseendring som du ikke har tatt hensyn til.
Sjekk Din Forståelse
hvorfor forblir snø på fjellskråninger selv når dagtemperaturen er høyere enn frysetemperaturen?
Løsning
Snø er dannet fra iskrystaller og er dermed den faste fasen av vann. Fordi enorm varme er nødvendig for faseendringer, tar det en viss tid før denne varmen akkumuleres fra luften, selv OM luften er over 0º. Jo varmere luften er, desto raskere oppstår denne varmevekslingen og jo raskere snøen smelter.
Seksjonssammendrag
- de fleste stoffer kan eksistere enten i faste, flytende og gassformer, som refereres til som » faser.»
- Faseendringer skjer ved faste temperaturer for et gitt stoff ved et gitt trykk, og disse temperaturene kalles kokende og frysende (eller smeltepunkter).
- under faseendringer blir varme absorbert eller frigjort gitt Ved: Q = mL hvor L er latent varmekoeffisient.
Konseptuelle Spørsmål
- Varmeoverføring kan forårsake temperatur-og faseendringer. Hva annet kan forårsake disse endringene?
- Hvordan bidrar latent fusjonsvarme til å redusere lufttemperaturen, kanskje hindre at temperaturen faller betydelig under º, i nærheten av store vannkilder?
- hva er isens temperatur rett etter at den er dannet ved å fryse vann?
- hva skjer hvis DU plasserer º is i º vann i en isolert beholder? Vil noe is smelte, vil mer vann fryse, eller vil det heller ikke skje?
- Hvilken effekt har kondens på et glass isvann på hastigheten som isen smelter? Vil kondensasjonen øke smelteprosessen eller redusere den?
- I svært fuktige klima der det er mange vannmasser, som For Eksempel I Florida, er det uvanlig at temperaturen stiger over 35º (95º). I ørkener kan imidlertid temperaturene stige langt over dette. Forklar hvordan fordampning av vann bidrar til å begrense høye temperaturer i fuktige klima.om vinteren er Det ofte varmere I San Francisco enn I Nærliggende Sacramento, 150 km inn i landet. Om sommeren er det nesten alltid varmere I Sacramento. Forklar hvordan vannmassene rundt San Francisco modererer sine ekstreme temperaturer.
- Å sette et lokk på en kokende gryte reduserer varmeoverføringen som er nødvendig for å holde den kokende. Forklar hvorfor.
- Frysetørket mat har blitt dehydrert i vakuum. Under prosessen fryser maten og må oppvarmes for å lette dehydrering. Forklar både hvordan vakuumet øker dehydrering og hvorfor maten fryser som et resultat.
- når luften fortsatt avkjøles ved å utstråle om natten, er det uvanlig at temperaturen faller under duggpunktet. Forklar hvorfor.
- i en fysisk klasseromsdemonstrasjon blåser en instruktør opp en ballong gjennom munnen og kjøler den deretter ned i flytende nitrogen. Når det er kaldt, har den krympede ballongen en liten mengde lyseblå væske i den, så vel som noen snølignende krystaller. Når det varmes opp, kokes væsken, og en del av krystallene sublimerer, med noen krystaller som dveler for en stund og deretter produserer en væske. Identifiser den blå væsken og de to faste stoffene i den kalde ballongen. Rettferdiggjør identifikasjonene dine ved hjelp av Data Fra Tabell 1.
Problemer& Øvelser
- Hvor mye varmeoverføring (i kilokalorier) kreves for å tine en 0,450 kg pakke med frosne grønnsaker opprinnelig PÅ 0º hvis deres fusjonsvarme er den samme som for vann?
- en pose som inneholder 0º is er mye mer effektiv i å absorbere energi enn en som inneholder samme mengde 0º vann. (A) hvor mye varmeoverføring er nødvendig for å heve temperaturen på 0.800 kg vann fra 0º til 30.0 º? (b) hvor mye varmeoverføring er nødvendig for å smelte først 0.800 kg 0º is og deretter øke temperaturen? (C) Forklar hvordan svaret ditt støtter påstanden om at isen er mer effektiv.
- (A) Hvor mye varmeoverføring kreves for å øke temperaturen på en 0,750 kg aluminiumspotte som inneholder 2,50 kg vann fra 30,0 º til kokepunktet og kok deretter 0,750 kg vann? (b) Hvor lang tid tar dette hvis varmeoverføringshastigheten er 500 W 1 watt = 1 joule/sekund (1 W = 1 J / s)?
- dannelsen av kondens på et glass isvann fører til at isen smelter raskere enn det ellers ville. Hvis 8.00 g kondens dannes på et glass som inneholder både vann og 200 g is, hvor mange gram isen vil smelte som et resultat? Anta at ingen annen varmeoverføring oppstår.
- på en tur legger du merke til at en 3,50 kg ispose varer i gjennomsnitt en dag i kjøleren din. Hva er gjennomsnittlig effekt i watt som kommer inn i isen hvis den starter VED 0º og smelter helt TIL 0º vann på nøyaktig en dag 1 watt = 1 joule / sekund (1 W = 1 J/s)?
- På en bestemt tørr solskinnsdag vil temperaturen i et svømmebasseng stige med 1,50 º hvis ikke for fordampning. Hvilken brøkdel av vannet må fordampe for å bære bort akkurat nok energi til å holde temperaturen konstant?
- (A) Hvor mye varmeoverføring er nødvendig for å øke temperaturen på et 0,200 kg isstykke fra -20,0 º til 130º, inkludert energien som trengs for faseendringer? (b) Hvor mye tid kreves for hvert trinn, forutsatt en konstant 20,0 kJ / s varmeoverføringshastighet? (C) Lag en graf av temperatur versus tid for denne prosessen.
- I 1986 brøt et gigantisk isfjell bort Fra Rossisen I Antarktis. Det var omtrent et rektangel 160 km langt, 40.0 km bred og 250 m tykk. (A) hva er massen av dette isfjellet, gitt at isens tetthet er 917 kg / m3? (B) Hvor mye varmeoverføring (i joules) er nødvendig for å smelte den? (c) hvor mange år vil det ta sollys alene for å smelte is så tykk, hvis isen absorberer et gjennomsnitt på 100 W / m2, 12.00 h per dag?
- Hvor mange gram kaffe må fordampe fra 350 g kaffe i en 100 g glasskopp for å avkjøle kaffen fra 95.0 º til 45.0 º? Du kan anta at kaffen har de samme termiske egenskapene som vann, og at gjennomsnittlig fordampningsvarme er 2340 kJ/kg (560 cal / g). (Du kan forsømme endringen i massen av kaffen når den avkjøles, noe som vil gi deg et svar som er litt større enn riktig.)
- (a) det er vanskelig å slukke en brann på en råoljetanker, fordi hver liter råolje frigjør 2,80 × 107 j energi når den brennes. For å illustrere denne vanskeligheten, beregne antall liter vann som må brukes til å absorbere energien som frigjøres ved å brenne 1,00 L råolje, hvis vannet har sin temperatur hevet fra 20,0 ºC TIL 100º, koker det, og den resulterende dampen heves TIL 300º. (B) Drøfte ytterligere komplikasjoner som skyldes at råolje har en mindre tetthet enn vann.
- energien frigjort fra kondens i tordenvær kan være veldig stor. Beregn energien som slippes ut i atmosfæren for en liten storm på radius 1 km, forutsatt at 1, 0 cm regn faller jevnt over dette området.
- for å forhindre frostskader sprøytes 4,00 kg 0º vann på et frukttre. (A) Hvor mye varmeoverføring skjer når vannet fryser? (b) Hvor mye vil temperaturen på 200 kg treet reduseres hvis denne mengden varme overføres fra treet? Ta den spesifikke varmen til å være 3,35 kJ / kg · º, og anta at ingen faseendring skjer.
- En 0.250-kg aluminiumskål som holder 0.800 kg suppe på 25.0 º er plassert i en fryser. Hva er den endelige temperaturen hvis 377 kJ energi overføres fra bolle og suppe, forutsatt at suppens termiske egenskaper er de samme som for vann?
- en 0.0500 kg isbit ved -30.0 º er plassert i 0.400 kg 35.0 º vann i en meget godt isolert beholder. Hva er den endelige temperaturen?
- hvis du heller 0.0100 kg 20.0 º vann på en 1.20-kg isblokk(som i utgangspunktet er på -15.0 º), hva er den endelige temperaturen? Du kan anta at vannet kjøler så raskt at effektene av omgivelsene er ubetydelige.Urfolk koker noen ganger i vanntette kurver ved å plassere varme steiner i vann for å få det til å koke. Hvilken masse AV 500 ④ STEIN må plasseres i 4.00 kg av 15.0 º vann for Å bringe temperaturen TIL 100º, hvis 0.0250 kg vann slipper ut som damp fra den opprinnelige sizzle? Du kan overse effektene av omgivelsene og ta den gjennomsnittlige spesifikke varmen av bergarter som granitt.
- Hva ville være den endelige temperaturen på pannen og vannet Ved Beregning Av Den Endelige Temperaturen Når Varmen Overføres Mellom To Legemer: Helles Kaldt Vann i En Varm Panne hvis 0,260 kg vann ble plassert i pannen og 0,0100 kg av vannet fordampet umiddelbart, slik at resten kommer til en vanlig temperatur med pannen?
- i noen land brukes flytende nitrogen på melkebiler i stedet for mekaniske kjøleskap. En 3.00-timers leveringstur krever 200 L flytende nitrogen, som har en tetthet på 808 kg / m3. (A) Beregne varmeoverføringen som er nødvendig for å fordampe denne mengden flytende nitrogen og øke temperaturen til 3,00 º. (Bruk cp og anta at det er konstant over temperaturområdet.) Denne verdien er mengden kjøling av flytende nitrogenforsyninger. (B) hva er denne varmeoverføringshastigheten i kilowatt-timer? (C) Sammenlign kjølemengden som oppnås ved smelting av en identisk masse PÅ 0º is med den fra fordampning av flytende nitrogen.
- noen pistol fanciers lage sine egne kuler, som innebærer smelting og støping av bly snegler. Hvor mye varmeoverføring er nødvendig for å øke temperaturen og smelte 0.500 kg bly, fra 25.0 º?
Ordliste
varme av sublimering: energien som kreves for å endre et stoff fra fast fase til dampfasen
latent varmekoeffisient: en fysisk konstant lik mengden varme som overføres for hver 1 kg av et stoff under endringen i fase av stoffet
sublimering: overgangen fra den faste fasen til dampfasen
Valgte Løsninger på Problemer& Øvelser
1. 35,9 kcal
3. (a) 591 kcal; (b) 4,94 × 103 s
5. 13,5 W
7. (a) 148 kcal; (b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. (a) 9.67 L; (b) Råolje er mindre tett enn vann, så det flyter på toppen av vannet, og dermed utsette den for oksygen i luften, som den bruker til å brenne. Også, hvis vannet er under oljen, er det mindre effektivt å absorbere varmen som genereres av oljen.
12. (a) 319 kcal; (b) 2.00 º
14. 20.6 º
16. 4,38 kg
18. (a) 1.57 × 104 kcal; (b) 18.3 kW ⋅ h; (c) 1.29 × 104 kcal
- verdier oppgitt ved normal smelte-og koketemperatur ved standard atmosfærisk trykk (1 atm). ↵
- ved 37.0 º (kroppstemperatur) er fordampningsvarmen Lv for vann 2430 kJ/kg eller 580 kcal/kg ↵
- ved 37.0 º (kroppstemperatur) er fordampningsvarmen Lv for vann 2430 kJ/kg eller 580 kcal/kg ↵