en 49 år gammel mann med en historie med alkoholmisbruk presenterer ED med klager på generalisert magesmerter og oppkast i de siste 36 timene. Pasienten er kjent for avdelingen for alkoholrelaterte besøk og fortsetter å drikke daglig. Ved ankomst er han takykardisk og tachypneisk, og fysiske undersøkelsesfunn inkluderer tørre slimhinner, redusert sakin turgor, epigastrisk ømhet og tremor i begge hender. Laboratoriestudier viser et serumbikarbonat på 10 mEq / L, et aniongap på 30, en serumglukose på 95 mg / dL, en laktacidose med pH 7,2, hypofosfatemi og spor ketonuri. Abdominal CT-skanning er normal. Han nekter en historie med diabetes mellitus, inntak av giftige alkoholer eller nylig sykdom.denne pasienten kan potensielt ha en av mange diagnoser, men hans presentasjon og laboratoriefunn er mest konsistente med alkoholisk ketoacidose (AKA). AKA kan være en vanlig ED-diagnose og forekommer vanligvis hos kroniske alkoholdrikkere som har en abrupt opphør i alkoholinntaket kombinert med redusert glykemisk inntak og intravaskulær volumdeplesjon.1
i de fleste tilfeller fører en utfellende hendelse som pankreatitt, gastritt eller aspirasjonspneumoni til en abrupt nedgang i oral inntak. Omtrent 24 til 72 timer etter opphør AV PO inntak, KAN AKA utvikle seg.2 Disse pasientene har vanligvis lav eller fraværende serumalkoholkonsentrasjon og kan presentere med varierende grad av alkoholabstinens. Imidlertid er et klart sensorium et kjennetegn på denne tilstanden. Tilstedeværelsen av en endring i bevissthet tyder sterkt på at en annen prosess er tilstede.3
Selv om den underliggende patofysiologien er kompleks, hjelper en riktig forståelse sterkt i diagnosen og styringen av denne tilstanden.Det er tre generelle begreper som driver AKA: Alkoholinntak, forsterket med redusert kaloriinntak og dehydrering, favoriserer en ketotisk tilstand.Ketoacidose er forårsaket av en kombinasjon av faktorer, inkludert sultindusert hypoinsulinemi, oksidasjon av alkohol til dets forskjellige ketonmetabolitter, lipolyse med fri fettsyre (FFA) – frigjøring og intravaskulær volumkontraksjon. Den relative sultestaten i AKA fører til overdreven glukagonsekresjon og reduserte perifere insulinkonsentrasjoner, som spiller en nøkkelrolle i utviklingen av ketoacidose. Metabolisme av fett gjennom lipolyse produserer beta-hydroksybutyrat (BHB) og acytylacetat (ACA). Disse ketonene brukes til cellulær respirasjon for å gi energi gjennom adenosintrifosfat (ATP) produksjon, men legger til aniongapet acidose sett I AKA.
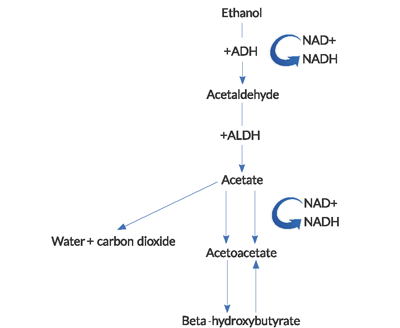
- under metabolismen av etanol genereres høye mengder NADH (den reduserte formen av nikotinamid-adenindinukleotid).4 NAD+ ER et koenzym som brukes til å bære elektroner i intracellulære redoksreaksjoner. Reduksjonen AV NAD+ og påfølgende akkumulering og ubalanse AV NADH i metabolismen av etanol har flere viktige konsekvenser. BHB-generasjonen dominerer over PRODUKSJONEN AV ACA i dette høye NADH TIL NAD + – forholdet. Dette unormale forholdet fører til en hemming av sitronsyresyklusen og hepatisk glukoneogenese, noe som delvis forklarer hvorfor hyperglykemi er sjelden hos disse pasientene.Nesten counterintuitively, det er en manglende evne til å regenerere normale nivåer AV NAD+ og ACA I AKA. Reoksideringen AV NADH til NAD+ ser ut til å være begrenset av en kombinasjon av faktorer, inkludert hypofosfatemi og en funksjonell blokk i mitokondriene.2laktisk acidose sett I AKA skyldes en unormal redoks tilstand. Pyruvat er et substrat som brukes i mange energiproducerende veier, men i alkoholisk ketoacidose blir den skiftet fra sine normale metabolske veier til andre som øker laktatproduksjonen. I tillegg er regenerering av pyruvat fra melkesyre svekket.
- en økt adrenerg tilstand og volumdeplesjon forverrer ketose og hemmer glukoneogenese, og skaper en tilstand som favoriserer opprettelse og vedlikehold av et ketotisk miljø.
kroppen reagerer på sult, dehydrering og hypoglykemi med frigjøring av motregulerende hormoner. Disse hormonene øker sympatisk tone, reduserer insulinfrigivelse og øker ketonkonsentrasjonen gjennom frigjøring Av FFAs og redusert perifer ketonmetabolisme. Alle disse endringene opprettholder ketotisk tilstand til glukose gjeninnføres i systemet. Signifikant dehydrering på grunn av oppkast og redusert oral inntak fører til nedsatt nyreketonclearance, noe som ytterligere forverrer situasjonen.2differensialdiagnosen FOR AKA bør inkludere sulteketose og diabetisk ketoacidose (dka). Selv om en grundig historie kan bidra til å begrense differensialet, er et metabolsk panel viktig for å bekrefte diagnosen. Aniongap på 30 mEq / L eller mer kan ses I AKA, selv om gapet kan bli skjult av en samtidig primær metabolsk alkalose på grunn av oppkast. Faktisk er det tilfeller av pasienter MED AKA som har et alkalemisk serum pH på grunn av overdreven oppkast.Aniongapet i sulteketose er vanligvis mye lavere, med bikarbonatnivåer sjelden under 18 mEq / L, og serum pH vanligvis over 7.30.2 I DKA, derimot, kan aniongapet være ganske høyt, med bikarbonatnivåer som ofte når enkeltsifrene. Hyperglykemi med glykosuri, vanligvis sett i diabetisk ketoacidose (DKA), er sjelden MED AKA.4 Kronisk underernæring fører til lave glykogenreserver, og den økte adrenerge tonen fører til hemming av hepatisk glukoneogenese. Ketonuri, tilstede i alle tre av disse forholdene, kan forstyrre alvorlighetsgraden AV AKA.Ketonuri måles ved nitroprussid-testen, hvor en fargeendring indikerer den relative konsentrasjonen av aceton og ACA i urinen. TILSTEDEVÆRELSEN AV BHB, den mest fremtredende keton tilstede I AKA, reflekteres ikke av nitroprusside testen. Dette forklarer hvorfor PASIENTER MED AKA kan vise ingen eller bare liten ketonuri ved første presentasjon, med en paradoksal økning ettersom tilstanden reverseres. SOM ACA:BHB-forholdet normaliserer, blir BÅDE detekterbar ACA og BHB ryddet i urinen.
Differensialdiagnose
andre livstruende tilstander som kan forårsake en signifikant aniongapacidose bør også vurderes i differensialdiagnosen. Giftige alkoholer, spesielt metanol og etylenglykol, kan inntas med vilje eller ved et uhell i denne pasientpopulasjonen. Disse inntakene kan forårsake betydelig morbiditet og mortalitet hvis de ikke håndteres på riktig måte.5 Endret mental status er et vanlig trekk ved giftig alkoholinntak, men er vanligvis ikke sett I AKA.5
Pasienter vil typisk ha et innledende osmolært gap som overgår til et økt aniongap etter hvert som giftig alkohol metaboliseres. Forhøyet serum BHB konsentrasjon kan være ganske forhøyet I AKA, men dette utelukker ikke nødvendigvis muligheten for giftig alkoholinntak; heller ikke fravær av en osmolar eller anion gap utelukke diagnosen. Mens pasienter I AKA har en liten melkesyreacidose, bør tilstedeværelsen av et signifikant forhøyet laktatnivå be om søket etter en underliggende sykdom. Sjelden kan EN kombinasjon AV AKA og en av disse andre hendelsene forekomme og presentere en diagnostisk gåte. Gjennomtenkt vurdering av timing, type og mengde inntak og tilhørende symptomer, i kombinasjon med observasjon og laboratoriestudier, må brukes til å gjøre denne differensieringen dersom en klar og nøyaktig historie mangler.
Behandling
reversering av ketose og kraftig rehydrering er sentral i styringen AV AKA. I tillegg til isotonisk væskeutskifting er det nødvendig med dextroseholdige intravenøse væsker. Vanligvis gir 5% dextrose med halv normal saltvann med en hastighet på 150 mL per time tilstrekkelig glukose for å stimulere bukspyttkjertelen til å utskille insulin, slik at perifert vev kan metabolisere ketoner og hemme ffa-frigjøring.2 Det tillater også kroppen å regenerere NAD+, som er hemmet av metabolske endringer forårsaket AV AKA. Intravenøs infusjon med dekstroseholdig væske bør stoppes når bikarbonatnivåene har nådd 18-20 mEq / L og pasienten tolererer oralt inntak. Dette skjer vanligvis 8 til 16 timer etter behandlingsstart.2 alkoholabstinens hos disse pasientene bør håndteres aggressivt med intravenøse benzodiazepiner. Tiamin, folat og andre elektrolytter, spesielt fosfat og kalium, må kanskje repleteres hos disse pasientene.6 Interessant er flertallet av sykelighet sett I AKA på grunn av den underliggende prosessen som forårsaket opphør av alkohol.
Case konklusjon
pasienten fikk 4 liter normal saltvann og ble startet På D5-1/2 NS før opptak. Han ble gitt iv valium for alkoholabstinens, og tiamin, folat og fosfat ble replet. Han ble innlagt på sykehus i tre dager for behandling AV AKA og alkoholabstinens, deretter utskrevet når tolerere oral inntak og i god stand. Han ble sett tre uker senere i akuttmottaket for en lignende presentasjon.
Tabell 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Vei for alkoholmetabolisme
(ADH = alkoholdehydrogenase, ALDH = acetaldehyd dehydrogenase).
- Palmer, Jerry P. Alkoholisk ketoacidose: Klinisk og laboratorie presentasjon, patofysiologi og behandling. Klinikker i endokrinologi og metabolisme 12.2 (1983): 381-389.
- Duffens K, Marx JA. Alkoholholdig ketoacidosisa gjennomgang.Journal of emergency medicine 5.5 (1987): 399-406.
- Wrenn KD, Slovis CM, Minion GE, Et al. Syndromet av alkoholisk ketoacidose. Den Amerikanske journal of medicine 91.2 (1991): 119-128.
- Marx JA, Hockberger RS, Walls RM, et al. eds. Rosens™ Akuttmedisin: Begreper Og Klinisk Praksis. Philadelphia, PA: Mosby/ Elsevier; 2013. Kapittel 185 Alkoholrelatert Sykdom Av John T. Finnell.
- Kraut JA, Kurtz I. â € œ alkoholinntak: kliniske egenskaper, diagnose og ledelse. Klinisk Journal Av American Society Of Nephrology 3.1 (2008): 208-225.
- Miller Pd, Heinig R, Waterhouse C. Behandling av alkoholisk acidose: rollen av dextrose og fosfor. Arkiv for internmedisin 138.1 (1978): 67-72.